三丁基锡对褐菖鮋精巢性激素受体表达的影响*
2012-01-05张纪亮朱文文熊建利郭黛健
张纪亮,朱文文,孙 平,熊建利,郭黛健
(1.河南科技大学 动物科技学院,河南 洛阳471003;2.洛阳师范学院,河南 洛阳471022)
三丁基锡对褐菖鮋精巢性激素受体表达的影响*
张纪亮1,朱文文1,孙 平1,熊建利1,郭黛健2
(1.河南科技大学 动物科技学院,河南 洛阳471003;2.洛阳师范学院,河南 洛阳471022)
三丁基锡(Tributyltin,TBT)能够影响鱼类生殖功能,而有关TBT对鱼类生殖细胞发育至关重要的雄激素和雌激素受体的影响还未见报道。本实验以海洋经济鱼类褐菖鲉(Sebastiscusmarmoratus)为对象,研究环境水平TBT(1,10和100ng/L)对精巢雄激素和雌激素受体表达的影响。结果表明,TBT暴露能够抑制褐菖鲉精巢发育和精巢雌激素受体蛋白的水平,并且发现雌激素受体主要定位于精巢精小叶腔间隙。小叶腔间隙的雌激素受体蛋白水平降低可能影响支持细胞和间隙细胞的正常功能,从而影响精巢的正常发育。TBT暴露对雄激素受体的表达并没有显著的影响。该结果为全面了解TBT产生鱼类生殖毒性效应、途径和机制提供了新的重要的资料。
三丁基锡;褐菖鮋;精巢;雌激素受体
(王佳实 编辑)
有机锡化合物,特别是三丁基锡(Tributyltin,TBT),被广泛用于海洋船只防污涂料。Jiang等[1]对大连、天津、青岛、北海、秦皇岛和烟台等港口采样测定,发现样点无一例外地存在TBT污染,污染程度从0.5 ng/L(低于检测极限)到几百ng/L。研究表明,有机锡能够影响动物生殖功能,干扰体内激素的分泌,造成生殖和遗传方面的不良后果[2]。激素核受体在生殖和发育中可能起重要作用,核受体与配体结合活化,进入核内与靶基因中的激素反应元件结合,激活或抑制靶基因的表达,调节机体的生长发育和生殖。与生殖细胞的发育有关的受体主要包括雌激素受体(Estrogen receptor,ER)和雄激素受体(Androgen receptor,AR)。而三丁基锡对鱼类这两种核受体的影响还未见报道。
本实验以海洋经济鱼类褐菖鲉(Sebastiscusmarmoratus)为对象,研究环境水平TBT(1,10和100 ng/L)对精巢性激素受体表达的影响。褐菖鲉是一种卵胎生、体内受精的硬骨鱼,容易采集,在实验室容易饲养,适合作为生态毒理学的研究对象。
1 材料与方法
1.1 实验动物
褐菖鲉采于福建厦门海域,体重25~50g。雄性有乳白色突起状的生殖器,根据此特征选择雄性实验鱼。实验鱼先在清洁沙滤海水中暂养7d,用充气机连续充气。
1.2 污染实验
TBT(纯度≥97%,Fluka公司,美国)先用无水乙醇配制成一定质量浓度的储备液,避光于4℃保存,实验前用砂滤海水分别配制成1,10和100ng/L三种质量浓度。对照组的每升海水中加入1μL无水乙醇。每组30只褐菖鮋分别于60L不同质量浓度的TBT的水体中饲养。每日更换一半相同污染质量浓度的海水。取样前3d停止喂食。实验期间水温14±2℃,S为22~24。暴露50d后取样。精巢放入中性甲醛固定液中固定,用于组织学观察。
1.3 组织化学
按照免疫组化试剂盒说明书(华美生物,中国洛阳)操作:切片脱蜡至水,3%双氧水甲醇溶液中浸洗10 min去除内源性过氧化物酶,接着在柠檬酸盐缓冲液中微波抗原修复10min,正常小牛血清37℃封闭30 min;滴加1:100稀释的兔抗人ER或兔抗鼠AR受体抗体(一抗,NeoMarkers,美国),置4℃过夜,磷酸盐缓冲液(Phosphate buffer saline,PBS)洗3次;滴加生物素化羊抗兔IgG抗体(二抗),置37℃30min,PBS洗3次;滴加SABC-Cy3,置37℃30min,PBS洗4次,DAB显色,苏木精复染。阴性对照用正常兔血清IgG代替一抗,其余步骤相同。组织切片在Olympus BX41型显微镜下观察拍照。
在6个不同的视野随机选择10个圆形或半圆形的精小叶,利用OLYSIA BioReport软件分别计算其周长(c)。精小叶直径(d)根据公式:d=c/π进行换算。采用SPSS统计软件进行数据处理,结果用平均值±标准误(Mean±S.E.)表示。单因素方差分析的方法进行统计学分析,组间数据用Duncan法进行显著性水平的分析。
2 实验结果
2.1 TBT对精巢发育的影响
褐菖鲉精巢由许多精小叶构成。在成熟的精巢中精子充满整个精小叶腔。除生殖细胞外,精巢精小叶间还存在另外2种非常重要的细胞:支持细胞和间隙细胞。由于这两种细胞较小,在光学显微镜下很难辨别。

图1 免疫组织化学检测TBT暴露50d后褐菖鲉精巢内ER蛋白表达注:棕色块状为间隙细胞ER蛋白;深紫色块状体为精子Fig.1 Immunohistochemical detection of ER in the testes of Sebastiscusmarmoratus exposed to TBT for 50d
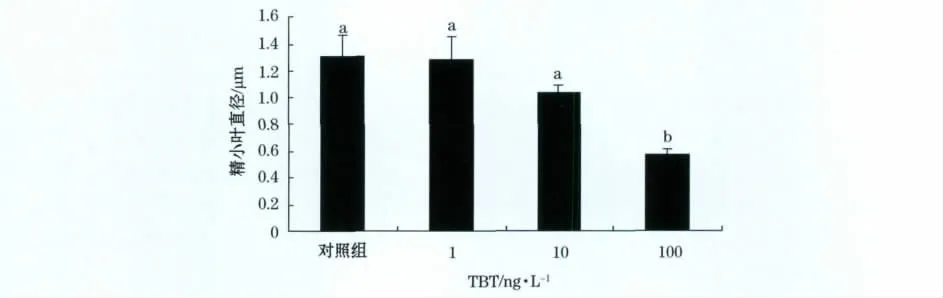
图2 TBT暴露50d后褐菖鲉精巢精小叶直径注:上标字母不同的组间具有显著性差异Fig.2 Lobules diameter in Sebastiscusmarmoratus exposed to TBT for 50days
TBT暴露50d后雄性褐菖鲉精巢发育受到抑制(图1)。在对照组褐菖鲉精巢内精小叶腔内充满了成熟精子(图1a)。1ng/L TBT暴露组褐菖鲉精巢发育与对照组相比未表现出明显差异。10ng/L TBT暴露组褐菖鲉精巢精小叶腔内也存在成熟精子,但精子数量和密度明显低于对照组和1ng/L TBT暴露组(图1c)。在100ng/L TBT暴露组中成熟精子仅仅存在于少数精小叶腔中,个别精巢中甚至不存在成熟精子(图1d)。另外,与对照组相比,TBT暴露50d后各暴露组的精小叶直径均有降低,表现出剂量依赖型抑制下降,其中100ng/L暴露组显著性下降(图2)。
2.2 TBT对精巢ER表达的影响
运用免疫组织化学的方法在精巢内定位ER蛋白,发现ER蛋白主要分布在小叶间隙间(图1)。另外,与对照组相比,各暴露组精巢内ER蛋白均被抑制,而且随着暴露质量浓度的升高,对ER蛋白的抑制程度不断增加,表现出良好的剂量-效应。
2.3 TBT对精巢AR表达的影响
运用免疫组织化学的方法在精巢内定位AR蛋白,发现AR蛋白主要分布在精细胞上(图3)。另外在精母细胞上分布有极少量的AR蛋白(图3)。在小叶间隙、精原细胞以及成熟的精子上都没有发现AR蛋白。与对照组相比,各暴露组精巢内AR蛋白并没有显著的变化。
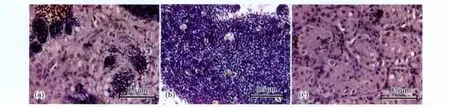
图3 免疫组织化学检测TBT暴露50d后褐菖鲉精巢内AR蛋白变化注:白色块状体为精细胞;紫色块状体为精母细胞AR蛋白;深紫色块状体为精子Fig.3 Immunohistochemical detection of AR in the testes of Sebastiscusmarmoratus exposed to TBT for 50d
3 讨 论
在本实验中,TBT暴露抑制了精巢的发育。和对照组相比,10,100ng/L TBT暴露组的精小叶直径显著性降低。Gimeno等曾报道,精小叶直径和精子发生有关[3],精小叶直径降低则意味着精子发生受到抑制。在本实验中10,100ng/L TBT暴露组精巢内成熟精子数量降低。Haubruge等曾经报道,将虹鳉(Poeciliareticulata)暴露于11.2ng/L TBT 21d后精子数量下降40%~75%[4]。这和本实验的研究结果是一致的。另外,研究表明类雌激素污染物[5-7]和抗雄激素污染物[7-9]通过模仿或抑制内源性雌激素或雄激素与ER或AR结合来抑制精巢发育。本实验结果表明,TBT同样能够干扰性激素受体,抑制精巢发育。
研究证明,雌激素的许多作用都是通过ER介导的[10]。目前,关于ER在硬骨鱼类性腺定位的研究还很少。Miura等运用原位杂交的方法在日本鳗鲡(Anguilljaponica)精巢内对ER进行定位,发现ER主要定位在精原细胞周围的支持细胞和间隙细胞[11],这和本实验的结果基本一致。另外,Andreassen等[12]运用免疫组织化学的方法研究发现ER主要定位于对锦(Zoarcesviviparus)精巢的支持细胞和初级精原细胞。尽管和我们的实验结果不一致,但这可能是由于选取的实验鱼类处于不同发育时期所致,因为在本实验中,褐菖鲉精巢中并不存在初级精原细胞。在本实验中,精巢生殖细胞上都没有存在ER蛋白,因此雌激素可能通过激活小叶腔间隙间细胞上的ER间接影响精巢内生殖细胞的发育。ER对精巢的发育十分重要。Hess等[13]指出缺失雌激素受体的转基因雄性小鼠不育,精子发生紊乱,睾丸精子容量和精子活力降低,精巢输出管中流体产物增加。在本实验中,TBT暴露组褐菖鲉精巢的ER蛋白水平降低,这可能是精巢发育受到抑制的原因之一。Andreassen等[12]报道,在对锦精巢内,特别是支持细胞上,17β-雌二醇能够自动调节ER的表达。因此,本实验中ER表达水平的降低可能和17β-雌二醇水平的降低有关。以前的实验已经证实TBT能够抑制褐菖鮋精巢17β-雌二醇水平[14]。
TBT抑制了褐菖鲉精巢小叶腔间隙的ER表达水平。在小叶腔间隙分布着支持细胞和间隙细胞。这两种细胞,特别是支持细胞,对精巢的正常发育十分重要[15]。Rasmussen等[16]曾报道,对锦精子发生的紊乱的一个非常重要的原因是支持细胞的衰退。因此,小叶腔间隙的ER表达水平降低可能影响支持细胞和间隙细胞的正常功能,从而影响精巢的正常发育。在本实验中AR蛋白主要定位在精巢内精细胞上,并且TBT暴露对AR蛋白表达没有显著影响。因此,在TBT抑制精巢发育的过程中,AR作用并不明显。
本研究结果表明,TBT对ER表达水平的抑制是鱼类精巢发育抑制的一个重要原因。该结果丰富了三丁基锡内分泌干扰机制。尽管ER可能介导了TBT对褐菖鲉精巢发育的影响过程,但详细的机制还不是很清楚,因此还需要更加深入的研究。
(References):
[1]JIANG G B,ZHOU Q F,LIU J Y,et al.Occurrence of butyltin compounds in the waters of selected lakes,rivers and coastal environments from China[J].Environmental Pollution,2001,115(1):81-87.
[2]ANTIZAR-LADISLAO B.Environmental levels,toxicity and human exposure to tributyltin(TBT)-contaminated marine environment.a review.b-antizar@hotmail.com[J].Environmental International,2008,34(2):292-308.
[3]GIMENO S,KOMEN H,JOBING S,et al.Demasculinisation of sexually mature male common carp,Cyprinuscarpio,exposed to 4-tert-pentylphenol during spermatogenesis[J].Aquatic Toxicology,1998,43(2-3):93-109.
[4]HAUBRUGE E,PETIT F,GAGE M J.Reduced sperm count in guppies(Poeciliareticulata)following exposure to low levels of tributylin and bisphenol A [J].Proceedings of Royal Society B:Biological Sciences,2000,267(1459):2333-2337.
[5]VAN DEN BELT K,WESTER P W,VAN DER VEN L T,et al.Effects of ethynylestradiol on the reproductive physiology in zebrafish(Daniorerio):time dependency and reversibility[J].Environmental Toxicology and Chemistry,2002,21(4):767-775.
[6]KINNBERG K,TOFT G.Effects of estrogenic and antiandrogenic compounds on the testis structure ofthe adult guppy(Poeciliareticulata)[J].Ecotoxicology and Environmental safety,2003,54(1):16-24.
[7]WEBER L P,HILL R L,JANZ D M.Developmental estrogenic exposure in zebrafish(Daniorerio):II.Histological evaluation of gametogenesis and organ toxicity[J].Aquatic Toxicology,2003,63(4):431-466.
[8]SINGH M S,JOY K P.Effects of administration of cyproterone acetate on seminal vesicle and testicular activity,and serum testosterone and estradiol-17βlevels in the catfishClariasbatrachus[J].Acta Biologica Hungarica,1998,49:143-154.
[9]KIPARISSIS Y,METCALFE T L,BALCH G C,et al.Effects of the antiandrogens,vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka(Oryziaslatipes)[J].Aquatic Toxicology,2003,63(4):391-403.
[10]JAUSEN H T,WEST C,LEHMAN M N,et al.Ovarian estrogen receptor-β(ERβ)regulation:I.changes in ERβmessenger RNA expression prior to ovulation in ewe[J].Biology and Reproduction,2001,65(3):866-872.
[11]MIURA T,MIURA C,OHTA T,et al.Estradiol-17βstimulates the renewal of spermatogonial stem cells in males[J].Biochemical and Biophysical Research Communications,1999,264(1):230-234.
[12]ANDREASSEN T K,SKJOEDT K,ANGLADE I,et al.Molecular cloning,characterisation,and tissue distribution of oestrogen receptor alpha in eelpout(Zoarcesviviparus)[J].General and Comparative Endocrinology,2003,132(3):356-368.
[13]HESS R A,BUNICK D,LEE K H,et al.A role for oestrogens in the male reproductive system[J].Nature,1997,390(6659):509-512.
[14]ZHANG J L,ZUO Z H,HE C Y,et al.Effect of tributyltin on testicular development inSebastiscusmarmoratusand the mechanism involved[J].Environmental Toxicology and Chemistry,2009,28(7):1528-1535.
[15]YU W J,LEE B J,NAM S Y,et al.Spermatogenetic disorders in adult rats exposed to tribuyulin chloride during puberty[J].Journal of Veterinary Science,2003,65(12):1331-1335.
[16]RASMUSSEN T H,TEH S J,BJERREGAARD P,et al.Anti-estrogen prevents xenoestrogen-induced testicular pathology of eelpout
(Zoarcesviviparus)[J].Aquatic Toxicology,2005,72(3):177-194.
Effect of Tributyltin on the Sex Hormone Receptor in Testis of Sebastiscus Marmoratus
ZHANG Ji-liang1,ZHU Wen-wen1,SUN Ping1,XIONG Jian-li1,GUO Dai-jian2
(1.CollegeofAnimalScienceandTechnology,HenanUniversityofScienceandTechnology,Luoyang 471003,China;2.LuoyangNormalUniversity,Luoyang 471022,China)
Tributyltin(TBT)can affect the reproductive function in fishes.However,few study reports the effects of TBT on estrogen receptor or androgen receptor which is related to the development of germ cells.Therefore,the present study was conducted to investigate the effects of TPT at environmentally relevant concentrations(1,10and 100ng/L)on testicular estrogen receptor or androgen receptor in male rockfish Sebastiscus marmoratus.The results showed that TBT inhibited the testicular development and reduced the levels of estrogen receptor which was located in the interlobular septa.TBT interfered with estrogen receptor might be one of the reasons causing the dysfunction of Sertoli cells,which play a critical role during spermatogenesis.Androgen receptor levels were not shown significant changes after TBT exposure.The results provided new information which is important for fully understanding the reproductive toxic effects,pathway and mechanism of TBT.
Tributyltin;Sebastiscusmarmoratus;testis;estrogen receptor
April 8,2011
Q958
A
1671-6647(2012)02-0252-05
2011-04-08
国家自然科学基金——有机锡污染对海洋鱼类性腺分化和发育的影响及其机制(20777061);河南省教育厅科技重点研究项目——有机锡水体污染对鱼类性腺发育的影响及其机制(12B240001)
张纪亮(1980-),男,河南新乡人,副教授,博士,主要从事海洋生态毒理方面研究.E-mail:jiliang_zhang@126.com
