中肋骨条藻在不同营养盐条件下的荧光光谱特征研究*
2012-01-05蒋凤华赵美丽史振平陈军辉王小如黎先春
蒋凤华,赵美丽,史振平,郑 立,陈军辉,王小如,黎先春
(1.国家海洋局 第一海洋研究所海洋生态中心,山东 青岛266061;2.青岛科技大学 化工学院,山东 青岛266042)
中肋骨条藻在不同营养盐条件下的荧光光谱特征研究*
蒋凤华1,赵美丽1,史振平2,郑 立1,陈军辉1,王小如1,黎先春1
(1.国家海洋局 第一海洋研究所海洋生态中心,山东 青岛266061;2.青岛科技大学 化工学院,山东 青岛266042)
采用实验生态学方法,探讨了营养盐条件变化对中肋骨条藻活体细胞和光合色素荧光光谱的影响。结果表明,光合色素的荧光激发光谱和发射光谱均比活体藻细胞的多一个荧光峰,且荧光峰最大值向短波方向移动;营养盐条件改变时,活体藻细胞的荧光光谱特征基本不变,光合色素的荧光光谱特征由于色素组成比例发生变化而使荧光光谱特征发生改变。研究结果还显示营养盐条件的改变会影响光合色素的荧光光谱特征,应用光谱技术对赤潮藻进行监测和分析时需要考虑环境条件的影响。
赤潮藻;中肋骨条藻;荧光光谱;营养盐
(高 峻 编辑)
因为全球特别是我国近海赤潮的频发,所以对浮游植物种类和数量的监测分析方法的探讨已成为研究的焦点。吸收光谱法和荧光光谱法作为常规的分析手段,可用于浮游植物种类的识别和数量的测量,对于赤潮监测具有重要意义。藻体所含色素种类及其组成比例决定了藻类吸收谱的形状,而色素浓度及包裹效应主要影响吸收谱的值[1-2]。藻类荧光随着培养时间[3]、光照条件[4]、营养盐条件[3]、微量元素含量[5]及污染物的存在等而变化[6-10]。荧光特性方面的研究较多,对光谱特征研究较少。国内唐晓静等、苏荣国等对不同光照条件下东海典型赤潮藻的光谱特征进行研究,并进行藻类的识别[11-12]。赤潮发生时现场环境条件的不同会引起藻类光谱的变化。我们以中肋骨条藻为研究对象,测量活体藻细胞及其光合色素的荧光光谱特征,分析营养盐条件改变对荧光光谱性质的影响,为建立浮游植物的光谱分析方法进行有益探索,并对赤潮的监测和预测提供技术支持。
1 材料与方法
1.1 样品与实验条件
实验所用中肋骨条藻(Skeletonemacostatum(Greville)Cleve)由国家海洋局第一海洋研究所提供,藻种于2002-05采自东海长江口海域,分离纯化后于20℃保存在f/2培养液中,光照度约为3 000Lx,光暗比为12h∶12h,光源为白色日光灯。以250mL玻璃三角瓶为培养容器,经体积分数为20%的HCl溶液浸泡处理后,用超纯水冲洗干净,蒸汽灭菌(121℃,15min)。海水用孔径0.45μm的醋酸纤维滤膜过滤后,高压锅煮沸灭菌。
培养实验在4种营养盐条件下进行。除了f/2培养液条件,另3种营养盐条件为固定PO4-P浓度为2 μmol/L,使NO3-N浓度分别为16,64和128μmol/L,即N/P比分别为8∶1,16∶1和64∶1。首先在上述3种营养盐条件下对微藻进行培养,然后取10mL指数生长期的藻液接种到500mL培养液进行正式实验,培养周期15d。每组3个平行。培养条件与藻种保存条件相同。培养期间适当振荡,接种及取样时均进行灭菌处理。
实验期间每天定时取样5mL藻液直接进行微藻生长和荧光光谱的测定;另取20mL藻液用GF/F滤膜过滤后,将滤膜放置于15mL玻璃离心馆中,加入10mL体积分数为90%丙酮,于4℃在暗处放置24h,以提取其中的光合色素,取上清液进行荧光光谱测量[13]。
1.2 微藻生长和荧光光谱的测量
以微藻的活体叶绿素荧光值表示微藻的生长[14]。直接用Hitachi F-4500荧光分光光度计(配以1cm石英比色皿)测定活体叶绿素荧光值,发射和激发狭缝均为5.0nm。激发波长(λex)466nm,发射波长(λem)600~750nm,以680nm处的荧光强度(arbitrary unit,a.u.)变化表示藻的生长变化。
测荧光激发光谱时,λem为680nm,λex范围为360~600nm;测定荧光发射光谱时,λex为440nm,λex范围为600~800nm[5,13]。扫描速度1 200nm/min。
1.3 光谱数据的预处理
将扫描的光谱数据导出,在Matlab软件中用窗口移动多项式平滑和最大归一化方法对数据进行平滑和归一化处理,以消除噪音、基线漂移和光谱强度的差别,处理后的光谱图只反映样品的光谱形状。
2 结果与讨论
2.1 不同营养盐条件对中肋骨条藻生长的影响
实验中,微藻的细胞密度和活体叶绿素荧光强度之间存在线性关系,因而以叶绿素荧光强度的变化表示微藻生长。中肋骨条藻活体叶绿素荧光强度的变化,即微藻的生长符合指数生长曲线,第1~3天处于缓滞期,从第4天开始进入指数生长期。在f/2营养液和N/P比例为64∶1条件下,藻的生长在第10天达到最大值;而在N/P比例为16∶1和8∶1条件下,藻密度均在第6天达到最大值(图1)。营养盐浓度越高,藻密度越大。这与刘春颖等[13]发现的低营养盐条件下亚心形扁藻的生长状况普遍较差相一致。

图1 不同营养盐条件下中肋骨条藻的生长曲线Fig.1 Growth curves of Skeletonemacostatumin different nutrient concentrations
1.2 不同营养盐条件对中肋骨条藻荧光光谱的影响
2.2.1 荧光激发光谱
图2为预处理前后f/2培养液条件下不同培养时间的中肋骨条藻光合色素的荧光激发光谱图。光合色素的荧光强度随藻密度增加而增大,因而不同时间的荧光光谱形状存在较大差异;由于峰强高低不同,使得峰强较弱的光谱形状显现不出来(图2a)。经过平滑和归一化处理后(图2b),能够有效消除受噪音、仪器影响而产生的平峰现象;消除了量的差别之后,波谱只反映了物种的形状,有助于对比不同物种间波谱的特征差异。由于第7天时N/P比为8∶1条件下藻的生长已进入衰亡期,因而只选取第6天的光谱数据并平滑和归一化处理后进行比较,分析营养盐条件改变对荧光光谱的影响。
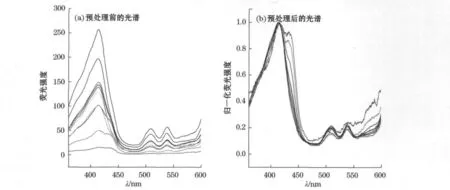
图2 不同时期f/2培养液条件下中肋骨条藻光合色素的荧光激发光谱Fig.2 Fluorescence excitation spectra of photosynthetics pigments of Skeletonemacostatum in f/2culture medium in at different periods
图3为发射波长为680nm时不同营养盐条件下中肋骨条藻第6天时活体藻细胞和光合色素的荧光激发光谱。4种营养盐条件下荧光激发光谱形状基本一致,荧光峰位置没有明显变化。活体细胞的荧光激发光谱在400~480nm和500~570nm出现2个强度相近的荧光宽峰,最大值分别位于440nm和530nm,在470nm处存在次大峰;分别为Chl-a、类胡萝卜素和Chl-b的特征激发波长[15]。但是,也有研究表明含有Chl-c的微藻光谱中位于绿光区468nm附近的激发峰是Chl-c的强峰[16],主要是由Chl c1,c2,c3及其衍生物引起的。530~545nm的强吸收是类胡萝卜素的典型吸收带,而胡萝卜素的吸收带可位于425~500nm[17]。

图3 第6天时不同营养盐条件下中肋骨条藻的荧光激发光谱(λem=680nm)Fig.3 Fluorescence excitation spectra of Skeletonemacostatumin 6th day under different nutrient condition(λem=680nm)
相对于活体细胞荧光光谱,光合色素的荧光激发光谱中2个荧光宽峰分别蓝移至360~450nm和490~550nm,并且在415,510和540nm出现最大荧光值,分别对应于活体细胞440nm处的叶绿素、类胡萝卜素和褐藻黄素的典型吸收[17],但是,510nm和540nm处的荧光强度比较接近,并且较415nm处的荧光强度明显偏低。提取光合色素的荧光最大值和荧光最大值均向短波方向移动,可能是由于色素提取液中细胞膜被破坏,不存在细胞色素层叠效应的原因。
比较3种低营养盐条件下2个荧光峰范围的荧光强度变化,可发现随N浓度降低(64∶1降至8∶1),530nm处的荧光强度比值升高,即藻体中胡萝卜素和类胡萝卜素的比例增加。提取色素荧光光谱中同样是N/P为8∶1条件下类胡萝卜素和褐藻黄素(510nm和540nm处荧光)比例相对最高。
进一步分析光合色素荧光激发光谱中415nm,510nm和540nm处荧光强度的比值随培养时间的变化(图4)。
叶绿素与类胡萝卜素和褐藻黄素的比例(I415nm/I510nm和I415nm/I540nm)的变化趋势与藻生长曲线相似,表明藻体内色素组成比例与生长周期有关,但是第4天比值最高。此外,f/2培养液条件下I415nm/I510nm和I415nm/I540nm在整个培养周期内均最大,而N/P比为8∶1条件下,荧光峰强度的比例均最小,表明不同营养盐条件下藻体内的色素组成发生了改变,而类胡萝卜素的比例有所增加。研究表明,在环境胁迫条件下,Chl-a含量较类胡萝卜素更敏感,即Chl-a降低幅度要大于类胡萝卜素[17],这可能是低营养盐条件下微藻的生长受到胁迫会产生过氧自由基,类胡萝卜素和褐藻黄素等作为微藻体内的抗氧化剂,其含量增加是微藻适应环境的一种表现。
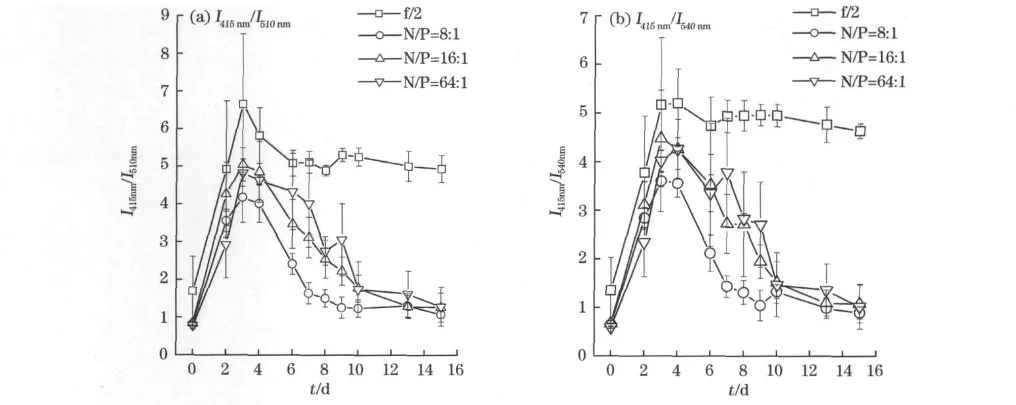
图4 不同营养盐条件下光合色素激发光谱中2种荧光强度比例随培养时间的变化Fig.4 The changes of 2fluorescence intensity ratioes of photosynthetic pigments with the culture time under different nutrient conditions
2.2.2 荧光发射光谱
激发波长为440nm时,活体细胞的激发光谱在650~750nm范围内出现1个荧光峰,最大值在680 nm,为Chl-a的典型荧光峰(图5a)。营养盐条件的改变对荧光峰的形状没有影响。但是,提取色素的激发光谱在600~750nm存在2个荧光峰(图5b),最大值分别在636nm和669nm,分别为Chl-c和Chl-a的荧光发射峰[19],并且光合色素荧光发射光谱中Chl-a的位置同样向短波方向移动。这同样是由于色素提取液中细胞膜被破坏,不存在细胞色素层叠效应的原因。
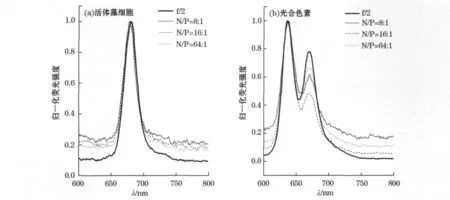
图5 第6天时不同营养盐条件下中肋骨条藻的荧光发射光谱Fig.5 Fluorescence emission spectra of Skeletonema costatum in 6th day under different nutrient conditions
进一步分析不同营养盐条件下2个荧光峰强度之比(I636nm/I670nm)的变化发现,不同营养盐条件下的荧光强度比例不同,即营养盐条件的改变影响到Chl-a和Chl-c的相对比例(图6)。在第3天之前,荧光峰的比值较小,这可能是由于在生长初期藻密度较低,色素含量同样很低的原因;2个荧光峰强度的比值在第6~8天达到最大,在衰亡期变小,同样表明藻体内的色素比例会随生长阶段的不同而发生改变。

图6 不同营养盐条件下光合色素发射光谱中荧光强度比例随培养时间的变化Fig.6 The changes plot of fluorescence intensity ratio of photosynthetic pigments with the culture under different nutrient conditions
3 结 语
研究营养盐条件变化对中肋骨条藻活体细胞和光合色素的荧光激发光谱和荧光发射光谱的影响,结果表明:
1)光合色素的荧光激发光谱和发射光谱均比活体藻细胞多一个荧光锋,并且位置均较活体藻细胞向短波方向移动;
2)营养盐条件改变时,活体藻细胞的荧光光谱特征基本不变;但是营养盐浓度较低时,藻细胞中辅助色素的比例增加,从而引起荧光激发光谱和发射光谱发生变化。
(References):
[1]BRICAUD A,BEDHOMME L,MOREL A.Optical properties of diverse phytoplanktonic species:Experimental results and theoretical interpretation[J].Journal of Plankton Research,1988,10:851-873.
[2]ROESLER C S,PERRY M J,CARDER K L.Modeling in situ phytoplankton absorption from total absorption spectra in productive inland marine waters[J].Limnology and Oceanography,1989,34(8):1510-1523.
[3]PARKHILL J,MAILLET G,GULLEN J J.Fluorescence-based quantum yield for photosystem II as a diagnostic of nutrient stress[J].Journal of Phycology,2001,31:517-529.
[4]YANG X L,ZHU M Y,CULLEN J J.Study on fluorescentcharacteristics and biochemical composition of a marine diatom in light-dark cycle-II effect of the light intensity[J].Acta Oceanologica Sinica,1992,14(1):97-104.杨小龙,朱明远,CULLEN J J.光暗周期下一种海洋硅藻荧光特性和生化组成的研究-Ⅱ光强的影响[J].海洋学报,1992,14(1):97-104.
[5]LI D X,CONG W,CAI Z L,et al.Spectroscopic properties ofheterosigmaakashiwounder iron limitation[J].Chinese journal of applied ecology,2003,14(7):1181-1184.李东侠,丛威,蔡昭铃,等.赤潮异弯藻在铁限制条件下的光谱特性[J].应用生态学报,2003,14(7):1181-1184.
[6]THOMPSON J A.Cellluar fluorescence capacity as endpoint in algal toxicity testing[J].Chemosphere,1997,35:2027-2037.
[7]GUSTAVSON K,WANGBERG S.Tolerance induction and succession in microalgae communities exposed to copper and atrazine[J].A-quatic Toxiciology,1995,32:283-302.
[8]BLANCK H,DAHL B.Pollution-induced community tolerance(PICT)in marine periphyton in a gradient of tri-n-butyhin(TBT)contamination[J].Aquatic Toxiciology,1996,35:59-77.
[9]RALPH P J.Herbicide toxicity of Halophila ovalis assessed by chlorophyll a fluorescence[J].Aquatic Botany,2000,66:141-152.
[10]HAYNES D,RALPH P,PRANGE J,et al.Impact of herbicide diuron on photosynthesis in three species of tropical seagrass[J].Marine Pollution Bulletin,2000,41:288-293.
[11]TANG X J,ZHANG Q Q,LEI S H,et al.Research on characterization analysis of synchronous fluorescence spectra of living phytoplankton[J].Spectroscopy and Spectral Analysis.2007,27(3):556-559.唐晓静,张前前,类淑河,等.活体浮游植物同步荧光光谱特征分析研究[J].光谱学与光谱分析,2007,27(3):556-559.
[12]SU R G,LIANG S K,ZHU C J,et al.Fluorescence discrimination technology ofBacillariophytaandPyrrophyta[J].Environmental Science and Technology,2008,31(3):52-55.苏荣国,梁生康,祝陈坚,等.硅藻和甲藻的荧光识别测定技术研究[J].环境科学与技术,2008,31(3):52-55.
[13]LIU C Y,ZHANG Z B,LI P F,et al.Growth effect of exogenous nitric oxide on platymonas subcordiformis and spectrum study[J].Environmental Science,2006,27(6):1062-1067.刘春颖,张正斌,李培峰,等.外源一氧化氮对亚心形扁藻的生长效应及光谱研究[J].环境科学,2006,27(6):1062-1067.
[14]ZHENG L,HAN X T,YAN X J,et al.A preliminary study on algicidal activity of marine bacteria associated with marine organism[J].Advances in Marine Science,2006,24(4):511-519.郑立,韩笑天,严小军,等.海洋生物共栖细菌抑藻活性的初步研究[J].海洋科学进展,2006,24(4):511-519.
[15]JIN H L,WANG Y T.Research on recognition method of living alga based on stimulating fluorescence spectrum [J].Chinese Journal of Sensors and Actuators,2006,19(1):97-99.金海龙,王玉田.基于荧光发射光谱的活体海藻识别方法研究[J].传感技术学报,2006,19(1):97-99.
[16]PORYVKINA L,BABICHENKO S,LEEBEN A.Analysis of phytoplankton pigments by excitation spectra of fluorescence[C]∥Proceedings of EARSeL-SIG-Workshop LIDAR,Dresden/FRG.[s.L.]:2000:224-232.
[17]LU L,SU R G,WANG X L,et al.Study on the characters of phytoplankton chlorophyll fluorescence excitation spectra based on fourth-derivative[J].Spectroscopy and Spectral Analysis,2007,27(11):2307-2312.卢璐,苏荣国,王修林,等.基于四阶导数的浮游植物叶绿素荧光激发光谱特征研究[J].光谱学与光谱分析,2007,27(11):2307-2312.
[18]LIU C S,WANG Y,YU J,et al.Effects of UV-B radiation enhancement on photosynthetic pigments ofDicrateriainornataandPhaeodactylumtricornutum[J].Marine Science,2002,26(7):5-6.刘成圣,王悠,于娟,等.UV-B辐射对叉鞭金藻和三角褐指藻光合色素的影响[J].海洋科学,2002,26(7):5-6.
[19]ZHU M Y,XING J,WU B L.The application of two spectrofluorometric methods to chlorophyll determination of marine phytoplankton[J].Journal of Ocean University of Qingdao,1994,24(4):533-538.朱明远,邢军,吴宝铃.两种荧光分析法在海洋浮游植物叶绿素测定中的应用[J].青岛海洋大学学报,1994,24(4):533-538.
Study on the Characteristics of Fluorescence Spectra ofSkeletonemacostatumUnder Different Nutrient Conditions
JIANG Feng-hua1,ZHAO Mei-li1,SHI Zhen-ping2,ZHENG Li1,CHEN Jun-hui1,WANG Xiao-ru1,LEE FRANK S C2
(1.ResearchCenterofMarineecology,TheFirstInstituteofOceanography,SOA,Qingdao 266061,China;2.Collegeofchemicalengineering,QingdaoUniversityofScienceandTechnology,Qingdao 266042,China)
The effects of nutrient conditions on living cells and fluorescence spectra ofSkeletonemacostatumwere studied by using experimental ecological methods.An extra fluorescent peak was found in both excitation and emission spectrum of photosynthetic pigments and the positions of the fluorescence peaks of photosynthetic pigments were blue-shifted compared to those of the living cells.When the nutrient conditions changed,the characteristics of fluorescence spectra of living cells were basically kept the same,however the characteristics of fluorescence spectra of photosynthetic pigments were changed when the ratio of pigments compositions altered.The results indicated that the changes of nutrient conditions affected the characteristics of fluorescence spectra of photosynthetic pigments,and the environment conditions should be considered when applying the spectroscopic methodology to monitor and analyze red tide algae.
red tide algae;Skeletonemacostatum;fluorescence spectra;nutrient
December 15,2010
P733.3
A
1671-6647(2012)02-0229-07
2010-12-15
项目资助:国家高技术研究发展计划——赤潮现场快速监测与检测技术(2007AA092001);海洋赤潮灾害立体监测技术与应用国家海洋局重点实验室开放课题——长江口赤潮监控区常见赤潮藻种光谱特性研究(200811)
蒋凤华(1977-),山东德州人,副研究员,主要从事海洋环境化学方面研究.E-mail:jiangfh@fio.org.cn
