超声波辅助-顶空固相微萃取-气相色谱法测定葡萄酒中痕量2,4,6-三氯苯甲醚
2012-01-03张素娟梁宝爱孙丽萍李建珍
张素娟 梁宝爱 孙丽萍 李建珍
(山西省食品质量安全监督检验研究院,太原 030012)
·食品分析·
超声波辅助-顶空固相微萃取-气相色谱法测定葡萄酒中痕量2,4,6-三氯苯甲醚
张素娟*梁宝爱 孙丽萍 李建珍
(山西省食品质量安全监督检验研究院,太原 030012)
建立了超声波-顶空固相微萃取-气相色谱检测葡萄酒中的痕量木塞污染物——2,4,6-三氯苯甲醚(TCA) 的方法。试验结果表明,该方法有良好的线性关系,相关系数为0.999 89,方法定量限为0.5 ng/L,相对标准偏差RSD在1.98%~5.32%之间,加标回收率为89.0%~103.2%。该方法操作简便、快速、准确度高、重现性好,适用于普通实验室对葡萄酒中痕量TCA残留的检测。
TCA;超声波;顶空固相微萃取(HS-SPME);葡萄酒
1982年,2,4,6-三氯苯甲醚(TCA) 被发现是污染葡萄酒品质的主要元凶之一。曲霉菌、青霉、木霉等真菌在潮湿环境下可将酒瓶软木塞中的氯酚转化为氯苯甲醚,软木从加工到葡萄酒的装瓶都可能会暴露此种环境下,导致TCA的形成。研究报告表明,由软木塞迁移到葡萄酒中TCA的质量浓度约在2.4 ng/L~210.0 ng/L之间。据估计,2%~5%的瓶装葡萄酒因瓶塞受到TCA污染。由于痕量的TCA感官阈值非常低,对葡萄酒的风味和品质造成不可逆的破坏,世界范围内每年因TCA污染造成的经济损失估计为100亿美元。国外检测TCA的方法较多,有顶空固相微萃取方法,微波萃取、索氏提取、压力溶剂萃取、搅拌棒吸附萃取、固相萃取等方法,国内对TCA的检测方法较少,仅有固相微萃取法。本文基于以上研究,首次采用超声波辅助顶空固相微萃取-气相色谱法测定葡萄酒中的痕量TCA,优化了萃取前处理条件,方法简便、高效、灵敏度高。
1 材料与方法
1.1 仪器
气相色谱仪,配ECD检测器,日本岛津GC-2010;固相微萃取装置,supelco公司,配5种萃取头;KQ5200DE型数控超声波清洗器,昆山市超声仪器有限公司;PHS-3C型数字酸度计,雷磁仪器厂;BSA124S-cw分析天平,Sartorius;BSA2202S电子天平,Sartorius;40ml样品瓶,supelco公司。
1.2 试剂
无水乙醇、氯化钠、L(+)-酒石酸、氢氧化钠,优级纯;甲醇,色谱纯;实验室用水,超纯水;2,4,6-三氯苯甲醚,纯度(质量分数) ≥99%。
1.3 溶液的配制
1.3.1 标准储备液的配制
精确称取三氯苯甲醚10 mg溶于10 mL甲醇溶液中,配制成质量浓度为1 mg/L的标准储备溶液,然后用甲醇溶液稀释至1 μg/L和10 μg/L,摇匀置于4℃冰箱储存备用。
1.3.2 标准工作液的配制
用1 mol/L氢氧化钠溶液将体积浓度12%乙醇溶液(含有3.5 g/L 的L(+) -酒石酸) 调pH值为3.5,作为配制标准工作液的溶剂,分别配制浓度为0ng/L、1ng/L、5ng/L、10ng/L、25ng/L、50 ng/L、100 ng/L的TCA标准工作溶液。
1.4 色谱条件
毛细管柱:DB-17(0.25 mm×30 m,0.25 μm);载气:氮气;流速:1.0 mL/min;进样方式:无分流;进样时间:2 min;进样口温度:270℃;检测器温度:300℃。
升温:初始温度40℃,保持2 min;13℃/min升温至150℃,保持8 min,25℃/min升温至250℃,保持11 min。
1.5 分析步骤
准确移取稀释酒样(1倍体积) 25 mL,置于40 mL顶空进样瓶中,加入浓度3 mol/L的NaCl溶液4.4 g,用硅胶隔垫密封,置于超声波清洗器中,在 40℃下,预超声 10 min,再用 50 μm/30 μm DVB-CAR-PDMS萃取头萃取超声40 min后,拔出,在GC进样口热脱附2 min,样品经色谱系统分离后,用ECD检测器进行检测,由保留时间定性,外标法峰面积定量。
2 结果与讨论
2.1 萃取方式的选择
在其他条件相同的情况下,采用50/30 μm DVB/CAR/PDMS萃取头对磁力搅拌和超声波两种辅助萃取方式进行比较,结果如图1。
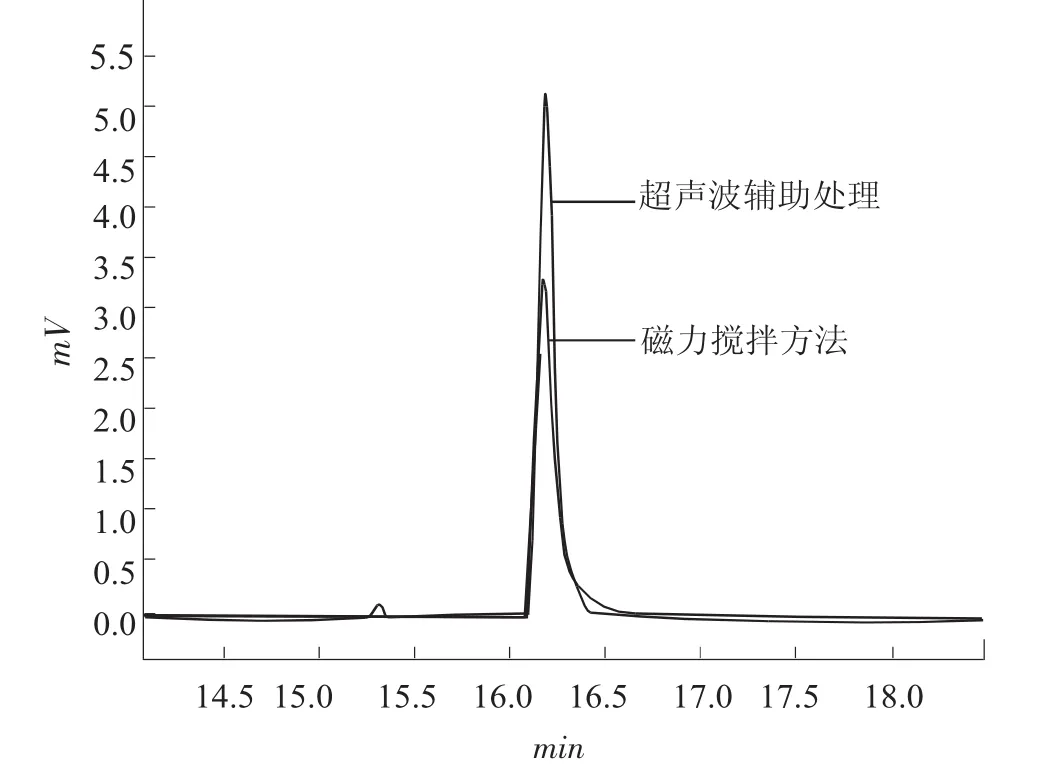
图1 不同萃取方式对萃取效率的影响
由图1可以看出,超声波比磁力搅拌的萃取率提高了32%,可见超声波的空化效应促进了TCA脱溶剂,且易从溶液中溢出,表明超声波辅助可大大提高方法的灵敏度。
2.2 H S-SPM E萃取条件的优化
对于顶空固相微萃取来说,目标化合物的吸附量主要取决于萃取头涂层、液体表面上的压力、顶空体积以及溶质扩散的性质。所以分别就萃取头的选择、超声功率、吸附时间、盐(NaCl)的用量、温度等条件进行了优化研究。
2.2.1 萃取头的选取
分别用 100 μmPDMS、65 μmPDMS/DVB 和 75 μmCAR/PDMS、85 μmPA、50/30 μm DVB/CAR/PDMS5种涂层在相同条件下进行顶空萃取,其结果见下页图2、图3。
从图2、图3中可以看出,在不同时间内65 μm PDMS/DVB和 50/30 μmDVB/CAR/PDMS涂层的萃取效果明显较高,且对超声敏感。其中50/30 μm DVB/CAR/PDMS的萃取灵敏度最高,因此确定采用该涂层萃取头。
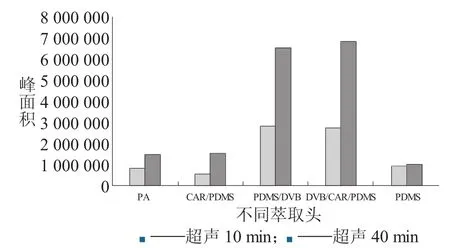
图2 不同萃取头对萃取效率的影响
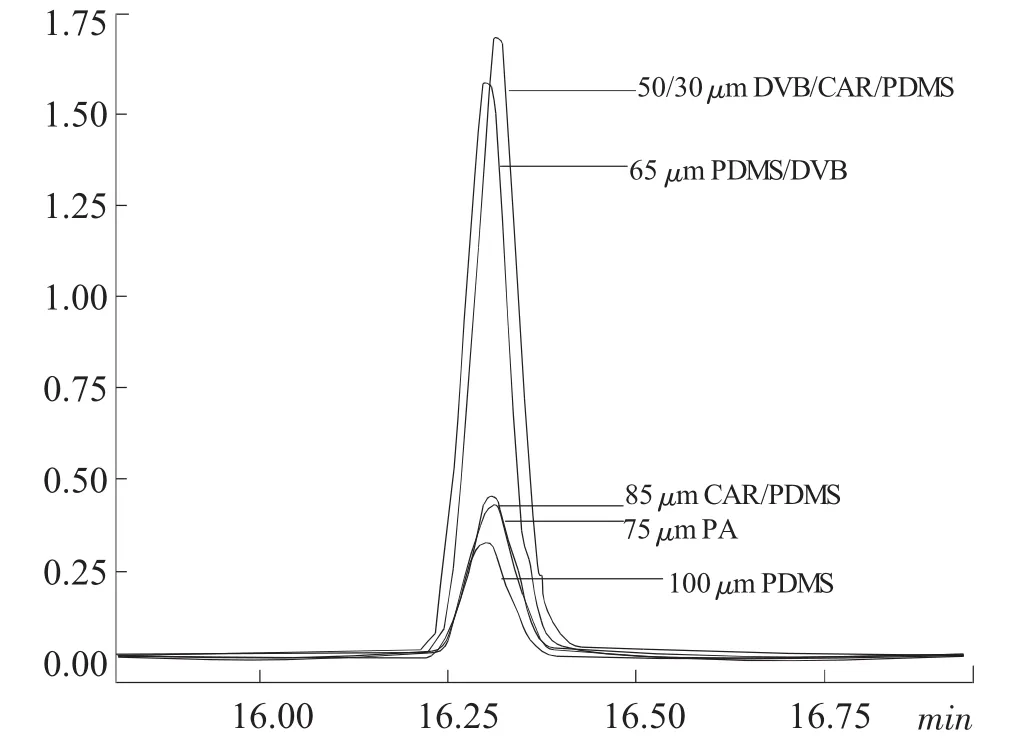
图3 不同萃取头萃取效率的变化
2.2.2 样品体积的确定
因为顶空固相微萃取与样品瓶中的顶空体积有密切关系。一般认为在萃取温度不变的情况下,顶空体积越小,萃取效率越高。在40 mL样品瓶中加入不同体积的相同浓度的标准工作溶液,在一定试验条件下,考察了样品体积对萃取效率的影响(见图 4)。
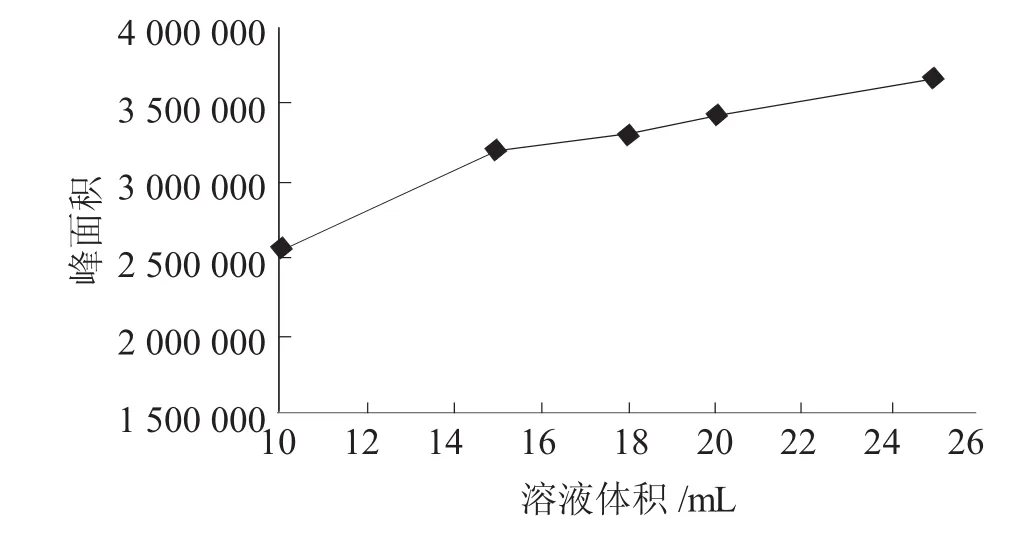
图4 溶液体积对萃取效率的影响
从图4中明显看出,随着样品体积的增大,顶空体积的减小对三氯苯甲醚萃取效率越来越高。但考虑空容体积太小会使萃取头浸入液体中,因此选择取样体积为25 mL。
2.2.3 超声功率的选择
超声功率的大小决定了传质速度的快慢,对溶液中溶质的扩散与饱和蒸气压有一定的影响,在其他条件相同的情况下,采用40%、60%、80%、100%超声功率对峰面积和重复性进行了试验。结果见表1。
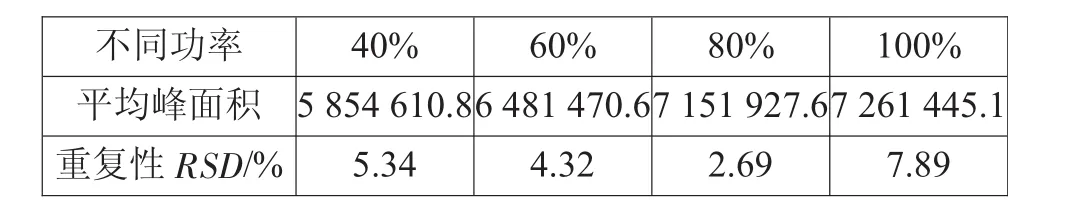
表1 不同功率对萃取效率的影响
从表1可以看出,随着超声功率的增加,峰面积有所上升,但是在100%功率时重复性有所下降,因此选择80%的超声功率。
2.2.4 加入无机盐的影响
离子强度不仅影响吸附热力学,而且对吸附动力学也能产生一定的影响。所以通过加入不同量的 NaCl(0 mol/L,1 mol/L,2 mol/L,3 mol/L,4 mol/L,5 mol/L,6 mol/L) 改变溶液的离子强度,考察其对TCA萃取效率的影响(见图5)。结果表明,随着盐加入量的逐渐增加,响应面积先增大后变化不明显。但随着盐量的逐渐增加,色谱图中杂峰明显增大,所以选择氯化钠的浓度为3 mol/L。
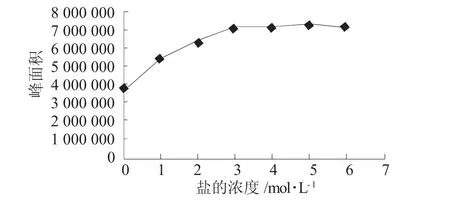
图5 盐加入量对萃取效率的影响
2.2.5 萃取时间的选择
选择 10 min、20 min、30 min、40 min、50 min、60 min和80 min不同萃取时间进行试验,结果表明,对TCA的响应随着萃取时间延长而增加,当萃取时间为40 min时,处于拐点,随着时间的增加萃取效率处于缓慢增加的状态。故选择萃取时间为40 min。
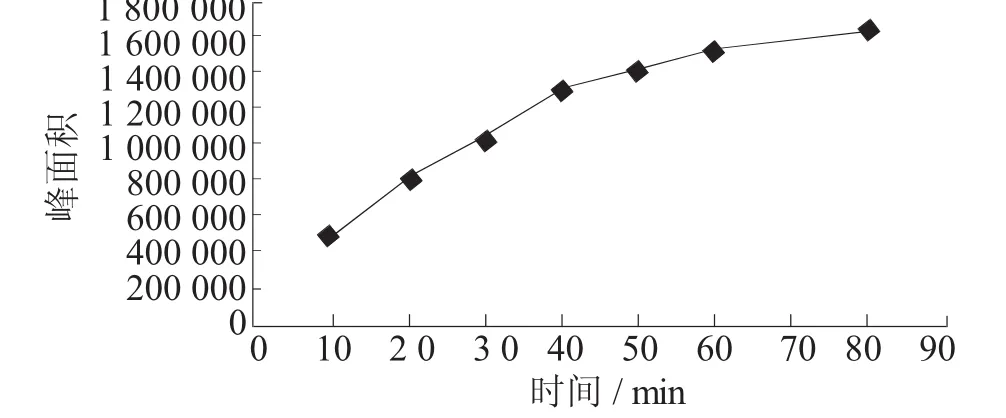
图6 萃取时间对萃取效率的影响
2.2.6 萃取温度的选择
在一定温度下溶液体系达到气液平衡时,气相的组成与样品原来的组成成正比关系。体系温度升高到一定程度,气相中各组分浓度变大,有利于纤维的吸附,试验考察了30℃、40℃、50℃、60℃4个温度点,采用超声辅助HS-SPME-GC-ECD法进行检测分析,吸附效率随温度升高略有提高(见图7),但过高的温度操作不方便且增加其他杂质的释放。因此选择萃取温度为40℃。
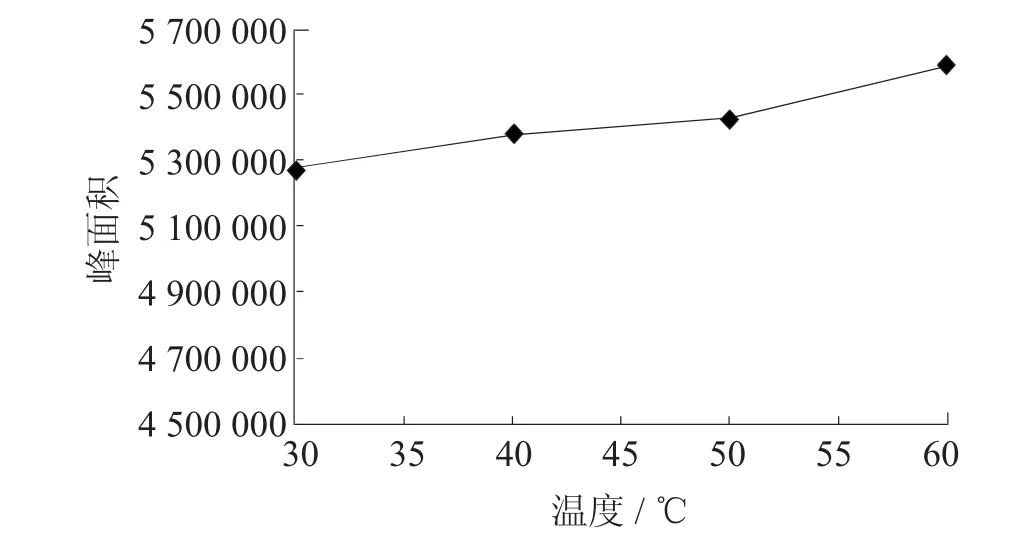
图7 萃取温度对萃取头吸附效率的影响
2.3 分离条件的优化
2.3.1 解析时间的选择
解析时间的选择对目标分析物的定量分析也是关键因素之一,太短的解析时间不能使目标化合物充分释放,致使解析率降低。太长的解析时间将导致纤维涂层高温环境缓慢降解。本试验选择了1 min、2 min、5 min进行试验,发现解析2 min后目标化合物已全部释放出来。
2.3.2 色谱条件的选择
根据TCA的结构性质,选择了ECD检测器和中等极性毛细管柱柱(DB-17),通过标准工作溶液和添加葡萄酒中进行与干扰峰的分离,最后选定了1.4中的最佳色谱条件。加入葡萄酒中的标准溶液谱图见图8。
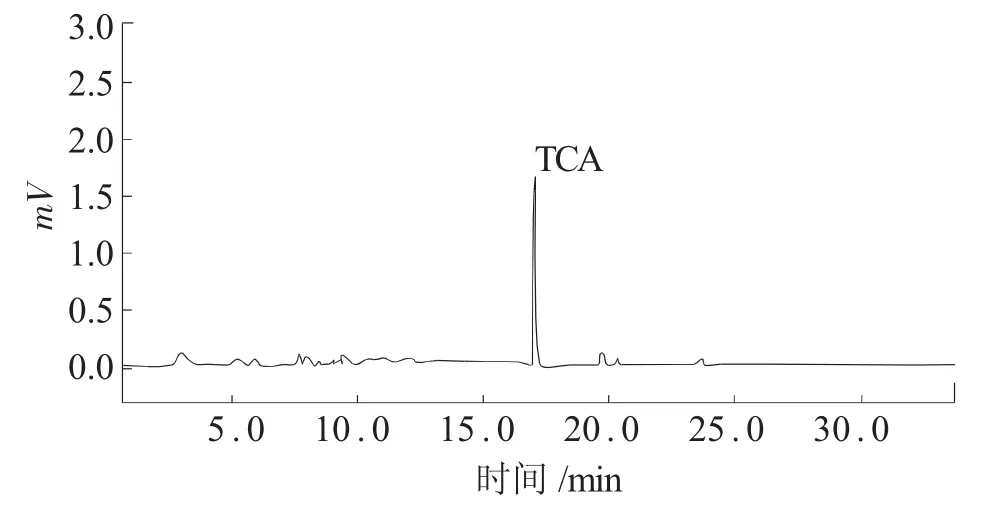
图8 加入葡萄酒中TCA色谱图
2.4 方法的线性范围、检出限、精密度和回收率
在优化条件下,用6次测定结果的平均值绘制标准曲线,见图9。回归方程为y=61 616.2x+123 657.1,TCA含量在1.0 ng/L~100 ng/L范围内呈线性关系,标准曲线的线性相关系数R2=0.999 893 7。按3倍的信噪比方法计算检出限为0.2 ng/L,定量限为0.5 ng/L。
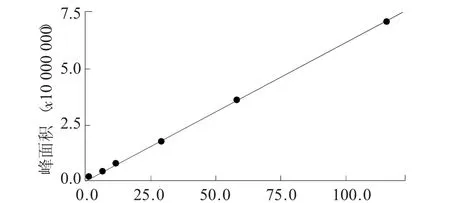
图9 TCA的标准曲线浓度/ng·L-1
选取6种不同的葡萄酒样品进行测定,同时加不同浓度的标准溶液,测得加标回收率在89.0%~103.2%之间,相对标准偏差(RSD) 介于1.98%~5.32%。见表2。
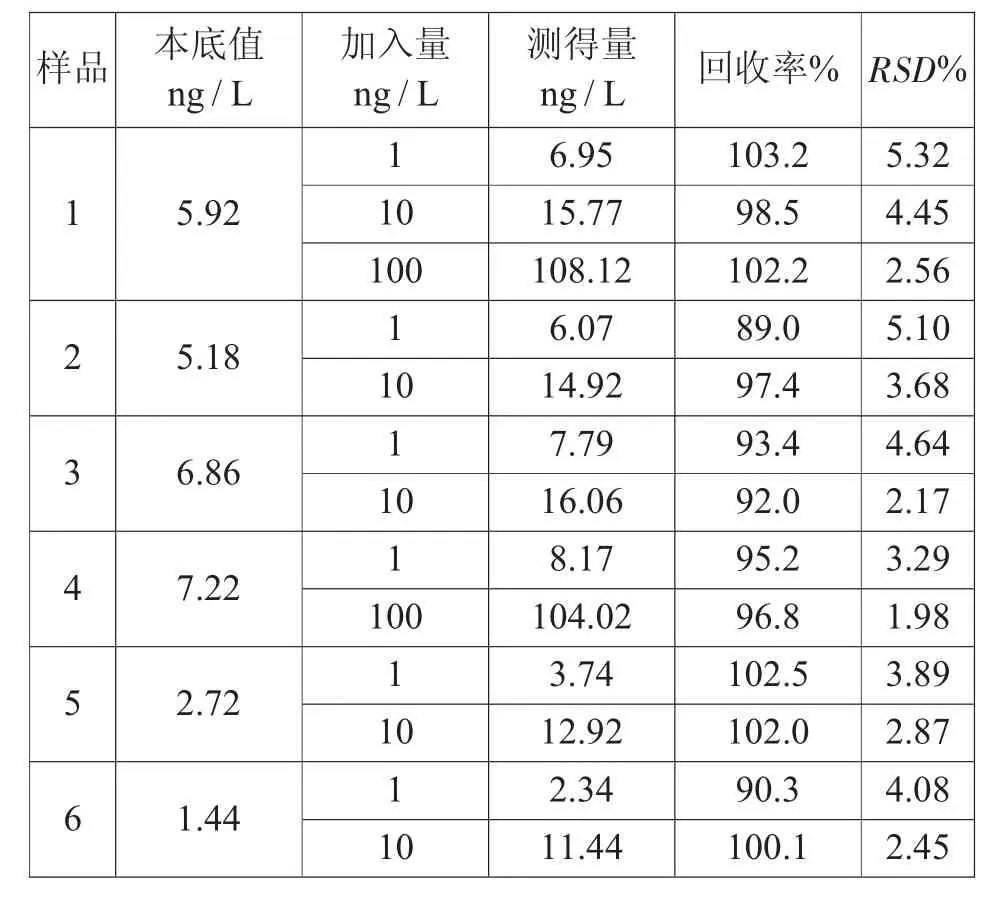
表2 方法的精密度和回收率(n=6)
3 结论
采用超声波辅助HS-SPME萃取葡萄酒中的TCA,可大大提高检测的灵敏度,方法检出限为0.2 ng/L,方法定量限为0.5 ng/L,线性范围1.0 ng/L~100 ng/L,RSD在1.98%~5.32%之间,加标回收率为89.0%~103.2%。该方法操作简便、快捷、准确,适用于普通实验室对葡萄酒中痕量TCA残留的检测。
[1]C.PEREIRA,L.GIL,L.CARRICO.Reduction of the 2,4,6-trichloroanisole content in cork stoppers using gamma radiation[J].Radiation Physics and Chemistry,2007(76):729-732.
[2]WHITFIELD FB,HILL JL,Shaw KJ.2,4,6-Tribromanisole a potential cause of mustiness in packaged food[J].Journal of Agricultural and Food Chemistry ,1997(45):889-893.
[3]HERESZTYN T.Metabolism of volatile phenolic compounds from hydroxyc in namic acids by Brettan am yces yeast[J].Arch M icrobiol,1986,146:96-98.
[4]CHATONNET P,DUBOURDIE D,BOIDRON J,et al.The origin of ethylphenols in wines[J].Journal of the Science of Food and Agriculture,1992,60(2):165-178.
[5]EVANS TJ,BUTZKE CE,EBELER SE.Analysis of 2,4,6-trichloroanisole in wines using solid-phase microextraction coupled to gas chromatography-mass spectrometry[J].Journal of Chromatography A,1997,786:293-298.
[6]C.PIZARRO,N.PEREZ-DEL-NOTARIO,J.M.GONZALEZ-SAIZ.Optimisation of a headspace solid-phase microextraction with on fiber derivatisation method for the direct determination of haloanisoles and halophenols in wine[J].Journal of Chromatography A,2007,1 143:26-35.
[7]C.PIZARRO,N.PEREZ-DEL-NOTARIO,J.M.GONZALEZ-SAIZ.Optimisation of maicrowave-assisted extraction method for the simulataneous determination of haloanisoles and halophenols in cork stoppers[J].Journal of Chromatography A,2007,1 149:138-144.
[8]R.Juanola,D.Subira,V.Salvado,et al.Evaluation of an extraction method in the determination of the 2,4,6-trichloroanisole content of tainted cork[J].Journal of Chromatography A,2002,953:207-214.
[9]OSCAR EZQUERRO,ALVARO GARRIDO-LOPEZ,MARIA TERESA TENA.Determination of 2,4,6-trichloroanisole and guaiacol in cork stoppers by pressurized fluid extraction and gas chromatography mass spectrometry[J].Journal of Chromatography A,2006,1 102:18-24.
[10]A.ZALZCAIN,G.L.ALONSO,C.LORENZO,et al.Stir bar sorptive extraction for the anaysis of wine cork taint[J].Journal of Chromatography A,2004,1 033:173-178.
[11]ALMUDENA MARTINEZ-UTUNUELA ,ISAAC RODRIGUEZ,RAFAEL CELA ,et al.Development of a solidphase extraction method for the simultaneous determination of chloroanisoles and chlorophenols in red wine using gas chromatography-tandem mass spectrometry[J].Analytica Chimica Acta ,2005,549:117-123.
[12]卫晓红,李燕,张燕,等.固相微萃取-气相色谱法测定葡萄酒及软木塞中 2,4,6-三氯苯甲醚(TCA)[J].酿酒科技,2010(4):92-93;95.
[13]邓晓军,郭德华,李波,等.葡萄酒中痕量木塞污染物的顶空固相微萃取-气相色谱串联质谱法检测[J].分析测试学报,2008,27(12):1 375-1 378.
[14]吴志坚,刘海宁,张慧芳.离子强度对吸附影响机理的研究进展[J].环境化学,2010,29(6):997-1 003.
Determination of trace 2,4,6-trichloroanisole(TCA)in wine by gas chromatography with ultrasonic oscillation assisted headspace solid phase micro-extraction(HS-SPME)
ZGABG Su-juan*LIANG Bao-aiSUN Li-ping LI Jian-zhen
(Shanxi province food quality safety supervision and inspection institute,Taiyuan 030012,China)
A new method used for the determination of trace contaminants of cork stoppers-2,4,6-trichloroanisole(TCA)in wine by Ultrasonic Oscillation assisted HS-SPME-GC,through the comparative study of pretreatment,extraction conditions and chromatographic separation condition optimization.The result shows that the method had taken on good linear relation with a correlation coefficient 0.999 89,the quantitative limit of the method was 0.5 ng/L,the repeatability(RSD)was from 1.98%to 5.32%,the recoveries were in the range of 89.0~103.2%.The method is simple,speediness,high accuracy,good reproducibility and suitable for general laboratory to detect trace TCA residues in wine.
TCA;ultrasonic wave; headspace solid phase microextraction(HS-SPME);wine
TS262.6
A
1673-6004(2012)01-0044-05
*张素娟,女,1975年出生,2003年毕业于吉林大学分析化学专业,高级工程师
2012-03-03
