EDTA浸出白钨矿的热力学分析
2011-12-31涂松柏曹才放赵中伟
涂松柏,曹才放,赵中伟
(中南大学 冶金科学与工程学院,湖南 长沙 410083)
0 前言
随着高品位钨矿资源的日益减少,从低品位白钨矿中提取钨已经变得越来越普遍。尽管传统的苏打高压浸出法可以直接处理品位低于1%的白钨矿,但是该过程反应条件苛刻,需要在高温高压下进行,并且苏打消耗量较大。关于如何更加经济、有效地从低品位白钨矿中提取钨的研究从未停止过。Payne[1]和Marshall[2]提出了用络合剂EDTA来浸出白钨矿的思路,并且做了相应的研究。该法基于如下反应:
CaWO4(s)=Ca2+(aq)+WO42-(aq)
Ca2+(aq)+Y4-=CaY2-(aq)
EDTA对钙离子有很强的络合作用,能够有效的结合CaWO4中的钙离子,使WO42-进入到水溶液里,从而达到分解白钨矿的目的。研究表明反应能够在常温常压的条件下进行;此外,有学者对EDTA分解白钨矿的工艺进行过改进:EDTA络合钙形成的CaY2-经过HCl处理可以重新形成EDTA酸,从而达到循环使用的目的。Konishi[3-4]和Ke[5]等人也做过类似的研究,均发现EDTA可以在较为温和的条件下有效的提取钨。虽然有多位学者对EDTA浸出白钨矿做过研究,但这些仅限于EDTA浸出白钨矿的工艺研究,从大体上来说,它们还停留在条件实验层面。还未见有学者对EDTA浸出白钨矿做过系统的理论研究。为此,作者对EDTA浸出白钨矿进行了热力学分析,从而期望能够对EDTA浸出白钨矿的过程进行理论指导。从文献[6]可以知道,采用溶解组分lgc-pH图,可以清楚的表示溶液中各组分的平衡浓度随pH值变化的趋势,适合于分析白钨矿的浸出过程。作者利用文献[7-10]中的数据,就白钨矿的EDTA分解绘制了溶解组分的lgc-pH图,并对分解过程的热力学进行了分析。
1 溶解组分lgc-pH图的绘制
1.1 热力学数据
白钨矿EDTA浸出过程可能发生的反应及其平衡关系式列于表1。所有热力学数据引自文献[7-10]。其中乙二胺四乙酸用H4Y表示。在酸度较低时,与钙配合的Y4-离子浓度较低,EDTA对白钨矿的浸出作用逐渐消失,因而本计算考察pH大于3的溶液平衡,且不考虑高酸度条件中存在的H5Y+和H6Y2+。

表1 Ca-W-Y-H2O体系的平衡反应及其平衡常数
1.2 热力学计算
根据Ca-W-Y-H2O系中存在的平衡,从游离的钨、钙、配离子Y的总浓度着手进行计算。
体系中游离钨的存在形态有:WO42-,HWO4-,H2WO4(aq),其平衡见表1中编号1、11~12式。设定[W]t为游离钨的总浓度,则按照物质守恒和同时平衡原理,得到:
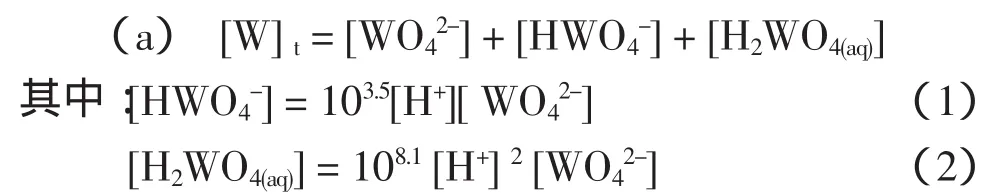
体系中游离Ca的存在状态有:Ca2+,Ca(OH)+,Ca(OH)2(aq),CaY2-,其平衡见表1中编号4~6式。设定[Ca]t为游离钙的总浓度,按照物质守恒和同时平衡原理,得到:
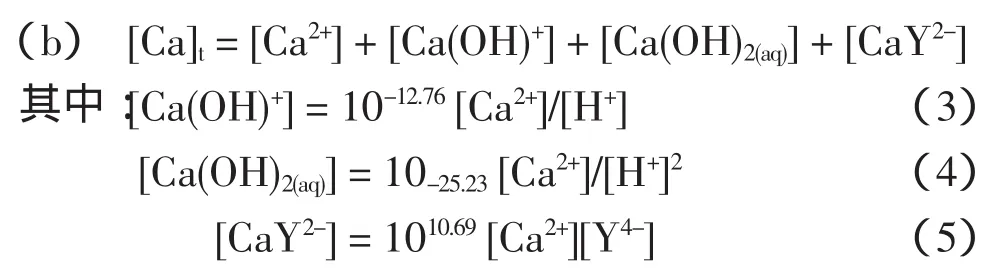
体系中游离Y的存在形态有Y4-,HY3-,H2Y2,H3Y-,H4Y,CaY2-,用[Y]t表示游离总EDTA浓度,同理得到:
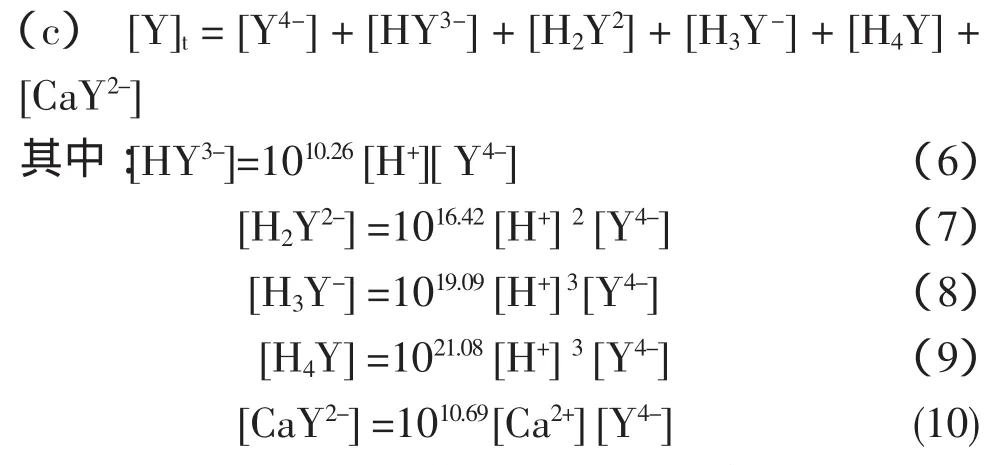
在pH值减小和增大时,CaWO4会分别转化成H2WO4沉淀,CaY2-络合物和Ca(OH)2沉淀。因此,应该根据体系固相组分的变化,分别考虑体系的平衡反应。
当体系中固体只有钨酸钙而无其他沉淀生成时,进入溶液的Ca和W均由钨酸钙提供,溶液中总钙和总钨浓度之比应等于钨酸钙的化学计量比,则有:

此时,溶液中各游离组分满足表1中编号2、4~14式。
当溶液pH值较低时,会有钨酸生成,溶液中各游离组分满足表1中编号1、2、4~13式;而在钨酸钙生成钨酸的边界pH值时,各游离组分满足表1中编号1、2、4~14式。当溶液pH值升高时,会有氢氧化钙生成,溶液中各游离组分满足表1中编号2~13式;而在钨酸钙生成氢氧化钙的边界pH值时,各游离组分满足表1中编号2~14式。
根据以上平衡关系,并利用文献[11]中的计算方法:在Excel里面采用数学估算法,可以绘制25℃下EDTA总浓度为0.1mol/L时Ca-W-Y-H2O体系各溶液组分的lgc-pH图,如图1。这种方法亦可计算出EDTA总浓度分别为0.001、0.01、0.1和1mol/L时25℃下溶液总钨和配离子Y4-的lgcpH图,如图2。

图1 Ca-W-Y-H2O体系溶解组分的lgc-pH图
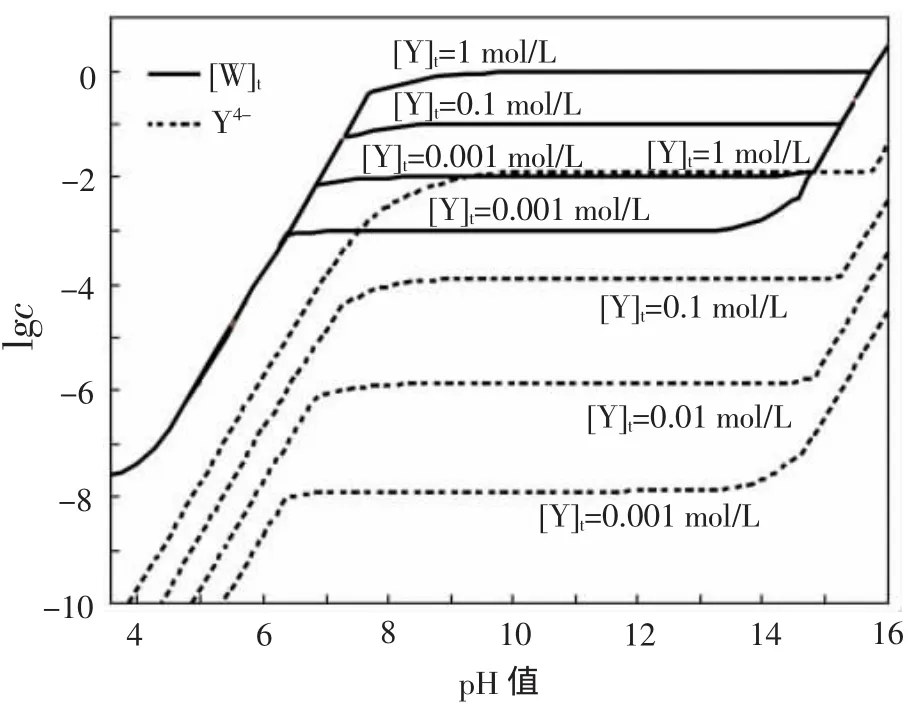
图2 不同EDTA总浓度时Y4-和总钨浓度的lgcpH图(25℃)
在缺少有关离子的活度系数的情况下,上面计算均以浓度代替活度。
2 白钨矿浸出的热力学分析
如图1,随着pH值增加,EDTA分解白钨矿的平衡体系分别存在钨酸稳定区、EDTA络合分解钨酸钙区、氢氧化钙稳定区。线①为生成钨酸的界线,此处pH值为7.3,线②为生成氢氧化钙的界限,此处pH值为15.3。
pH值小于4.1,溶液中钙主要以Ca2+的形态存在,而钨主要以钨酸的形式存在,这时候基本上可看作酸分解过程,EDTA对浸出的作用微弱。pH值在4.1~7.3之间,钨酸钙不稳定,转变为钨酸,同时由于配位作用,钙主要以CaY2-的形态存在,这时候白钨矿同时被EDTA和酸分解。pH值在7.3~15.3之间,为EDTA络合分解钨酸钙区,由于溶液中Y4-浓度增加,使得Ca2+大量被配位形成CaY2-,降低了溶液中Ca2+浓度,从而促进白钨矿的分解。这一区域钨主要以钨酸根的形式进入溶液,EDTA分解白钨矿主要发生在这一区域。当pH值大于15.3,由于氢氧化钙的形成,溶液中Ca2+进一步下降,从而使得溶液中钨浓度迅速增加。这一阶段主要为碱分解。
EDTA的存在形态对白钨矿的分解至关重要。因为其分解过程是依赖Y4-与Ca2+的配位作用。由图2可见,Y4-浓度随着EDTA总浓度的升高而升高,因此增加EDTA的用量可以较大幅度的改善分解。而在EDTA总浓度一定的情况下,Y4-的浓度与pH值直接有关。由图2可见,随着pH值升高,溶液中Y4-的浓度逐渐升高,并在pH值7~9以后出现一个平台,平台的终点大致在pH值14~16之间。而在某一EDTA总浓度固定的情况下,溶液中总钨浓度与Y4-浓度的变化趋势一致,也存在有一个平台,这时候溶液pH值对总钨浓度没有太大影响,EDTA发挥着最大的分解能力。
为了更清楚地看到pH值变化对溶液中总钨浓度的影响,以EDTA总浓度1mol/L为例,做出溶液总钨的c-pH图,如图3所示。由图3可以更加明显的看出:在pH值为7以后,总钨浓度随着pH值的增加急剧增大,继续增加pH值,总钨浓度会出现一个平台,不再变化,从计算结果来看,这个平台的范围大致在pH值11~15.8之间。
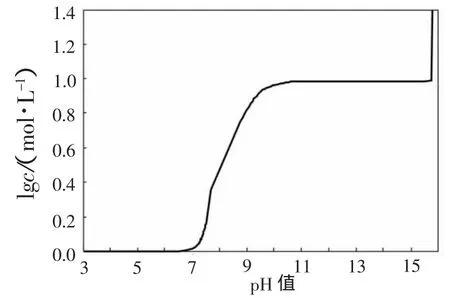
图3 EDTA总浓度为1mol/L时总钨浓度的cpH图(25℃)
常见的EDTA试剂为乙二胺四乙酸二钠或者乙二胺四乙酸,这些试剂具有一定酸性。由热力学分析,要保证白钨矿被EDTA有效分解,需要根据溶液EDTA总浓度,调节溶液pH值,使得总钨浓度能达到EDTA的最大浸出能力。例如溶液EDTA浓度为0.1mol/L时,pH值控制在9~14之间,能够保证EDTA主要以Y4-的形式存在,并且pH值在这个范围内变化时,Y4-的浓度基本上没有变化,因而EDTA的分解能力也基本上没有变化,已经达到最大浸出能力,从而保证最佳分解效果。文献[4]用浓度为0.1mol/L的EDTA浸出白钨矿时发现,pH值11时,白钨矿的分解效果较好。文献[5]研究表明pH值在9~13之间变化时,EDTA分解白钨矿都可以达到较好的效果。这些实验条件均落在理论分析的pH值9~14的范围。
3 结论
(1)运用现有热力学数据,通过计算,绘制了25℃下白钨矿在0.1mol/L的EDTA溶液中各主要溶解组分的lgc-pH图,以及不同EDTA浓度时EDTA配离子Y4-和WO42-的lgc-pH图。
(2)运用热力学平衡图,分析了EDTA分解白钨矿的热力学条件,认为溶液中Y4-的浓度直接影响白钨矿的分解。EDTA浓度越高,Y4-的浓度也越高;随着体系pH值的增加,H4Y将依次电离成H3Y-、H2Y2-、HY3-、Y4-,使EDTA的分解能力逐步增强。但是碱度增加到一定时候,Y4-浓度基本不再变化,EDTA的分解能力达到最大。以EDTA总浓度1mol/L为例,pH值在大约11~15.8时,EDTA主要以Y4-的形式存在,此时可以发挥最好的分解能力。
[1]Payne C M.The extraction of tungsten values from scheelite ores using a sequestering agent[J].N.Z.J.Sci,1969,12:13-26.
[2]Marshall R E.Hydrometallurgical extraction of tungsten from low grade residue dumps[J].Proc.Australas.Inst.Min.Metall,1983,287:47-50.
[3]Konishi Y,Katada H,Asai S.Kinetics of the dissolution of scheelite in aqueous Na4EDTA solutions[J].Metall.Trans.B,1987,18B:331-337.
[4]Konishi Y,Katada H,Asai S.Leaching Kinetics of Tungsten from Low-Grade Scheelite Ore in Aqueous Na4EDTA Solutions[J].Hydrometallurgy,1990(23):141-152.
[5]Ke J J,Yue L D,Liu W D.Kinetics of dissolution of synthetic scheelite by an alkaline EDTA leach solution[J].Hydrometallurgy,1986(16):325-334.
[6]赵中伟,曹才放,李洪桂,等.碳酸钠分解白钨矿的热力学分析[J].中国有色金属学报,2008,18(2):357-360.
[7]Asare O K.Solution Chemistry of Tungsten Leaching Systems[J].Metallurgical Transaction B,1982,13:555-564.
[8]Dean J A.Lange's Handbook of Chemistry (16th Edition)[M].New York:McGraw-Hill,2005.
[9]Guy V,Jacques L.Calculation of the solubility diagrams in the system Ca(OH)2-H3PO4-KOH-HNO3-CO2-H2O[J].Journal of Crystal Growth,1990,104(4):820.
[10]杭州大学化学系分析化学教研室.分析化学手册[M].北京:化学工业出版社,2003.
[11]赵中伟,胡宇杰,李洪桂,等.一种用EXCEL进行冶金热力学平衡计算的新方法[J].稀有金属与硬质合金,2005,33(1):49-51.
