纤维素酶在不同长度纤维上的吸附行为
2011-12-31詹怀宇付时雨
吕 健 詹怀宇 付时雨
(华南理工大学制浆造纸工程国家重点实验室,广东广州,510640)
在生物质能源替换传统石化能源的过程中,纤维素乙醇扮演着重要的角色[1]。纤维素乙醇是以自然界大量存在的纤维素为原料,通过糖化、发酵的过程得到的。纤维素的糖化过程始于纤维素酶吸附于纤维素,形成复杂的纤维素-纤维素酶复合结构,各种纤维素酶分子进而攻击纤维素,降解生成葡萄糖及可溶性糖。研究证明,纤维素酶的吸附平衡常数与纤维素水解速率有强烈的对应关系[2],因此,纤维素酶在纤维素上的吸附在一定程度上决定了纤维素酶水解的效率。用于定量描述纤维素酶吸附的模型主要有Langmuir吸附等温式[3-5]和Freundlich吸附等温式[6]。虽然纤维素酶在纤维素上的吸附并不完全满足Langmuir吸附和Freundlich吸附的假设,但实际应用中两者对实验数据都表现出很好的拟合性,可以在工程中近似应用。
从已有的研究来看,纤维的结晶结构和形态不同,纤维素酶的吸附行为也不同[5,7-8]。用于纤维素乙醇工业的纤维来源以及处理方式不同,其尺寸差别很大,其中表现最直观的就是纤维长度不同。定量研究纤维素酶在不同长度纤维上的吸附,对后续的酶水解过程有重要的指导意义。用于纤维素酶水解糖化的底物主要为经过预处理的木质纤维原料,不可避免保留大量木素,造成纤维素酶的无效吸附。本研究旨在探讨纤维素酶在纤维上的吸附,不考虑其在木素上的无效吸附,故选择漂白木浆纤维为底物,以进一步探知纤维素酶在不同长度纤维上的等温吸附,以及吸附的热力学性质。
1 实验
1.1 实验药品、原料及仪器
漂白针叶木浆:购自Buckeye Cellulose工厂;纤维素酶:Cellic CTec,购自Novozyme公司,酶活力66FPU/mL,蛋白质含量137mg/L;蛋白质检测包:BCA蛋白质检测试剂包,购自ThermoFisher Scientific公司;柠檬酸-柠檬酸钠缓冲溶液,pH值4.8。
离散式全自动化学分析仪(DA3500):美国O.I.Analytical公司生产;结合BCA蛋白质检测试剂包,用于溶液中蛋白质的定量测定。
1.2 不同长度纤维的筛分
将漂白针叶木浆浸泡于蒸馏水中,约2h待充分润胀后用纤维疏解器疏解纤维。为了避免纤维性质发生改变,在低浓(约0.5%,质量分数)和低转数(约500转)条件下进行疏解。使用圆柱形水力旋流器筛分疏解分散好的纤维,分别收集28目、48目和100目不同长度的纤维,风干后待用。
1.3 纤维素酶的吸附动力学实验
首先用缓冲溶液将纤维素酶稀释至不同体积分数(0.05%、0.1%和0.2%),然后将0.2g(绝干)纤维分散在10mL上述不同体积分数的酶溶液中,配成0.2%(质量分数)的纤维悬浮液。将配好的纤维悬浮液置于振荡水域中进行吸附实验,保持温度20℃、转速120r/min。每隔一定时间,取出样品,用0.2μm的玻璃纤维过滤器过滤,取滤液进行蛋白质分析。溶液中初始蛋白质含量与滤液中蛋白质含量之差即为吸附的蛋白质含量。
1.4 纤维素酶的等温吸附
将0.2g(绝干)纤维分散在10mL不同体积分数(0.02%~0.2%)的纤维素酶溶液中。将配好的纤维悬浮液置于振荡水域中进行吸附实验,恒定温度、转速120r/min。待吸附平衡后,取出样品,用0.2μm的玻璃纤维过滤器过滤,取滤液进行蛋白质分析。溶液中初始蛋白质含量与滤液中蛋白质含量之差即为吸附的蛋白质含量。被吸附的纤维素酶含量通过纤维素酶与蛋白质的转换关系得到。
2 结果与讨论
2.1 纤维素酶在纤维素上的吸附动力学
纤维素酶在纤维上的吸附是一个动态过程,随吸附时间的延长,其吸附量不断变化。但是,纤维素酶的吸附同样存在平衡状态,即吸附达到一定程度后,吸附量达到饱和。研究表明,纤维素酶在纤维上的吸附平衡时间约为30~60min[9-10]。在不同实验条件下,纤维来源不同,其吸附性质也存在差异。在本实验条件下,研究了不同体积分数的Cellic CTec在漂白针叶木浆上的吸附动力学,以确定吸附平衡时间。纤维素酶溶液初始的体积分数分别为0.05%、0.1%和0.2%,其吸附的蛋白质含量随时间的变化如图1所示。
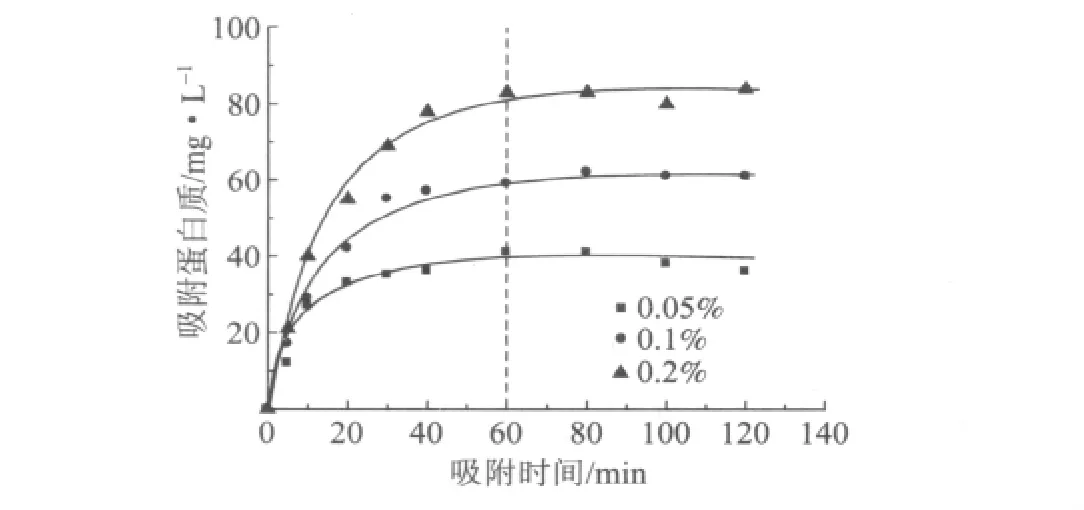
图1 不同体积分数的纤维素酶在漂白针叶木浆上的吸附动力学
从图1可以看出,纤维素酶在漂白针叶木浆上的吸附均表现为先快速吸附,然后缓慢吸附直至达到吸附平衡;同时,可在低体积分数的纤维素酶(对纤维来说,纤维素酶用量低)溶液中快速达到吸附平衡;在本实验最高体积分数(0.2%)的纤维素酶溶液中,吸附平衡发生在60min左右。由于下述等温吸附实验初始纤维素酶体积分数均不超过0.2%,因此,认为所有吸附实验均在60min达到吸附平衡。
2.2 纤维素酶在不同长度纤维上的等温吸附
在实验中发现,不同长度纤维的酶水解行为差别很大,这主要是由纤维素酶与纤维相互作用引起的。不同长度纤维的物理结构如孔隙率、比表面积都不相同,这决定了其与纤维素酶的吸附存在差异。为了研究纤维素酶与不同长度纤维的吸附行为,使用不同体积分数(0~0.2%)的Cellic CTec在2%(质量分数)纤维悬浮液中进行吸附平衡实验,其结果如图2所示。3种长度的纤维分别标示为28目、48目和100目,分别表示截留在28目筛网上、截留在28目筛网和48目筛网之间、截留在48目筛网和100目筛网之间的纤维,其物理性质如表1所示。由表1可知,3种纤维的差别主要在于纤维长度和扭结角。
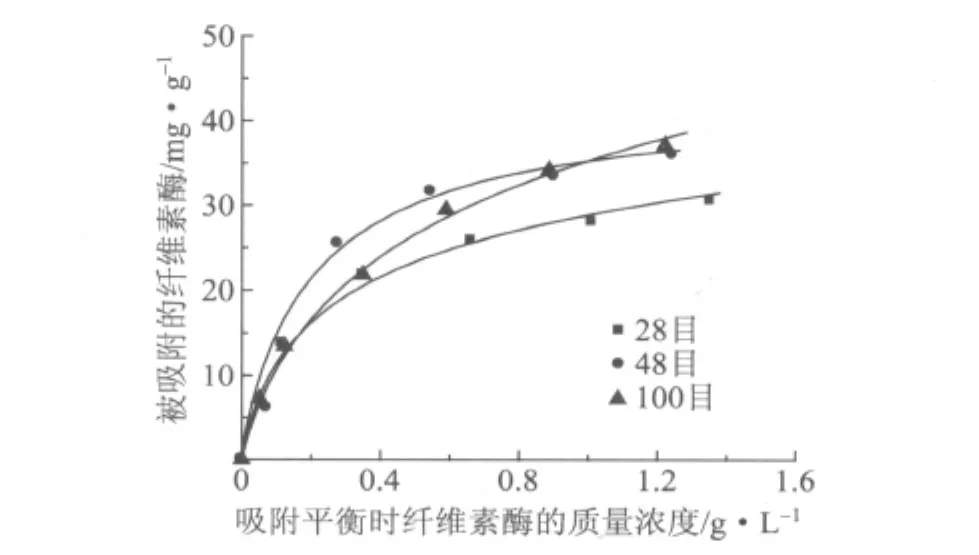
图2 20℃时纤维素酶在不同长度纤维上的吸附等温线
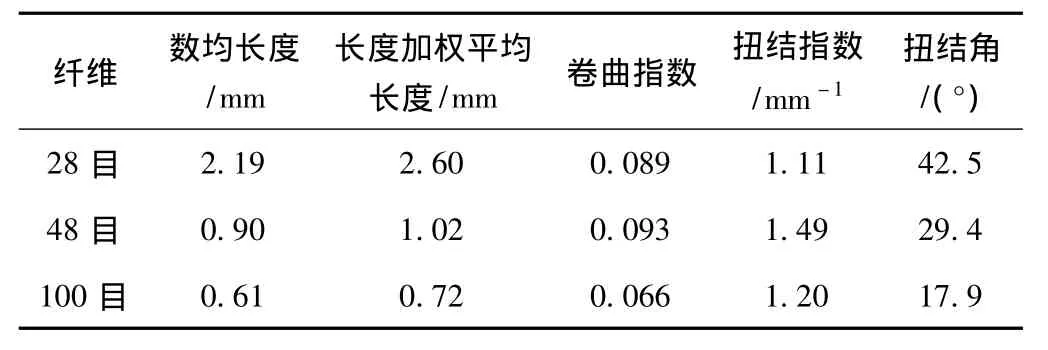
表1 3种纤维的物理性质
分别利用Langmuir吸附等温式和Freundlich吸附等温式对图2中的数据进行计算,以确定何种吸附等温式更能准确描述纤维素酶在纤维上的吸附。
2.2.1 Langmuir吸附等温式

式(1)中,Ed表示被吸附的纤维素酶含量,Emax表示纤维素酶的最大吸附量,Ef表示吸附平衡时溶液中的纤维素酶含量,Kd表示Langmuir吸附平衡常数。
将式(1)写成线性形式,可得
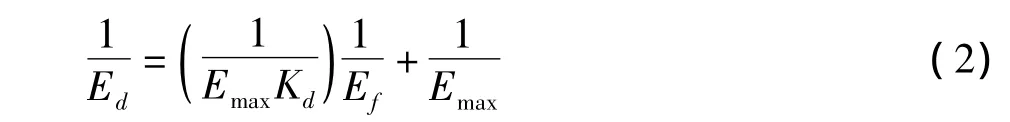
2.2.2 Freundlich吸附等温式

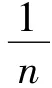
同样,将式(3)写成线性形式,可得

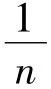
分别计算得到20℃时纤维素酶在不同长度纤维上的Langmuir等温吸附常数和Freundlich等温吸附常数(见表2)。
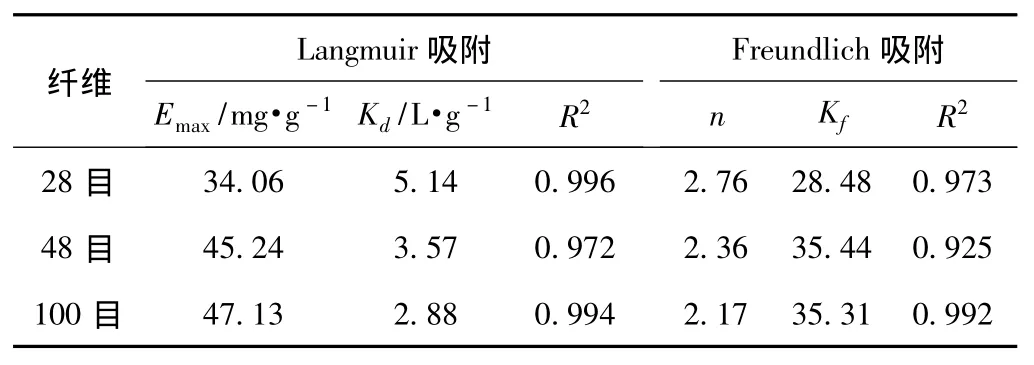
表2 20℃时纤维素酶在不同长度纤维上的等温吸附常数
从表2可知,Langmuir吸附等温式对实验数据拟合得更好,更能从本质上表现出纤维素酶的吸附性质。随纤维长度减小(从48目到100目),纤维素酶在纤维上的最大吸附量增加(从34.06mg/g增加到47.13mg/g),Langmuir吸附平衡常数下降(从5.14L/g下降到2.88L/g)。由于短纤维相对于长纤维具有更大的比表面积,而吸附量与吸附介质的比表面积是成正比的,因此,纤维素酶在100目纤维上具有最大的吸附量。纤维素酶在28目长纤维上有最大的吸附平衡常数,说明纤维素酶更容易在长纤维上达到吸附平衡。
2.3 纤维素酶吸附的热力学性质
为了进一步探讨纤维素酶在纤维上的吸附机理,需要研究纤维素酶的吸附热力学性质。通过改变温度(5、20、35、50℃),研究了纤维素酶Cellic Ctec在不同长度纤维上的Langmuir等温吸附线(见图3)。
根据Van’t Hoff方程,有
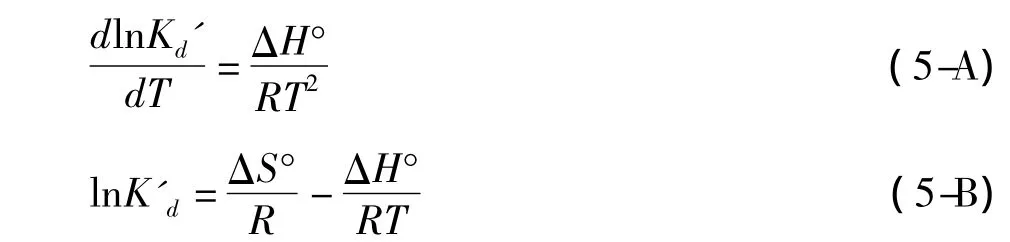
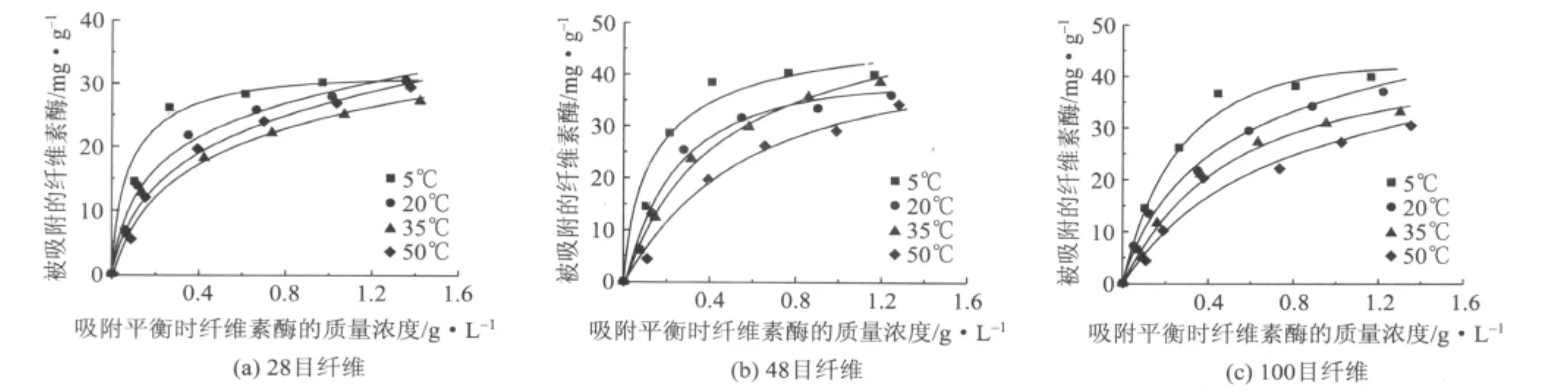
图3 纤维素酶在不同温度和不同长度纤维上的等温吸附
式(5-A)和式(5-B)中,Kd’、ΔH°、ΔS°、R和T分别代表Langmuir吸附平衡常数(L/mol)、吸附焓变(J/mol)、吸附熵变(J/(K·mol))、气体常数(8.314J/(mol·K))和温度(K)。值得注意的是,式中的K’d与2.2节中的Langmuir吸附平衡常数Kd关系为

式(6)中,MA为纤维素酶的摩尔质量,根据文献[11],其取值范围为41000~67000g/mol。为方便计算,本研究取值为60000g/mol。
根据吉布斯自由能的定义

可以得到吉布斯自由能与平衡常数的关系

根据式(5)~式(8),可以计算出纤维素酶在不同长度纤维上吸附的热力学常数(见表3)。
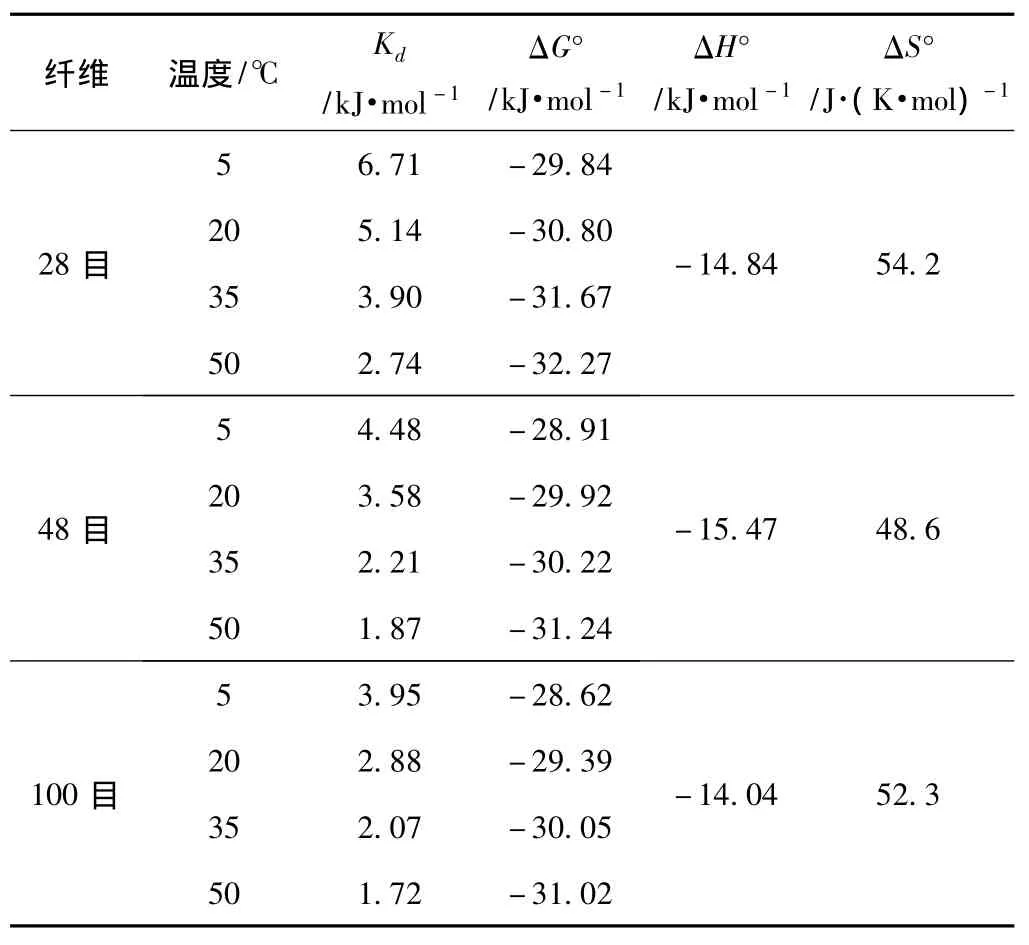
表3 纤维素酶在不同长度纤维上吸附的热力学常数
从表3可以看到,随温度的升高,Langmuir吸附平衡常数减小,说明纤维素酶在低温下可更快地与纤维素达到吸附平衡。ΔG°=ΔH°-TΔS°<0,表明纤维素酶在不同长度纤维上的吸附都是自发过程。随温度的升高,ΔG°的绝对值增加,说明吸附过程的自发程度增加,这对3种长度纤维都是适用的。在相同温度下,ΔG°绝对值随纤维长度的减小而减小。一般来说,当ΔG°的范围在0~-20kJ/mol时,吸附为物理吸附;当ΔG°的范围在-80~-400kJ/mol时,吸附为化学吸附[12]。表3中ΔG°均处于-28.62~-32.27kJ/mol之间,说明纤维素酶在3种长度纤维上的吸附同时存在物理吸附和化学吸附。从表3还能看出ΔH°为负值,表明吸附是放热过程。纤维素酶在3种长度纤维上的吸附焓变相近,在48目纤维上吸附的放热程度稍大。反应熵变ΔS°>0,说明纤维素和酶分子的吸附界面上的无序程度增加,在28目纤维上吸附的无序程度增加最大。另外,所有吸附过程的ΔH°<0、ΔS°>0,说明正反应过程即吸附过程是自发进行的,但是如果在只改变温度条件下,逆反应过程即解吸过程的ΔG°>0,即解吸不可能自发进行,这证明诸多文献中提到的纤维素酶的吸附是不可逆的结论[13-15]。
3结语
本研究探讨了纤维素酶在不同长度纤维上的吸附过程,吸附动力学表明酶吸附量随初始酶用量的增加而增大,吸附达到平衡的时间约为60min。纤维素酶在不同长度纤维上的等温吸附平衡满足Langmuir吸附等温式,最大吸附量随纤维长度增加而减小;而Langmuir吸附平衡常数随纤维长度增加而增加,表明纤维素酶在长纤维上可更快达到吸附平衡。在5~50℃范围内,纤维素酶Langmuir吸附平衡常数随温度升高而减小。吸附的热力学常数表明纤维素酶在纤维上的吸附介于物理吸附和化学吸附之间,是自发、放热,且不可逆的过程。吸附吉布斯自由能变化ΔG°随纤维长度减小而减小,但吸附焓变ΔH°和吸附熵变ΔS°与纤维长度关系不大。对3种长度的纤维,纤维素酶在48目纤维上有最大的吸附焓变ΔH°,在28目纤维上有最大的吸附熵变ΔS°。如果能把纤维素酶的吸附平衡常数及吸附热力学常数与后续的纤维素酶解糖化动力学结合,将为深入探索纤维素酶降解的本质提供途径。
[1]Brethauer S,Wyman C E.Review:Continuous hydrolysis and fermentation for cellulosic ethanol production[J].Bioresource Technology:2010,101(13):4862.
[2]Klyosov A A.Trends in biochemistry and enzymology of cellulose degradation[J].Biochemistry:1990,29(47):10577.
[3]Kadam K L,Rydhom E C,McMillan J D.Development and validation of a kinetic model for enzymatic saccharification of lignocellulosic biomass[J].Biotechnology Progress:2004z,20(3):678.
[4]Lu Y P,Yang B,Gregg D,et al.Cellulase adsorption and an evaluation of enzyme recycle during hydrolysis of steam-exploded softwood residues[J].Applied Biochemistry and Biotechnology:2002,98:641.
[5]Ooshima H,Sakata M,Harano Y.Adsorption of cellulase from Trichoderma-viride on cellulose[J].Biotechnology and Bioengineering:1983,25(12):3103.
[6]Medve J,Stahlberg J,Tjerneld F.Isotherms for adsorption of cellobiohydrolase I and II fromTrichoderma reeseion microcrystalline cellulose[J].Applied Biochemistry and Biotechnology:1997,66(1):39.
[7]Mooney C A,Mansfield S D,Beaston R P,et al.The effect of fiber characteristics on hydrolysis and cellulase accessibility to softwood substrates[J].Enzyme and Microbial Technology:1999,25(8/9):644.
[8]Ramos L P,Nazhad M M,Saddler JN.Effect of enzymatic hydrolysis on the morphology and fine structure of pretreated cellulosic residuals[J].Enzyme and Microbial Technology:1993,15(10):821.
[9]Lynd L R,Weimer P J,van Zyl WH,et al.Microbial cellulose utilization:fundamentals and biotechnology[J].Microbiology and Molecular Biology Reviews:2002,66(3):506.
[10]Tu M B,Chanadra R P,Saddler J N.Recycling cellulases during the hydrolysis of steam exploded and ethanol pretreated lodgepole pine[J].Biotechnology Progress:2007,23(5):1130.
[11]Ericsen J,Goksoyr J.Cellulases fromChaetomium-Thermophilevar.dissitum[J].European Journal of Biochemistry:1977,77(3):445.
[12]Jaycock M J,Parfitt G D.Chemistry of Interface[M].New York:Halsted Press,1981.
[13]Kyriacou A,Neufeld R J,MacKenzie C R.Reversibility and competition in the adsorption ofTrichoderma reeseicellulase components[J].Biotechnology and Bioengineering:1989,33(5):631.
[14]Carrard G,Linder M.Widely different off rates of two closely related cellulose-binding domains fromTrichoderma reesei[J].European Journal of Biochemistry:1999,262(3):637.
[15]Beltrame P L,Carniti P,Focher B,et al.Cotton cellulose:enzyme adsorption and enzymatic hydrolysis[J].Journal of Applied Polymer Science:1982,27(9):3493.
