半滑舌鳎病原鳗利斯顿氏菌双重PCR检测方法的研究
2011-12-28张晓君阎斌伦梁利国秦国民毕可然
张晓君,阎斌伦,梁利国,秦国民,毕可然
(淮海工学院 海洋学院 江苏省海洋生物技术重点建设实验室,江苏 连云港 222005)
半滑舌鳎病原鳗利斯顿氏菌双重PCR检测方法的研究
张晓君,阎斌伦,梁利国,秦国民,毕可然
(淮海工学院 海洋学院 江苏省海洋生物技术重点建设实验室,江苏 连云港 222005)
对引起江苏连云港工厂化养殖半滑舌鳎大量死亡的病原鳗利斯顿氏菌,进行了基于溶血素和金属蛋白酶两种基因的双重PCR检测。根据鳗利斯顿氏菌溶血素基因和金属蛋白酶基因序列设计2对特异性引物,在同一PCR反应体系中,鳗利斯顿氏菌可同时扩增出上述2种基因片段,扩增片段大小分别为493 bp和248 bp,两对引物对5种其他水产动物病原菌无交叉反应,敏感性检测结果为该双重PCR最低能检测8×102CFU/mL的鳗利斯顿氏菌,最低能检测0.171 875 ng/µL的鳗利斯顿氏菌基因组DNA。对发病半滑舌鳎溃疡组织、肝脏及养殖用水进行双重PCR检测,呈阳性反应的样品可分离出优势生长的鳗利斯顿氏菌。该实验表明两种不同基因综合检测病原鳗利斯顿氏菌,进一步提高了其PCR检测的准确性和特异性,建立了一种病原鳗利斯顿氏菌快速、准确的双重PCR检测方法。
半滑舌鳎;鳗利斯顿氏菌;溶血素基因;金属蛋白酶基因;双重PCR
随着半滑舌鳎(Cynoglossus semilaevis)养殖规模不断扩大,病害问题日趋严重,尤其是由鳗利斯顿氏菌(Listonella anguillarum)引起的大量死亡在多家养殖场频繁发生,已构成制约其养殖发展的重大障碍,给养殖生产造成了很大的经济损失[1,2]。鳗利斯顿氏菌是水产养殖动物中常见且重要的病原菌,该菌于1985年由MacDonell和Colwell等提议由弧菌属(Vibrio Pacini 1954)转入利斯顿氏菌属(Listonella MacDonell and Colwell 1986),该菌传统的检验方法包括形态学检测、生理生化特征检测等,这些检测手段不仅工作量大,而且耗时长, 已远远不能满足水产养殖生产上的诊断要求。因此选择合适的分子靶标,研究开发灵敏度高、特异性强的病原鳗利斯顿氏菌简便、快速检测方法已十分重要,在水产养殖动物处于带菌状态或大规模爆发细菌性疾病之前能进行准确的检测,这是传统方法无法比拟的。尤其是多种不同基因综合检测以进一步提高其准确性和特异性,将为鳗利斯顿氏菌引起的水产病害的监测及控制奠定良好的基础。
水产动物病原菌在生长和繁殖过程中,细胞不断向环境中释放出代谢产物,这些代谢产物对于细胞吸收营养物质、吸附和入侵宿主机体、在宿主体内扩散、繁殖以及抵抗宿主免疫因子的免疫作用等具有极为重要的作用。如胞外蛋白酶、溶血素、细胞毒素等胞外产物是对宿主产生毒性的主要物质,可以直接破坏宿主机体的体质,引起宿主的发病甚至死亡。目前溶血素及胞外蛋白酶被认为是鳗利斯顿氏菌重要的毒力因子[3-6],本文以编码溶血素和金属蛋白酶的两种基因为靶基因建立了快速检测病原鳗利斯顿氏菌的双重PCR方法,病原鳗利斯顿氏菌可扩增出大小约 493 bp的溶血素基因和大小约248 bp的金属蛋白酶基因,水产养殖生产中常见的病原哈氏弧菌、爱德华氏菌、美人鱼弧菌、鱼肠道弧菌及副溶血弧菌等均未扩增出特异性条带,表明该双重PCR可用于鳗利斯顿氏菌的快速检测,并具有较高的准确性和特异性。
1 材料与方法
1.1 菌株
供试鳗利斯顿氏菌分离自江苏连云港赣榆县工厂化养殖半滑舌鳎发病幼鱼,供试对照副溶血弧菌(Vibrio parahaemolyticus)、哈氏弧菌(Vibrio harveyi)、美人鱼弧菌(Vibrio damsela)、鱼肠道弧菌(Vibrio ichthyoenteri)及爱德华氏菌(Edwardsiella tarda)均分离自发病水产养殖动物,已通过表型及分子鉴定[7-11],本实验室保存供用,菌株编号及在GenBank 登录号见表1。

表1 供试菌株及其来源Tab. 1 Origin and species of tested bacteria
1.2 细菌模板DNA的制备
试验所需细菌模板DNA按细菌基因组DNA抽提试剂盒及煮沸两种方法提取。
细菌基因组DNA抽提试剂盒法:取纯培养菌分别接种于含盐1 %的LB肉汤中28℃培养16 h,按上海赛百盛基因技术有限公司生产的小量细菌基因组DNA抽提试剂盒所述方法提取DNA,作为PCR模板。
煮沸法:取1 mL菌液离心1 min(12 000 r/min),弃上清,将菌体悬浮于 100 µL的灭菌蒸馏水中,100℃煮沸10 min,冰浴中冷却后离心10 min(12 000 r/min), 取上清作为PCR模板。
1.3 引物设计与合成
以溶血素基因为靶基因设计鳗利斯顿氏菌的特异性检测引物:正向引物序列为 5'-TGC GCT ATA TTG TCG ATT TCA GTT-3',反向引物序列为5'-GCA CCC GTT GTA TCA TCA TCT AAG-3',目的片段大小约为493 bp;以金属蛋白酶基因为靶基因设计鳗利斯顿氏菌的特异性检测引物:正向引物序列为 5'-CCT TTA ACC AAG TGG GCG TA-3',反向引物序列为5'-CGA TTT GTT GTA AGG GCG ACA AT-3',目的片段大小约为248 bp[12]。2对引物均由上海生物工程技术公司合成。
1.4 PCR各反应条件的优化及电泳分析
以溶血素和金属蛋白酶2种基因设计的引物分别对模板进行单一扩增;在同一次PCR反应中, 应用同一个PCR反应程序, 用上述2种引物同步对模板进行扩增。对PCR各循环参数和各引物浓度等进行优化,筛选出单一PCR及双重PCR反应中最佳反应模式。
PCR扩增后的产物,用1.2%琼脂糖凝胶在80 V下电泳45 min,用凝胶成像系统观察并拍照记录。
1.5 双重PCR反应的特异性检测
以副溶血弧菌、哈氏弧菌、美人鱼弧菌、鱼肠道弧菌及爱德华氏菌为对照菌株,按上述优化的反应条件进行PCR扩增,分别进行上述2对引物双重PCR的特异性检验。
1.6 PCR反应的灵敏性检测
分别从菌液稀释以及模板DNA稀释2方面来检测方法的灵敏性。
菌液稀释:浓度为8×108CFU/mL的鳗利斯顿氏菌培养物分别用灭菌双蒸水进行 10倍系列稀释为:8×108CFU/mL、8×107CFU/mL、8×106CFU/mL、8×105CFU/mL、8×104CFU/mL、8×103CFU/mL、8×102CFU/mL、8×10 CFU/mL、8 CFU/mL、8×10-1CFU/mL,共10个稀释倍数,按1.2所述煮沸法,取1 mL菌液提取DNA作为PCR模板进行检测。
模板DNA稀释:小量细菌基因组DNA抽提试剂盒提取的鳗利斯顿氏菌基因组DNA,从88ng/µL起 2 倍连续稀释为:88 ng/µL、44 ng/µL、22 ng/µL、11 ng/µL、5.5 ng/µL、2.75 ng/µL、1.375 ng/µL、0.687 5 ng/µL、0.343 75 ng/µL、0.171 875 ng/µL、0.085 937 5 ng/µL,共11个稀释倍数,按上述方法进行PCR检测。
1.7 发病半滑舌鳎及养殖用水双重PCR检测
取连云港赣榆工厂化养殖出现腹水及溃疡的发病半滑舌鳎,无菌操作取溃疡病变组织及肝脏匀浆后用营养肉汤增菌培养 6 h, 池塘养殖用水同样用营养肉汤增菌培养6 h,增菌液提取DNA并进行PCR扩增。同时发病半滑舌鳎按常规方法进行细菌分离及检测。
2 结 果
2.1 双重PCR检测方法的确定
通过对不同反应条件下DNA扩增结果的比较,确定了鳗利斯顿氏菌的最佳双重PCR模式。以溶血素和金属蛋白酶基因为靶基因同步检测的 PCR反应条件为:95℃预变性3 min,接94℃变性1 min、55℃复性1 min、72℃延伸2 min、30个循环,然后72℃温育 6 min。在 40 µL反应体系中含有:水28.8 µL,10×PCR 缓冲液 4 µL,MgCl2(25 mM)3.2 µL,4×dNTP 混合物 0.8 µL,引物各 0.4 µL,Taq DNA 聚合酶(5 U/µL)0.4 µL,模板 DNA 2 µL。
2.2 单一及双重PCR特异性扩增结果
应用上述 PCR检测方法对鳗利斯顿氏菌和其它水产动物病原菌基因组DNA分别进行单一及双重 PCR 扩增,结果以溶血素基因为靶基因单一扩增,鳗利斯顿氏菌株只扩增出约493 bp一条带;以金属蛋白酶基因为靶基因单一扩增,鳗利斯顿氏菌株只扩增出248 bp一条带;以溶血素和金属蛋白酶2种基因为靶基因同步扩增,鳗利斯顿氏菌株可扩增出493 bp和248 bp 2条带,而其它5种水产动物病原菌(副溶血弧菌、哈氏弧菌、美人鱼弧菌、鱼肠道弧菌及爱德华氏菌)均未出现目的扩增条带(图1)。表明本实验建立的鳗利斯顿氏菌双重PCR检测方法具有较强的特异性。
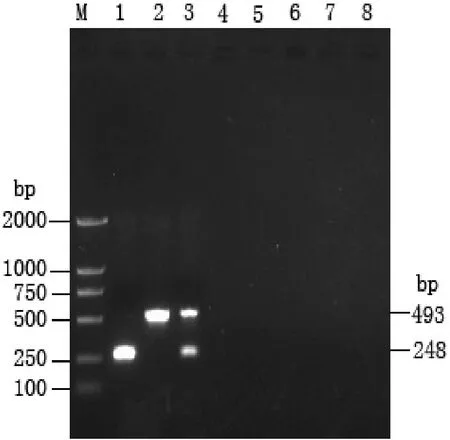
图1 鳗利斯顿氏菌单一及双重PCR特异性检测结果M, DL2000; 1, 金属蛋白酶基因扩增片段; 2, 溶血素基因扩增片段; 3,溶血素和金属蛋白酶基因同步扩增片段;4-8, 5种病原菌对照Fig. 1 Specificity of single-duplex PCR for detection of L. anguillarum M, DL2000; 1, amplified fragment of metalloprotease; 2, amplified fragment of hemolysin; 3, simultaneous amplified fragments of hemolysin and metalloprotease; 4-7, control of five pathogenic bacteria
2.3 菌液稀释双重PCR检测的灵敏度
菌液系列稀释后按 1.2所述煮沸方法提取DNA,按2.1优化出的双重PCR反应条件进行检测,结果在40 µL反应体系中,模板DNA加入2 µL,菌体浓度自 8×106~8×108CFU/mL均可扩增出清晰条带,菌体浓度为8×102~80×105CFU/mL扩增条带暗淡,菌体浓度在 8×10-1CFU/mL至80CFU/mL均未扩增出条带(图 2),表明本实验建立的双重PCR方法检测鳗利斯顿氏菌菌体灵敏为8×102CFU/mL。
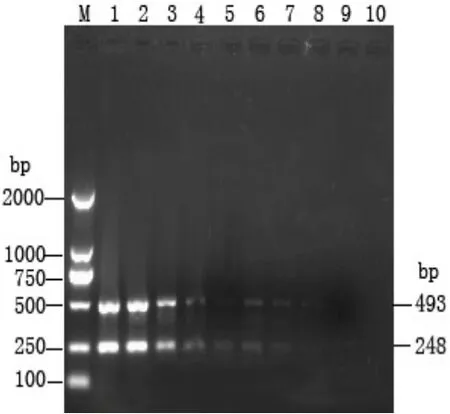
图2 鳗利斯顿氏菌菌液稀释法双重PCR检测结果M,DL2000; 1-10,双重PCR扩增片段(菌液系列稀释:依次为8×108CFU/mL~8×10-1CFU/mL)Fig. 2 Sensitivity of duplex PCR for detection of L. anguillarum dilution M, DL2000; 1-10, amplified fragments of duplex PCR (L. anguillarum serially diluted from 8×108CFU/mL-8×10-1CFU/mL)
2.4 模板DNA稀释双重PCR检测的灵敏度
细菌基因组DNA抽提试剂盒提取的DNA 2倍系列稀释后作模板,按2.1优化出的双重PCR反应条件进行检测,结果表明在40 µL反应体系中,模板 DNA 加入 2 µL(浓度 88~0.085 937 5 ng/µL),鳗利斯顿氏菌基因组DNA浓度在88 ng/µL至0.343 75 ng/µL的范围均可扩增出明亮条带,基因组DNA浓度在0.171 875 ng/µL条带较暗淡,基因组DNA浓度小于0.085 9375 ng/µL无扩增条带(图3), 表明本实验建立的双重 PCR方法对鳗利斯顿氏菌模板DNA浓度的检出灵敏度为0.171 875 ng/µL。
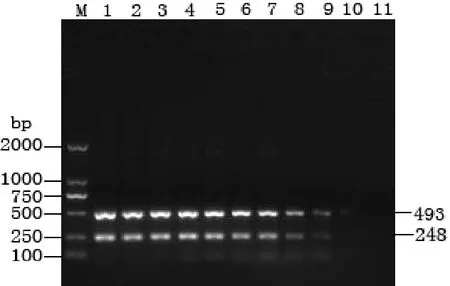
图3 鳗利斯顿氏菌模板DNA稀释法双重PCR检测结果M, DL2000; 1-11, 双重PCR扩增片段(模板DNA 2倍系列稀释:依次为88ng-0.0859375 ng)Fig. 3 Sensitivity of dulplex PCR for detection of purified chromosomal DNA dilution M, DL2000; 1-11, amplified fragments of duplex PCR (purified chromosomal DNA of L. anguillarum serially diluted 2-fold from 88 ng/µL-0.0859375 ng/µL)
2.5 发病半滑舌鳎及养殖用水的双重PCR检测结果
对发病半滑舌鳎及养殖用水进行双重 PCR检测,结果半滑舌鳎溃疡组织及肝脏均扩增出溶血素和金属蛋白酶2种基因片段,养殖用水检测结果为阴性(图 4)。发病半滑舌鳎溃疡组织及肝脏经细菌分离、形态及理化特性等表型生物学特性、16 S rRNA与gyrB基因的分子检测,表明分离自发病半滑舌鳎的优势生长菌为利斯顿氏菌属的鳗利斯顿氏菌。
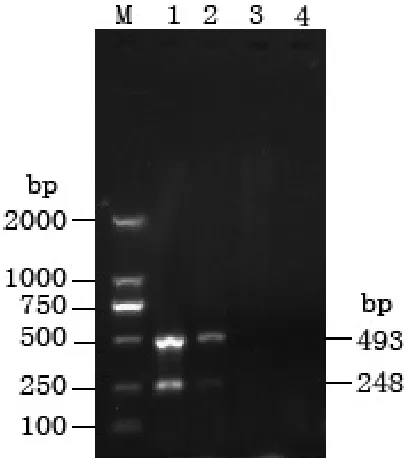
图4 发病半滑舌鳎及养殖用水的双重PCR检测结果M, DL2000; 1, 溃疡组织; 2, 肝脏; 3, 养殖用水; 4, 阴性对照Fig. 4 Results of duplex PCR for detection of L. anguillarum from diseased Cynoglossus semilaevis and tank water M, DL2000; 1, ulcer tissue; 2, liver; 3, tank water; 4, control
3 讨 论
鳗利斯顿氏菌是可引起多种海水鱼类发生出血性败血症的病原菌。2008-2009年间,江苏连云港市赣榆县工厂化养殖半滑舌鳎发生严重疾病,死亡率达到80%。病鱼主要症状为胃肠道出血,头部、鳃盖及鳍基出血,腹腔积有大量腹水,尾鳍腐烂,个别病鱼肠道有白浊物等,经细菌学及致病性检验表明病原为鳗利斯顿氏菌,且对半滑舌鳎具有强致病性。因此,建立该病原菌快速、简便、准确的检测方法以便对其引起的疾病进行有效的防治是十分必要的。
目前,应用于鳗利斯顿氏菌检测的技术主要有:荧光抗体技术(fluorescent antibody technique,FAT)、酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA 法)、核酸杂交技术(Nucleic acid hybridization)、PCR 技术(Polymerase Chain Reaction,PCR)等,这些生物学技术已在鳗利斯顿氏菌检测方面多有应用[13-17]。本文建立的鳗利斯顿氏菌的双重PCR的特异性试验结果表明,基于溶血素和金属蛋白酶基因序列设计的2对特异性引物仅对所研究的鳗利斯顿氏菌可扩增出大小分别为493 bp和248 bp的2个基因片断,对供试的5种水产动物其他病原细菌(副溶血弧菌、哈氏弧菌、美人鱼弧菌、鱼肠道弧菌及爱德华氏菌)均无交叉反应,说明设计的引物对病原鳗利斯顿氏菌具有良好的特异性;双重PCR检测灵敏度结果显示,该双重 PCR对病原鳗利斯顿氏菌的菌体浓度检出灵敏度为 8×102CFU/mL,对鳗利斯顿氏菌模板 DNA浓度的检出灵敏度为0.171 875 ng/µL,其灵敏度能满足临床病原鳗利斯顿氏菌株检测的需要。该方法可用于在水产养殖动物处于带菌状态或大规模暴发鳗利斯顿氏菌病之前进行准确的检测。
[1] Tang X Q, Zhou L, Zhan W B. Isolation and Characterization of Pathogenic Listonella anguillarum of Diseased Half-Smooth Tongue Sole (Cynoglossus semilaevis Güenther) [J]. Journal of Ocean University of China, 2008, 7:343-351.
[2] 张晓君, 秦国民, 阎斌伦, 等. 半滑舌鳎病原鳗利斯顿氏菌表型及分子特征研究 [J]. 海洋学报, 2009, 31(5):1-11.
[3] Inamura H, Nakai T, Muroga K. An extracellular protease produced by Vibrio anguillarum [J]. Bulletin Japanese Society of Science Fisheries, 1985, 51(12):1915-1920.
[4] Milton D L, Norqvist A, Wolf-Watz H. Cloning of a metalloproteas gene involved in the virulence mechanism of Vibrio anguillarum[J].Journal of Bacteriology, 1992, 174(22):7235-7244.
[5] 陈师勇, 莫照兰, 张振冬, 等. 鳗弧菌胞外产物中致病因子的分离纯化及性质研究 [J]. 高技术通讯, 2002,12(8):96.
[6] Toranzo A E, Barja J L, Potter S A, et al. Hemagglutinating,haemolytic and cytotoxic activities of Vibrio anguillarum and related vibriosis isolated from striped bass on the Atlantic Coast [J].FEMS Microbiology Letters, 1983, 18:257-262.
[7] 张晓君, 陈翠珍, 阎斌伦, 等. 凡纳滨对虾病原副溶血弧菌的表型及分子特征 [J]. 海洋与湖沼, 2009, 40(5): 654-661.
[8] 张晓君, 秦国民, 陈翠珍, 等. 龙胆石斑鱼源美人鱼发光杆菌的生物学特性与系统发育学分析 [J]. 渔业科学进展, 2009, 30(3):38-43.
[9] 张晓君, 房海, 陈翠珍, 等. 致病性哈氏弧菌生物学及分子特征[J]. 中国兽医学报, 2009, 29(9): 1120-1124.
[10] 张晓君, 陈翠珍, 阎斌伦, 等. 红鳍东方鲀病原鱼肠道弧菌的生物学特性研究 [J]. 水生生物学报, 2009, 33(6): 164-171.
[11] 陈翠珍, 房海, 张晓君, 等. 牙鲆与大菱鲆病原迟钝爱德华氏菌生物学特性及系统发育分析 [J]. 高技术通讯, 2005, 15(10):82-88.
[12] 陈吉祥, 李彩风, 颜显辉, 等. 大菱鲆病原鳗弧菌生物学及分子特征研究 [J]. 高技术通讯, 2005, 15(6): 92-96.
[13] 鄢庆枇, 苏永全. 鳗弧菌的间接荧光抗体快速检测 [J]. 海洋科学, 2004, 26(7): 371-375.
[14] 余俊红, 陈吉祥. 聚合酶链反应(PCR)检测花鲈鳗弧菌感染 [J].黄渤海海洋, 2002, 20(2): 60-64.
[15] Martínez-Picado J, Blanch A R, Jofre J. Rapid detection and identification of Vibrio anguillarum by using a specific oligonucleotide probe complementary to 16S rRNA [J]. Applied and Environmental Microbiology, 1994, 60(2):732-737.
[16] Rehnstam A S, Norqvist A, Wolf-Watz H, et al. Identification of Vibrio anguillarum in fish by using partial 16S rRNA sequences and a specific 16S rRNA oligonucleotide probe [J]. Applied and Environmental Microbiology, 1989, 55(8):1907-1910.
[17] 邹玉霞, 莫照兰, 高光, 等. 间接 ELISA技术在病原性鳗弧菌SMP1快速检测中的应用 [J]. 海洋科学, 2007, 31(6): 75-78.
Detection of pathogenic Listonella anguillarum isolated from Cynoglossus semilaevis by duplex PCR
ZHANG Xiao-jun, YAN Bin-lun, LIANG Li-guo, QIN Guo-min, BI Ke-ran
(Key Laboratory of Oceanic Biotechnology of Jiangsu, College of Ocean, Huaihai Institute of Technology, Lian Yungang 222005, China)
L. anguillarum is the cause of the high mortalities of cultured half-smooth tongue sole (Cynoglossus semilaevis) during cultivation in Lian Yungang, Jiangsu province. In this study, the detection of the pathogenic L.anguillarum by duplex PCR based on hemolysin and metalloprotease genes were conducted. Two pairs of specific primers were designed based on hemolysin and metalloprotease gene sequence, and these two primers could simultaneously amplify 493 bp and 248 bp gene fragments from chromosomal DNA of L. anguillarum in one PCR reaction, and no cross reaction was detected in 5 other pathogenic bacteria tested. The results of sensitivity of dulplex PCR showed that the two primers could detect L. anguillarum as low as 8×102CFU/mL, and detect purified chromosomal DNA as low as 0.171 875 ng/µL. Dominant L. anguillarum could be isolated from the positive sample of duplex PCR through detecting ulcer tissues and liver of diseased Cynoglossus semilaevis. The specific PCR method for detection of L. anguillarum was established, and the PCR protocol simultaneously amplifying different gene fragments of the L. anguillarum could be useful in the specific, accurate and rapid detection of pathogenic L. anguillarum.
Cynoglossus semilaevis; Listonella anguillarum; hemolysin gene; metalloprotease gene; duplex PCR
S917.1
A
1001-6932(2011)04-0430-05
2010-04-12;
2010-10-28
江苏省水产三项工程项目(PJ2010-58);江苏省自然科学基金项目(BK2009163)。
张晓君(1969-),河北秦皇岛市人,教授,博士,主要从事水产动物病害及病原微生物学研究。电子邮箱:zxj9307@163.com。
