石斛共生真菌木霉菌拮抗作用的初步研究
2011-12-23朱江敏赵英梅李玉婷张克铭陈加伟吴剑丙王慧中
朱江敏,赵英梅,白 坚,李玉婷,张克铭,陈加伟,吴剑丙,王慧中
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
石斛共生真菌木霉菌拮抗作用的初步研究
朱江敏,赵英梅,白 坚,李玉婷,张克铭,陈加伟,吴剑丙,王慧中*
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
为探讨拮抗真菌及其次生代谢产物对石斛病原菌生长的影响,从药用植物石斛中分离、鉴定和筛选出对常见病原真菌镰刀菌(Fusarium)有拮抗作用的木霉菌(Trichoderma).通过平板对峙培养,观察其对镰刀菌生长的影响;通过几丁质水解圈实验,检测木霉几丁质酶的活力.该研究所筛选获得的木霉生防菌株,可应用于石斛的栽培管理,提高石斛抗病能力.
石斛内生菌;拮抗作用;生物防治
0 引 言
石斛是典型的菌根植物,在长期的接触过程中,周围环境中的真菌与石斛根共同生存进化[1].很多研究者已从多种石斛根中分离获得各类有益、中性或有害的内生真菌.其中有些内生真菌不引起明显病症,有些真菌能促进石斛生长和发育,还有一些真菌不仅具有促生作用还能抑制有害真菌的生长,表现出强烈的拮抗效果[2].木霉菌(Trichodermaspp.)是一类开发比较成熟的生防菌,对许多常见的植物病原菌具有拮抗作用[3].研究发现,木霉菌分泌产生的几丁质酶是其抗菌作用的有效成分.不同的木霉菌株分泌产生不同的几丁质酶,有的只能够水解病原真菌细胞壁的组成成分——几丁质,而并不使细胞质外流;有的同时具有水解几丁质和拮抗病原真菌的活性,几丁质酶破坏细胞壁使细胞质泄露,产生的细胞碎片诱导刺激宿主植物抗逆性.此外,拮抗真菌几丁质酶活性的增强伴随着纤维素酶、β-1,3-葡聚糖酶及其他抗病蛋白的形成,有效抑制病原真菌的孢子萌发和菌丝生长[4-5].
石斛菌根中存在着包括木霉菌在内的许多有益拮抗真菌,这些真菌在石斛抗病中发挥重要作用.对于真菌病害的防治,采用传统的化学方法会带来很多后续问题.生物防治技术是一种有效的绿色的防治方法,其原理是利用生物的竞争关系,调节有害生物种群密度.因此,利用微生物或其代谢产物(抗生物质等)可对植物病原菌(包括土壤中的病原菌)进行有效防治[6].生物防治技术具有不污染环境、对人和其他生物安全、防治作用持久、产品无残留,即易于同其他植物保护措施协调配合并能节约能源等优点,必将在有害生物综合防治中发挥越来越重要的作用.
该研究对课题组从野生石斛组织中分离的真菌进行拮抗性分析,从中获得一株拮抗真菌,经分子鉴定,该菌属于木霉属.同时,通过对峙平板培养验证该菌能拮抗病原真菌镰刀菌(Fusarium),并利用几丁质酶透明圈实验分析检测菌株胞外酶几丁质酶的活性.
1 材料与方法
1.1 材料与试剂
1.1.1 供试材料
真菌材料:实验所用真菌为本实验室从各地采集的野生石斛植物中分离获得,并长期保存.
1.1.2 培养基及生化试剂
培养基:
①PDA培养基:马铃薯200g,葡萄糖20g,琼脂4~5g.
② 胶体几丁质PDA:PDA培养基中加入2%胶体几丁质[7].
③ DNS试剂(g/L):酒石酸钾钠91g,DNS 3.15g,NaOH 20g,苯酚2.5g,无水亚硫酸钠2.5g.
④ 产酶发酵培养基(g/L):NH4NO33g,KH2PO42g,MgSO4·7H2O 0.6g,FeSO4·7H2O 0.1g,胶体几丁质5g,pH5~6.
1.2 方法与步骤
1.2.1 F35菌株的鉴定
1.2.1.1 菌株DNA的提取与电泳检测
从平板上刮取约100mg菌丝体移入1.5mL离心管中,加入600μL菌丝裂解缓冲液,用研钵充分研磨后,定容至1mL,于65℃水浴中保温30min,期间充分混匀3次;加入等体积的苯酚/氯仿/异戊醇(V(苯酚)∶V(氯仿)∶V(异戊醇)=24∶24∶1),轻摇混匀5min,12 000r/min离心10min;吸取上清液,加入等体积氯仿进一步抽提;离心后收集上清液,加入2μL RNase(10mg/mL),37℃水浴保温30min;再次加入等体积氯仿抽提;吸取上清液,用2倍体积的100%乙醇沉淀析出DNA,并用70%乙醇洗涤沉淀2次,用适量TE溶解DNA,贮存于-20℃备用.
DNA电泳检测.取3μL DNA样品,1%琼脂糖凝胶电泳(100V,25min),以Trans 2KDNA Marker作为分子标记,EB染色后,紫外灯下观察拍照.
1.2.1.2 菌株rDNA ITS序列的获得、纯化及测序
石斛属菌根内生真菌rDNA ITS区段PCR扩增引物[8-9]:

PCR体系为(25μL)∶2.5μL 10×Buffer(含 Mg2+)、2.0μL模板 DNA、1.5μL dNTP(2.5mM)、1.5μL P1(10μM)、1.5μL P2(10μM)、0.2μL Taq酶(2U/μL)、16.8μL灭菌ddH2O.混匀后,稍离心,放入PCR仪进行下列程序:96℃预变性2min;94℃变性45s;55℃退火45s;72℃延伸50s;进行35个反应循环;72℃延伸5min.取5μL的PCR产物电泳检测.
PCR扩增产物采用DNA片段快速纯化/回收试剂盒回收(Axygen公司).真菌ITS序列区段的克隆,按照pMD18-T Vector试剂盒(TAKARA公司)使用说明进行操作.选取阳性克隆由上海华大基因公司测序.
1.2.1.3 ITS序列Blast比对及比较分析
菌根内生真菌rDNA ITS1和ITS2序列的起止范围通过Blast比对,并参照GenBank中已有石斛菌根真菌的ITS范围确定.用DNAStar软件对所获ITS序列进行系统分析,用最适全局排序选项对分离到的菌株F35进行同源性比对从而确定菌株种属.
1.2.2 对峙平板拮抗实验
将菌株F35和镰刀菌株分别接种到PDA平板(直径90mm)上,平板中心对称两点接种,两菌株距离约4 cm.在恒温恒湿培养箱中培养(25℃、60%湿度),3d后开始观察菌落生长情况.以单独接种病原真菌的平板作为对照,每处理重复3次.拮抗系数分为5级:Ⅰ级,木霉菌丝占据平板的100%;Ⅱ级,木霉菌丝占据平板>2/3;Ⅲ级,木霉菌丝占据平板<2/3,>1/3;Ⅳ级,木霉菌丝占据平板<1/3;Ⅴ级,病原菌占据平板100%[10].
1.2.3 木霉菌几丁质酶透明圈实验
1.2.3.1 木霉发酵液的制备
将木霉菌株F35接种到PDA培养基平板(直径9cm)上暗培养5d.同时配制木霉产酶发酵培养基,每瓶100mL分装于250mL三角瓶中,灭菌后备用.灭菌水浸泡木霉平板3~5min,用棉签轻轻刮洗孢子及菌丝体,并4层纱布过滤除去菌丝体,滤液即为孢子悬浮液[7].用血球记数板对孢子进行计数,每瓶接种孢子按1.0×106个,置于恒温摇床培养5~6d(180r/min,25℃).将发酵液经4层纱布过滤,10 000r/min离心30min,取上清液备用.
1.2.3.2 胶体几丁质PDA平板透明圈实验
制备胶体几丁质PDA,灭菌后倒板备用.在平板中央用直径5mm的打孔器打孔,用灭菌枪头分别吸取40μL灭菌的发酵上清液(用孔径为0.22μm细菌滤器过滤灭菌)、标准几丁质酶液和无菌培养液加到孔中,用密封胶带封口,于恒温箱28℃保温,5h后开始观察透明圈的情况.每个处理重复3次.
2 结果与分析
2.1 菌株F35鉴定结果
F35纯培养物,如图1A平板所示,菌丝呈白色薄绒状,生长迅速,后期产生黑绿色孢子团.提取菌株DNA,经过电泳检测(如图1B)大小在20kb左右.引物P1和P2对F35总DNA进行扩增,获得产物大小介于500~700bp之间(如图1C).
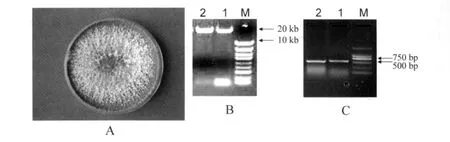
图1 菌株F35鉴定结果Fig.1 The identity results of strains F35
将扩增获得的ITS片段连接到pMD18-T载体上,PCR筛选阳性克隆,经测序后分析获得的PCR产物为606bp.将该序列在GenBank中进行同源比对,发现其与木霉属(Trichoderma persoon)真菌(Gen-Bank中登录号为DQ379015)同源性最高,达99.0%(见表1).
2.2 平板对峙培养结果
将F35与病原真菌镰刀菌进行平板对峙培养,结果表明,两菌之间有明显的抑菌区,木霉菌所产生的拮抗物质限制了镰刀菌的进一步生长,使抑菌区周围的镰刀菌菌丝十分整齐(图2B).而对照组镰刀菌的生长未受到任何的限制(图2A).同时,由于F35菌丝占据平板面积超过2/3,因此,判定F35对镰刀菌的拮抗系数为Ⅱ级.
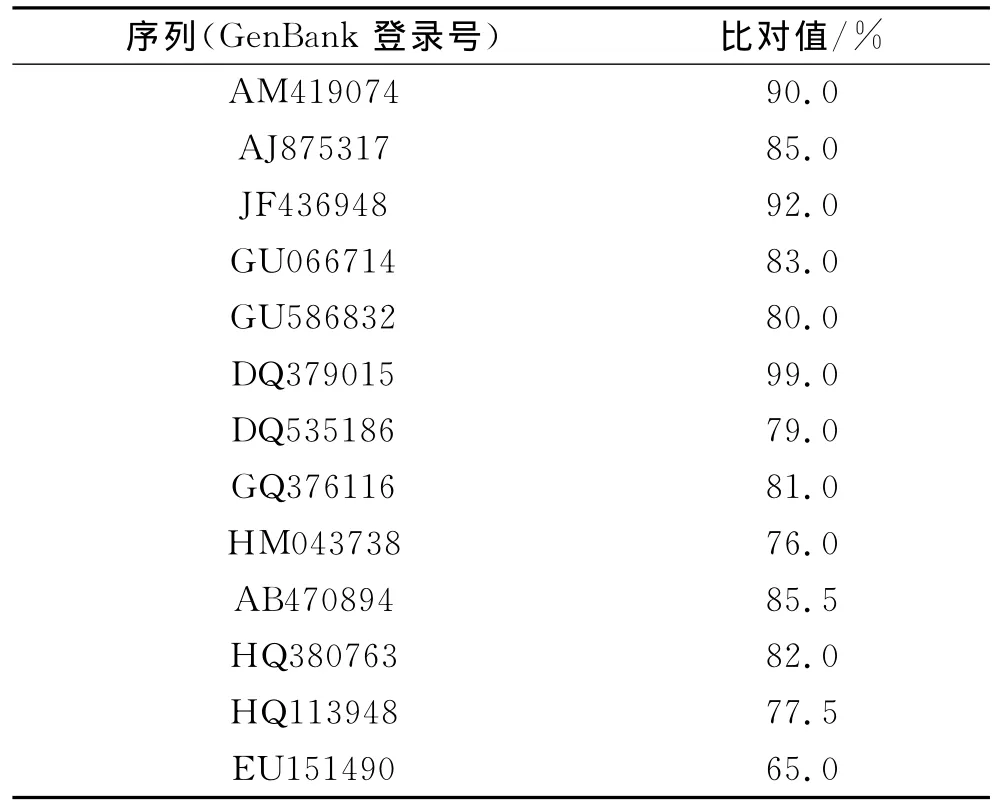
表1 基于真菌ITS序列的同源性比对Tab.1 Percentage nucleotide sequence identities between F35 and other fungi based on multiple alignments of ITS sequences

图2 平板对峙培养Fig.2 Cultivate of plate confrontation
2.3 木霉菌几丁质酶透明圈实验
利用胶体几丁质PDA平板测定F35分泌的几丁质酶活性.将含有F35几丁质酶粗提液的平板在28℃保温条件下培养,5h后可隐约观察到透明圈,7h后透明圈清晰可见.随着保温时间延长,透明圈不断增大,经过48h后透明圈直径达2cm左右(见表2).透明圈的出现进一步说明木霉菌株F35在诱导条件下发酵产生高活性的几丁质酶,能有效地催化分解细胞壁组成成分几丁质.
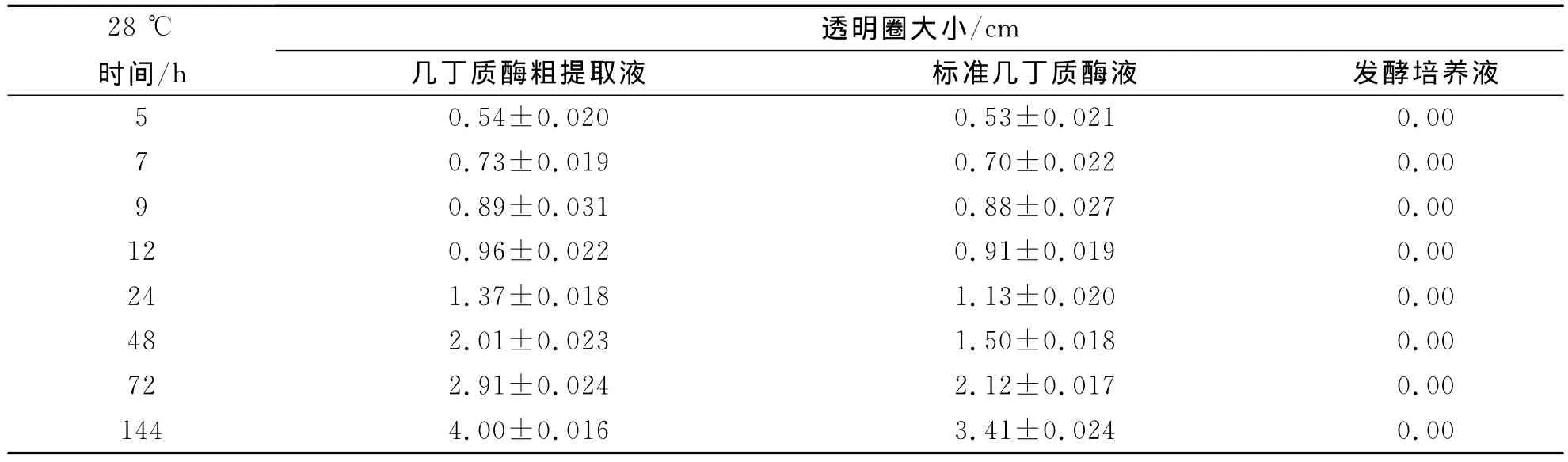
表2 几丁质酶透明圈的大小变化Tab.2 The size of chitinase transparent circle
3 讨 论
内生真菌广泛存在于植物组织内部,有助于提高植物抗病抗逆能力,一方面可能是由于拮抗真菌激发了植物的某种抗逆机制,引发相应的信号传导过程,另一方面可能是由于真菌间的拮抗作用,导致病原菌生长受到抑制.目前,有关石斛内生真菌的研究越来越受人们的重视,已发现野生石斛中存在大量内生真菌,其中某些真菌在植株生长和发育过程中起重要作用[11-12].
该研究对实验室分离保存的石斛内生真菌进行分子鉴定,通过ITS序列测定及同源性比对,发现F35为木霉菌.由于根据ITS序列分析,只能鉴定到属,因此,本实验室将在后期通过分子、形态等手段对该菌进行进一步的鉴定.随后该研究利用平板对峙培养,发现F35对常见病原真菌镰刀菌有拮抗作用,其拮抗系数为II级.酶活性测定表明F35能分泌有活性的几丁质酶,分解真菌细胞壁的主要成分几丁质,这可能是F35能拮抗病原菌的真正原因.此外,木霉菌的次生代谢产物中还可能含有其他的拮抗物质,需要对其代谢产物进行系统分析.同时,本实验室将进一步测定F35及其它石斛内生真菌对其他的病原菌的拮抗作用,为拮抗作用机理研究及生防菌的实际生产应用提供实验素材及理论依据.
[1]Dearnaley J D W.Further advances in orchid mycorrhizal research[J].Mycorrhiza,2007,17(6):475-486.
[2]Liu Hongxia,Luo Yibo,Liu Hong.Studies of mycorrhizal fungi of Chinese orchids and their role in orchid conservation in China:a review[J].Bot Rev,2010,76:241-262.
[3]Catalano V,Vergara M,Hauzenberger J R,etal.Use of a non-homologous end-joining-deficient strain(delta-ku70)of the biocontrol fungusTrichodermavirensto investigate the function of the laccase gene lcc1in sclerotia degradation[J].Curr Genet,2011,57(1):13-23.
[4]Liu Luning,Zhang Jingze,Xu Tong.Histopathological studies of sclerotia ofRhizoctoniasolaniparasitized by the EGFP transformant ofTrichodermavirens[J].Lett Appl Microbiol,2009,49(6):745-750.
[5]Abdel-Fattah G M,Shabana Y M,Ismail A E,etal.Trichodermaharzianum:a biocontrol agent against Bipolaris oryzae[J].Mycopathologia,2007,164(2):81-89.
[6]Ma Ruiyan,Wang Ren,Ding Jianqing.Classical biological control of exotic weeds[J].Acta Ecologica Sinica,2003,23(12):2677-2688.
[7]陈三凤,李季伦,裘维蕃.关于抑制植物病原真菌几丁质酶来源及效应的研究强作用黄杆菌的分离和鉴定[J].植物病理学报,1992,22(4):323-327.
[8]Li Lubin,Hu Tao,Tang Zheng,etal.rDNA ITS analysis of mycorrhizal fungi inCymbidiumplants[J].Scientia Silvae Sinicae,2008,44(2):160-164.
[9]庄彩云.适用于rDNA ITS分析的兰属菌根真菌培养及DNA提取方法[J].北京农学院学报,2007,22(3):4-7.
[10]宋漳,陈辉.绿色木霉对土传病原真菌的体外拮抗作用[J].福建林学院学报,2002,22(3):219-222.
[11]Mckendrick S L,Leake J R,Taylor D L.Symbiotic germination and development of the mycoheterotrophic orchid Neottia nidusavis in nature and its requirement for locally distributedSebacinaspp[J].New Phytologist,2002,154(1):233-247.
[12]McCormick M K,Whigham D F.Mycorrhizal diversity in photosynthetic terrestrial orchids[J].New Phytologist,2004,163(2):425-438.
Preliminary Studies on the Antagonism ofDenbrobiumMycorrhizal Fungi(TrichodermaPersoon)
ZHU Jiang-min,ZHAO Ying-mei,BAI Jian,LI Yu-ting,ZHANG Ke-ming,CHEN Jia-wei,WU Jian-bing,WANG Hui-zhong
(College of Life and Environment Science,Hangzhou Normal University,Hangzhou 310036,China)
To investigate the effect of antagonistic fungi and second metabolism products onDendrobiumpathogens,the experiment screened and identifiedTrichoderma,which was antagonistic toFusarium,from medicinal plantDendrobiumtissues.The effect of F35was determined by co-culture on PDA plates.The quantities of chitinase activity were detected through the chitin hydrolysis circle experiment.Trichodermaobtained in this study can be used inDendrobiumcultivation and management,which will improve the disease resistant ability ofDendrobium.
Dendrobiumendophytes;antagonism;biological control
Q939.5
A
1674-232X(2011)04-0340-05
2011-03-31
国家自然科学基金项目(30870180,31070298);浙江省重大科技专门项目(2008C12081);杭州市科技计划项目(20080432T06,20101032B25).
朱江敏(1985—),女,浙江杭州人,遗传学专业硕士研究生,主要从事植物菌根互作研究.
*通信作者:王慧中(1962—),男,浙江义乌人,教授,博士,主要从事植物系统生物学研究.E-mail:whz62@163.com
10.3969/j.issn.1674-232X.2011.04.011
