合欢皂甙Julibroside J8对人微血管内皮细胞凋亡的影响研究
2011-12-22张小平张莲芬
花 慧,冯 磊,张小平,张莲芬,金 坚*
1江南大学医药学院分子药理研究室;2江南大学工业生物技术教育部重点实验室,无锡214122;3无锡卫生高等职业技术学校,无锡214028
合欢皮为较常用中药,中国药典(一部)2000年版规定,合欢皮为合欢的干燥茎皮,具有解郁安神、活血消肿的作用、用于心神不安、忧郁失眠、肺痈疮肿、跌扑伤痛等症[1]。研究表明,合欢皮中化学成分较多,陈四平[2]等利用HPLC制备技术,从合欢皮乙醇提取物的正丁醇萃取部位分离得到一系列结构复杂的三萜苷类化合物。Julibroside J8是从合欢皮分离得到一种含九个糖三萜皂甙,郑路[3]等人研究表明其体外具有抑BGC-823、Bel-7402、HeLa、PC-3MIE8、MDA-MB-435和HL-60细胞的活性,具有经caspase家族及Bcl家族共同调控诱导Hela细胞凋亡的作用,但它是否具有抑制人微血管内皮细胞的作用尚不清楚。本研究旨在探讨Julibroside J8对人微血管内皮细胞的生长抑制作用及其可能的机制。
1 材料
SV40病毒转染的人微血管内皮细胞(HMEC-1)传代株由法国国家卫生医学研究院U553研究所(INSERM U553)陆核教授馈赠;SRB(Sigma公司); MCDB-131细胞培养基(Gibco BRL公司);胰酶、小牛血清、L-谷氨酰胺(华美生物工程公司);DAPI染液、TUNEL试剂盒(凯基生物公司);Annexin-V/PI双标记试剂盒(BD PharMin-gen公司)。
合欢皮购自江苏省无锡市山禾药业股份有限公司,由南京中医药大学陈建伟教授鉴定为 Albizia julibrissin Durazz.的干燥树皮。
2 方法
2.1 细胞培养
将HMEC-1用含1 mmol/L谷氨酰胺、1 mg/L氢化可的松、10 μg/L EGF和150 mL/L小牛血清的MCDB-131培养液,于37℃,50 mL/L CO2培养箱中传代培养。
2.2 合欢皂甙Julibroside J8的制备
将1 kg合欢皮分别用8 L、7 L 75%乙醇,100℃回流提取两次,每次2 h,过滤,去渣。合并滤液,减压回收乙醇,得浸膏120g,将所得浸膏经D101型大孔树脂吸附,再用水,30%乙醇,50%乙醇70%乙醇,90%乙醇各洗脱3个柱体积,收集各相,将70%乙醇相得浸膏,用100~200目的硅胶常压分离,用体积比氯仿∶甲醇∶水为9∶1∶0.1~6.5∶3.5∶1梯度洗脱,等体积(300 mL)收集,将第33~44瓶合并,回收溶剂得浸膏,用反相色谱(色谱柱Sunfire C18,5 μL,100A,19×150 mmID;流动相∶甲醇-水70∶30,流速:5 mL/min,紫外检测波长:215 nm)中压分离,按色谱单峰收集,回收溶剂,冷冻干燥得有效组分A1,经HPLC分析纯度为95.5%,将组分A1的UV、MS、IR、1H NMR、13C NMR图谱的数据与文献[4]逐一比对。确定其为化合物合欢皂甙Julibroside J8结构见图1。将Julibroside J8溶解于细胞培养基中过滤灭菌备用。
2.3 细胞增殖抑制实验(SRB法)
取对数生长期细胞,按每孔7000-8000个细胞接种于96孔板中放置于37℃、50 mL/L CO2的培养箱中培养过夜,加入不同浓度的合欢皂甙Julibroside J8(0.5、1.0、1.5、2.0、4.0 μg/mL)每个浓度设药物作用时间6、12、24、48 h。且同时设相应不加药组为阴性对照组。在撤去药物后继续培养至72 h去上清液,每孔轻轻加入100 g/L三氯醋酸100 μL固定,静置5 min后移到4℃再放置1 h倒掉固定液,用去离子水洗5遍,空气干燥。每孔加入4 g/L SRB 100 μL室温放置30 min,用10 mL/L醋酸液洗5遍,加入150 μL 10 mmol/L Tris碱液(pH 10.5)溶解,用MK3型酶标仪在波长A570处测定每孔A值。计算抑制率(%)同时绘制药物浓度抑制率曲线,抑制率=[(对照组的A值–药物组的A值)/(对照组的A值-空白组的A值)]×100%
2.4 DAPI染色观察细胞核变化
取对数生长期的HMEC-1细胞,接种到培养皿中(预先放置盖玻片)培养24 h,细胞在盖玻片上生长贴壁后,加入 Julibroside J8,使其终浓度为1.5 μg/mL,空白对照不加Julibroside J8,继续培养24 h,小心取出盖玻片,加500 μL的DAPI染液洗一次;再滴加入500 μL的DAPI工作液,37℃染色15 min;弃去染色液,甲醇漂洗一次,滴加甘油。荧光显微镜以340/380 nm紫外光激发,以100×油镜头观察、拍照。
2.5 TUNEL染色法
取对数生长期的HMEC-1细胞,接种到培养皿中(预先放置盖玻片)培养24 h,细胞在盖玻片上生长贴壁后,加入不同浓度的合欢皂甙Julibroside J8(0.5、1.5、2.5 μg/mL)作用时间48 h。且同时设相应不加药组为阴性对照组。以下操作严格按照说明书进行。
2.6 采用Annexin-Ⅴ/PI双标记行流式细胞仪测定细胞凋亡率
取对数生长期的HMEC-1细胞,接种于细胞培养瓶中,细胞浓度为5×105个/瓶,24 h后加Julibroside J8,使其终浓度为0.5~2.5 μg/mL,同时不加Julibroside J8为空白对照,继续培养24 h后,据Annexin-V/PI双标记试剂盒说明操作。流式细胞仪分析,每样本收集10 000个细胞荧光信号,检测结果采用Cellquest软件分析。
2.7 统计分析
采用SPSS 1310软件进行分析,组间比较采用方差分析。

图1 Julibroside J8的化学结构图和对HMEC-1细胞的作用Fig.1 Chemical structure and effect of Julibroside J8on HMEC-1 cells
3 结果
3.1 Julibroside J8对HMEC-1增殖的影响
在不同浓度Julibroside J8作用下,Julibroside J8对内皮细胞HEMC-1均有不同的抑制作用。Julibroside J8呈剂量依赖性抑制HEMC-1细胞的增殖,抑制作用随着Julibroside J8的浓度以及作用时间的增加而增强。在作用浓度1 μg/mL,作用时间6 h时,抑制率达到35%。统计学分析差异显著(P<0.01)。
3.2 Julibroside J8对HMEC-1细胞核形态的影响
HMEC-1细胞爬片后,经DAPI染色后荧光显微镜拍照结果如图2。HMEC-1空白对照细胞较弱的蓝色荧光,核形态呈椭圆形,边缘清晰,染色均匀,细胞经样品作用后,产生很强蓝光染色。并且细胞的细胞核边缘不规则,细胞核染色体浓集,着色较重,并伴有细胞核固缩,核小体碎片增加这是细胞凋亡的明显特征。
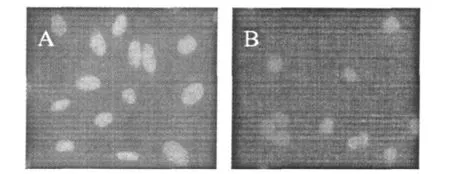
图2 DAPI染色观察HMEC-1细胞形态的变化Fig.2 The morphological changes of HMEC-1 cells by DAPI dying with microscopy
3.3 TUNEL检测细胞在凋亡过程中细胞核DNA的断裂
HMEC-1细胞爬片后,经TUNEL染色后光学显微镜拍照如图3。由图中可以看到,HMEC-1空白对照细胞核呈较弱的蓝色,核形态呈椭圆形,边缘清晰,染色均匀,细胞经样品作用后,细胞核呈深棕色。表明细胞经药物作用后产生了凋亡。且随着剂量的增加细胞核呈深棕色的细胞比例也在增加,呈现出剂量依赖关系。
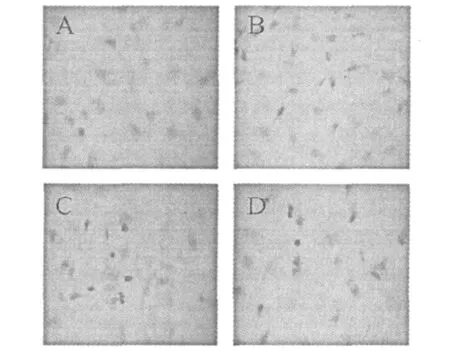
图3 TUNEL染色观察HMEC-1细胞核中DNA断裂Fig.3 Effect of Julibroside J8on DNA fragmentation in HMEC-1 cells
3.4 检测细胞坏死与凋亡:Annexin V/PI双染色流式细胞术检测
HMEC-1细胞经不同浓度的样品作用24 h后,分别经胰酶消化,收集5×105~106个细胞,根据试剂盒说明书进行Annexin V/PI双染色,立即用流式细胞仪检测,结果如图4。在不同的浓度Julibroside J8作用下,随加样浓度的增大,处于右下象限的细胞即凋亡细胞明显增多,当Julibroside J8的浓度依次为 0.5、1.5、2.5 μg/mL时,凋亡率分别达到13.63% ±3.10%,19.55% ±4.69%,32.32% ± 6.19%,而正常对照组细胞凋亡率为 8.34% ± 2.90%。二者统计学分析差异显著(P<0.05)。
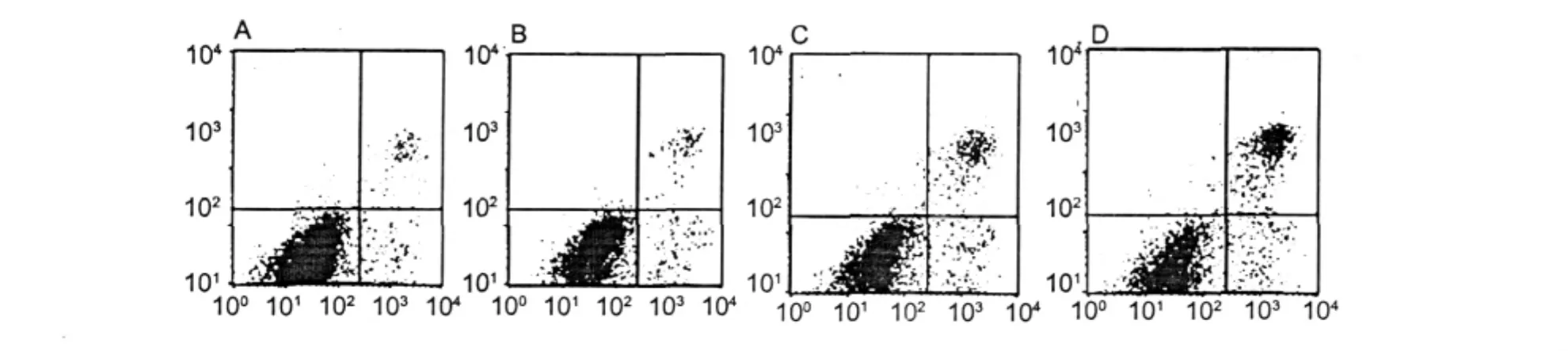
图4 AnnexinⅤ/PI双染色法流式细胞术检测HMEC-1细胞的坏死与凋亡Fig.4 Representative flow cytometry analysis of cell necrosis and cell apoptosis induction in HMEC-1 cell incubated 24 h with Julibroside J8
4 讨论
1971年,Folkman提出肿瘤生长是血管生成依赖性的新观点,并提出了“抗血管生成治疗”的概念[5]。血管生成(angiogenesis)是指毛细血管从已存在的血管周围生成的过程,包括血管内皮细胞的激活、细胞外基质的降解、内皮细胞的增殖与移行、形成新的血管和血管网,因此以血管内皮细胞为药物作用靶点从中草药中寻找发现新的血管生成抑制剂正日益成为目前研究肿瘤转移的热点。
根据以上理念,我们首先通过体内,体外模型确定了中药合欢皮的提取物的抑制血管生成的作用[6],继而以血管内皮细胞为模型,综合运用多种分离手段从合欢皮中筛选分析得到Julibroside J8。体外细胞抑制实验结果显示内皮细胞经不同浓度Julibroside J8,作用6 h后生长就受到抑制,表明Julibroside J8对内皮细胞的抑制作用不是因为改变细胞的生长环境而产生的,而是对细胞本身发生了作用。为了探明Julibroside J8抑制内皮细胞增殖的原因我们采用以下三个实验进行了分析研究。
DAPI染色法:DAPI(4,6-Diamidino-2-phenylindole,4,6-二氨基-2-苯基吲哚)是一种DNA特异性染料,与DNA产生非嵌入式结合,发出蓝色荧光。该染料对细胞膜有半通透性,可透过正常活细胞产生较弱的蓝色荧光(细胞固定后荧光增强),而凋亡细胞的膜通透性增加,对其摄取能力增强,产生很强蓝光染色。并且正常细胞的核形态呈圆形,边缘清晰,染色均匀,而凋亡细胞的细胞核边缘不规则,细胞核染色体浓集,着色较重,并伴有细胞核固缩,核小体碎片增加,因此从荧光强度及核形态均可鉴别出细胞发生凋亡的典型特征。TUNEL染色法则利用脱氧核糖核苷酸末端转移酶(TdT)的作用标记荧光素于凋亡细胞中断裂DNA的3’末端,从而准确地反映DNA片段的生化特点与典型的形态学特点,进行凋亡细胞的识别[7]。Annex-inV/PI双染法应用流式细胞仪测定是检测细胞凋亡的常用方法,具有量化凋亡变化的能力[8]。
通过上述3项指标检测,结果证实Julibroside J8可以通过诱导内皮细胞凋亡的途径达到抑制内皮细胞增殖的作用。这与文献[3]报道的Julibroside J8可以诱导HeLa凋亡的报道相一致。但其诱导内皮细胞凋亡的机理尚待实验进一步证明。
1 Pharmacopoeia Committee of China(国家药典委员会),Chinese Pharmacopoeia(中华人民共和国药典),Part A,Chemistry and Industry Publishing House(化学工业出版社),Beijing,2000,p.111.
2 Chen SP,Zhang RY,Ma LB,et al.Structure determination of three saponons from the stem bark of Albizzia julibrissin Durazz.Acta Pharm Sin,1997,32:110-115.
3 Zheng L,Zheng J,Wu LJ,et al.Julibroside J8-induced HeLa cell apoptosis through caspase pathway.J Asian Nat Prod Res,2006,8:457-465.
4 Zou K,Tong WY,Liang H,et al.Diastereoisomeric saponins from Albizia julibrissin.Carbohydr Res,2005,340:1329-34.
5 Folkman J,Shing Y.Angiogenesis.J Biol Chem,1992,267: 10931-10934.
6 Hua H(花慧),Feng L(冯磊),Zhang XP(张小平),et al.The experimental study on the anti-angiogenenic effect of Albizia julibrissin extracts.Nat Prod Res Dev(天然产物研究与开发),2010,22(2):215-218,260
7 Otsuki Y,Li Z,Shibata MA.Apoptotic detection methods from morphology to gene.Prog Histochem Cytochem,2003,38:275-339.
8 Mccloskey TW,Oyaizu N,Coronesi M,et al.Use of a flow cytometric assay to quantitate apoptosis in humanlymphocytes.Clin Immunol Immunopathol,1994,71:14-18.
