节球藻和柱胞藻毒素免疫分析的前处理方法研究
2011-12-20殷浩文
李 双, 殷浩文
(1.华东师范大学 生命科学学院,上海 200062;2.上海市检测中心,上海 201203)
节球藻和柱胞藻毒素免疫分析的前处理方法研究
李 双1, 殷浩文2
(1.华东师范大学 生命科学学院,上海 200062;2.上海市检测中心,上海 201203)
采用固相萃取前处理技术和酶联免疫吸附(Enzyme-Linked ImmunoSorbent Assays,ELISAs)检测技术,研究了水样中节球藻和柱胞藻毒素的免疫前处理方法.由于两种藻毒素极性差异较大,分别对水样中节球藻和柱胞藻毒素采用不同的前处理方法,具体如下.①节球藻毒素:先后用10 mL甲醇和10 mL纯水活化C18柱,以3~4 mL/min的速度上样后用10 mL纯水淋洗,再用12 mL甲醇洗脱节球藻毒素,氮气吹干后纯水定容至1 mL待测.②柱胞藻毒素:先后用10 mL甲醇和10 mL纯水活化碳黑固相萃取柱,以2~3 mL/min的速度上样后用10 mL甲醇淋洗,再用12 mL含0.1%三氟乙酸的甲醇洗脱柱胞藻毒素,氮气吹干后用0.1%氨水定容至1 mL待测.结果表明,这两种前处理方法对节球藻与柱胞藻毒素的ElISAs检测能保证有较好的回收率,加标回收率可分别达到99.4%和77%.
节球藻毒素; 柱胞藻毒素; ELISAs
0 引 言
自1878年George Francis报道第一起澳大利亚有毒蓝藻水华事件以来[1],全世界范围内由于加速的水体富营养化(eutrophication)现象而产生的淡水水华越来越多.有毒藻类形成的水华或赤潮越来越频繁地出现在沿海及内陆水域,欧洲、美洲、非洲、大洋洲、中东和亚洲等地区均出现过蓝藻引发的水华[2],其中有50%~75%的蓝藻水华会产生藻毒素[3],并以微囊藻、节球藻和柱胞藻藻毒素最为常见.它们主要通过饮水或食用被毒素污染的水产品等途径进入人体,进而影响人类健康[4].目前对微囊藻毒素的研究较为普遍,而同样广泛发生的节球藻和柱胞藻毒素由于技术的原因(微量、干扰严重及前处理复杂等)研究较少.节球藻毒素(Nodularins,NOD)是一种环状的五肽肝毒素,主要作用于肝脏,能抑制丝氨酸/苏氨酸蛋白磷酸酶1和2A的活性,具有强烈的促肝肿瘤的作用[5],它不仅是肿瘤促进剂,也是直接的致癌物质[6].柱胞藻毒素(Cylindrospermopsins,CYN)是近年来才发现的一种生物碱类肝毒素,主要作用于肝脏和肾脏组织,能够抑制蛋白质的合成,以共价修饰改变DNA或RNA引起基因损伤.柱胞藻毒素及其代谢物能够作用于细胞分裂过程中的纺锤体或着丝粒,导致整个染色体丢失[7].目前对于节球藻和柱胞藻毒素的分析方法几乎空白,而节球藻和柱胞藻毒素在实际饮用水中的污染问题却日渐严重,因此急需一种灵敏、快速、准确的方法对其进行检测和定量.
对于藻毒素的前处理研究主要运用于高效液相色谱法等化学检测中,免疫检测的样品都不经过前处理,水样过滤后直接进行免疫检测.由于水样的复杂背景会影响免疫检测的效果,同时考虑到免疫检测的特殊性,应用于化学检测中的前处理程序也不能直接用于免疫检测.因此,本文在综合国内外文献的基础上,采用比较研究的方法,以SPE技术和ELISAs为手段,对节球藻和柱胞藻藻毒素的富集前处理做了重点研究.在杂质淋洗和目标化合物洗脱等关键过程优化的基础上,建立了这两种藻毒素的前处理方法,以保证水体中痕量毒素检测的快速性和准确性.
1 材料与方法
1.1 仪器和材料
C18反相固相萃取柱(Waters,美国);碳黑固相萃取小柱(CNW,德国);0.22μm水相滤膜(MILLI-PORE,美国);酶标仪(BioTek,美国);超纯水系统 (Milli-Q,美国);甲醇(SIGMA,美国);甲酸、三氟乙酸(ACROS,美国);节球藻毒素/柱胞藻毒素检测试剂盒(Beacon美国).
1.2 节球藻和柱孢藻毒素的检测步骤
按照试剂盒说明书操作进行.
1.3 实验方法
藻毒素的固相萃取前处理流程为:活化柱子→上样→淋洗→洗脱→吹干定容→Elisa检测.
本次实验对该流程中节球藻毒素的淋洗,柱胞藻毒素的柱子活化及洗脱给予了重点优化,具体步骤如下.
1.3.1 节球藻毒素淋洗方式优化
100 mL纯水中加入1 mL1μg/L的NOD标样,混匀后通过预先经10 mL纯甲醇和10 mL纯水活化的C18固相萃取柱,流速3~4 mL/min,然后分别用10 mL纯水、10%甲醇和20%的甲醇淋洗,每组做3个平行加标和1个空白对照,12 mL纯甲醇洗脱,收集于底部有刻度的梨形烧瓶中,洗脱液在35℃下用氮吹仪吹干,氮吹过程中用少量纯甲醇淋洗瓶壁,吹干后用纯水定容至1 mL,并利用水相针式过滤器(0.22μm)过滤到样品瓶中,根据1.2步骤检测,对比纯水、10%甲醇和20%甲醇三者的淋洗效果.
1.3.2 节球藻毒素湖水加标实验
取0.22μm水相滤膜过滤后的淀山湖水100 mL,加入1 mL1μg/L的NOD标样,混匀,上样后用10 mL纯水淋洗,其它步骤同1.3.1.做3个平行加标和1个空白对照.
1.3.3 柱胞藻毒素固相萃取柱活化方式
碳黑固相萃取小柱的活化有两种方式:A组用10 mL纯甲醇和10 mL纯水活化,B组用10 mL甲醇和10 mL0.1%甲酸水溶液活化,两组分别做3个平行加标和1个空白对照.100 mL纯水中加入1 mL1μg/L的CYN标样混匀,然后以2~3 mL/min的速度通过活化的碳黑固相萃取柱,用12 mL含0.1%三氟乙酸的甲醇洗脱,收集于底部有刻度的梨形烧瓶中,洗脱液于35℃下用氮吹仪吹干,氮吹过程中用少量纯甲醇淋洗瓶壁,吹干后用0.1%氨水定容至1 mL,并利用水相针式过滤器(0.22μm)过滤到样品瓶中,根据1.2步骤检测得出结果,对比两种活化方式的效果.
1.3.4 柱胞藻毒素洗脱溶剂优化
选择10 mL纯甲醇和10 mL纯水活化碳黑固相萃取小柱,采用纯水加标的方式,选择含1%甲酸的50%甲醇和含0.1%三氟乙酸的甲醇作为洗脱溶剂,其他步骤同1.3.3,对比两种洗脱溶剂的效果,每组分别做3个平行加标和1个空白对照.
1.3.5 柱胞藻毒素湖水加标实验
但是,在RTK技术的实际应用过程中,如果系统误差得不到完全的消除,就会影响工程数据的真实性、客观性和准确性。参考站作为一个工作站,其校正数据的有效作用距离就是RTK技术在实际应用中的最大问题。同时,GPS技术在使用过程中,受到空间相关性的影响,其误差也随参考站与移动站的实际距离的改变而发生非线性变化,进而导致定位精度降低。因此,在实际应用过程中,必须采取一定的措施降低测量过程中的系统性误差。
取0.22μm水相滤膜过滤后的淀山湖水100 mL,加入1 mL2μg/L的CYN标样,混匀,用10 mL纯甲醇和10 mL纯水活化碳黑固相萃取小柱,用含0.1%三氟乙酸的甲醇为洗脱溶剂,其他步骤同1.3.3.做3个平行加标和1个空白对照.
2 实验结果
2.1 节球藻毒素优化实验结果
2.1.1 节球藻毒素淋洗方式优化
纯水、10%甲醇和20%甲醇三者的淋洗效果如表1.结果显示,淋洗中随着甲醇浓度的增加,回收率逐渐降低,即淋洗损失的毒素也越来越多,而纯水淋洗则能够保证回收率在80.6%.因此,节球藻毒素的淋洗中,本实验选择纯水作为淋洗溶剂,以减少在这一过程中毒素的损失,保证回收率.
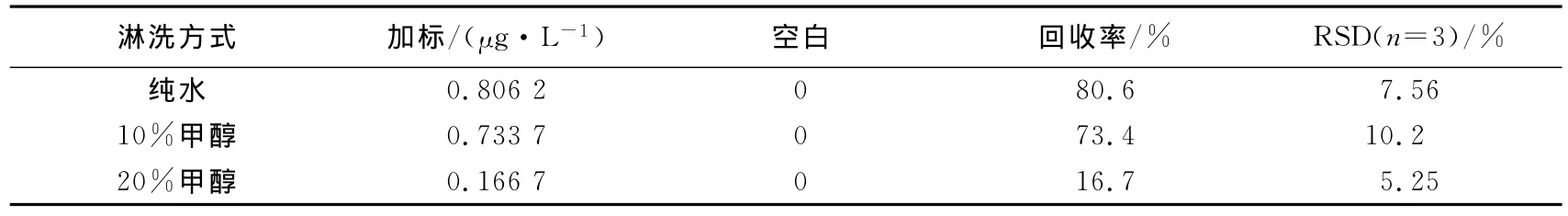
表1 淋洗方式优化Tab.1 Optimization of purge solvent
2.2 节球藻毒素湖水加标实验
淋洗方式的优化结果显示纯水的淋洗效果较好,为了验证在实际水样中整个固相萃取流程的效果,做了湖水加标实验.结果如表2所示.选择纯水淋洗、甲醇洗脱的整个固相萃取流程回收率为83%~106.7%,平均回收率为94.3%,表明该固相萃取流程能够作为实际水体中节球藻毒素免疫检测的前处理方法.?
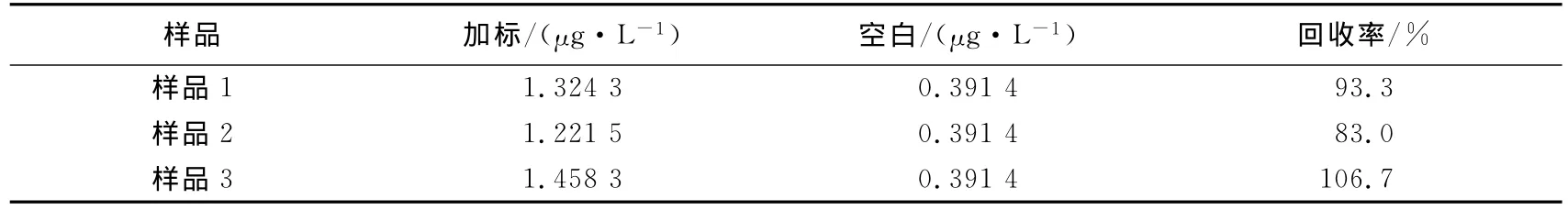
表2 NOD湖水加标结果Tab.2 Recoveries of NOD added in lake water
2.3 节球藻毒素优化后方法
优化后的节球藻毒素前处理方法如下:分别用10 mL甲醇和10 mL纯水活化柱子,以流速3~4 mL/min上样,然后用10 mL纯水淋洗,12 mL甲醇洗脱,洗脱液于35℃下用氮气吹干,纯水定容至1 mL,4℃保存待测.整个流程如下,其中重点优化步骤为淋洗方式.
2.4 柱胞藻毒素固相萃取柱活化方式
纯水活化与0.1%甲酸水活化的效果对比如表3.结果显示,两者都能保证实验的回收率,但是纯水活化的效果更好,而且取材方便.因此柱胞藻毒素固相萃取柱的活化就选择纯水,即选择10 mL纯甲醇和10 mL纯水活化碳黑固相萃取小柱.
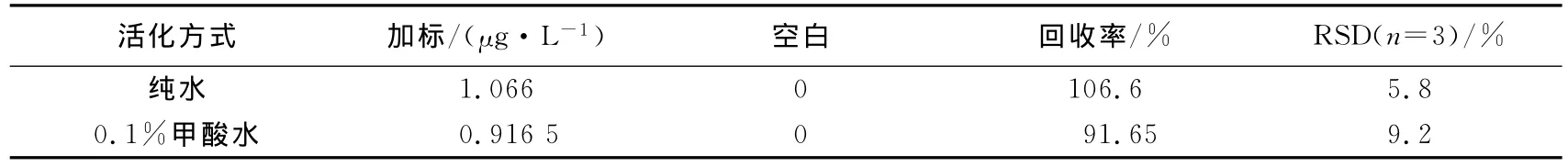
表3 固相萃取柱活化方式Tab.3 Optimization of activation
2.5 柱胞藻毒素洗脱溶剂优化
用含1%甲酸的50%甲醇和含0.1%三氟乙酸的甲醇作为洗脱溶剂,对比两种溶剂的洗脱效果,结果如表4所示.两者都能充分洗脱柱胞藻毒素,回收率分别是100.4%和118.7%,由于后者在氮吹过程中比前者速度快,因此,洗脱溶剂就选择0.1%三氟乙酸的甲醇,既能较快完成氮吹过程,又能充分洗脱毒素,提高效率.
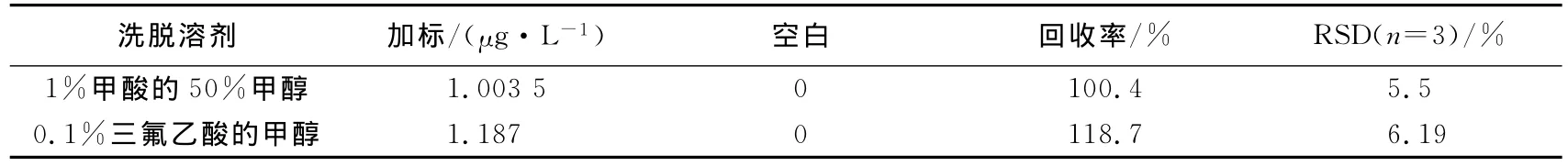
表4 洗脱溶剂优化结果Tab.4 Optimisation of eluent
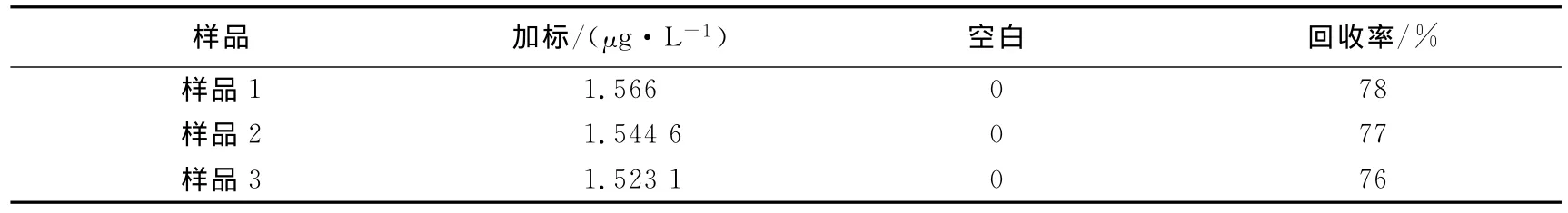
表5 CYN湖水加标结果Tab.5 Recoveries of CYN added in lake water
2.7 柱胞藻毒素优化后方法
柱胞藻毒素的前处理优化方法中对柱子的活化方式和毒素的洗脱溶剂进行了重点优化优,具体步骤为:10 mL甲醇和10 mL纯水活化碳黑固相萃取小柱,以2~3 mL/min的速度上样,然后用10 mL甲醇淋洗,用12 mL含0.1%三氟乙酸的甲醇洗脱毒素,洗脱液在35℃条件下氮气吹干,用0.1%氨水定容至1 mL,4℃保存待测.整个流程为:活化柱子→上样→10 mL甲醇淋洗→0.1%三氟乙酸甲醇洗脱→吹干0.1%氨水定容→Elisa检测.
3 讨 论
ELISAs是应用最为广泛的一种免疫检测方法,其基本原理是把抗原抗体反应的特异性和敏感性与酶的高效催化作用相结合.它在实际检测中具有一系列的优势,如灵敏度高、检测速度快等,自1990年ELISAs就开始用于藻毒素的检测[8].但在实际水样的检测中,由于毒素含量低,水样背景复杂,干扰因素多,在分析前一般需要对样品进行预富集.目前用固相萃取柱(Solid Phase Extraction,SPE)对藻毒素水样进行富集的方法已有很多研究.
在节球藻毒素的固相萃取中,洗脱液一般用纯甲醇[9-11],也有少数采用含有0.1%三氟乙酸的甲醇[12].在本实验的ELISAs检测中,HRP标记的毒素与样品中的毒素竞争结合数量有限的抗体位点.研究显示[13],极少量的三氟乙酸也能强烈抑辣根过氧化物酶(HRP)的活性,甲醇对HRP也有着明显的抑制作用,从而造成假阳性结果.因此本文选取纯甲醇作为洗脱溶剂,氮气吹干后纯水定容,避免了有机溶剂对ELISAs反应中HRP活性的干扰.湖水加标结果显示,该方法回收率为83%~106.7%,平均为94.3%,能够满足环境样品免疫检测的前处理需要.
对于柱胞藻毒素的固相萃取前处理,由于它的极性很强,在各种固相萃取柱上的保留效果都不是很好,有关环境水样中柱胞藻毒素的富集方法研究尚少.一般是将毒素从藻细胞或水样中萃取出来后直接进行HPLC-PDA或HPLC-MS/MS分析.Sachiko[14]利用阴离子交换原理在Oasis MAX柱上富集环境水样中的柱胞藻毒素,Metcalf[15]用C18柱和碳黑小柱串联富集水样中的柱胞藻毒素,把C18柱接在碳黑小柱前以除去水样中非极性或弱极性干扰物,得到了满意的富集效果.目前,国内关于柱胞藻毒素的富集分析方法很少.参考文献发现,根据所选柱子的不同,一般有两种不同的富集方法:甲醇—纯水作活化液,1%甲酸的50%甲醇作洗脱液[16],或者是甲醇—含0.1%甲酸的纯水作活化液,0.1%三氟乙酸的甲醇作洗脱液[17].本实验通过纯水加标的方式对这两种活化方式和洗脱溶剂进行了优化.如前文所述,ELISAs检测中HRP标记的柱胞藻毒素与水样中的毒素竞争结合有限的抗体,而HRP活性很容易被酸抑制,因此需要考虑氮气吹干后洗脱液中残留的酸对HRP的影响.故在洗脱液吹干定容时用0.1%氨水定容,以避免残留液中的酸抑制HRP活性造成假阳性的结果.湖水加标结果显示,该方法回收率为76%~78%,平均为77%,能够满足环境样品免疫检测的前处理需要.
4 结 论
WTO及我国的饮用水标准规定,水体中微囊藻毒素-LR含量不能高于1μg/L.对于节球藻和柱孢藻毒素,由于发现较晚且研究资料有限,目前还没有国家和组织对其进行含量限制.因此,本文的前处理方法可为相关标准的建立提供基础依据.
本文的节球藻和柱胞藻毒素的免疫前处理过程如下:①节球藻毒素 分别用10 mL甲醇和10 mL纯水活化柱子,3~4 mL/min的速度上样后10 mL纯水淋洗,12 mL甲醇洗脱,洗脱液在35℃条件下氮气吹干后用纯水定容至1 mL,4℃保存待测.②柱胞藻毒素 分别用10 mL甲醇和10 mL纯水活化碳黑固相萃取小柱,2~3 mL/min的速度上样后10 mL甲醇淋洗,12 mL含0.1%三氟乙酸的甲醇洗脱,洗脱液在35℃条件下氮吹仪吹干后用0.1%氨水定容至1 mL,4℃保存待测.这两种前处理方法对节球藻和柱胞藻毒素的ELISAs检测能保证有较好的回收率,加标回收率可达到94.3%和77%,能够满足环境样品免疫检测的前处理需要,可用于环境水样的监测,确保广大居民的饮用水安全.同时本方法的研究结果也能为建立节球藻和柱胞藻毒素的ELISA检测标准提供依据.
[1] FRANCIS G.Poisonous Australian lakes[J].Nature,1878,18(444):11-12.
[2] METCALF J S,CODD G A.Cyanobacterial toxins in the water environment:a review of current knowledge[J].Marlow,2004(2):1-36.
[3] WHO.Algae and Cyanobacteria in Fresh Water[M]//Guidelines for Safe Recreational Water Environments.Geneva:Coastal and Fresh Waters,2003(1):136-158.
[4] WHO.Guidelines for Drinking-water Quality,Second edition,Volume 2:Health Criteria and Other Supporting Information[M].Geneva:World Health Organization,1998.
[5] HUYNH-DELERME C,PUISEUX-DAO S.Algal toxins,inhibitors of serine/threonine phosphatases[J].C R Seances Soc Biol Fil,1998,192(3):387-408.
[6] OHTA T,SUEOKA E,LIDA N,et al.Nodularin,apotent inhibitor of protein phosphatases 1 and 2A,is a new environmental carcinogen in male F344 rat liver[J].Cancer Research,1994,54:6402-6406.
[7] HUMPAGE A R,FENECH M,THOMAS P,et al.Micronucleus induction and chromosome loss in transformed human white cells indicate clastogenic and aneugenic action of the cyanobacterial toxin,cylindrospermopsin[J].Mutation Research,2000,472(1-2):155-161.
[8] CHU F S,HUANG X,WEI R D.Enzyme-linked immunosorbent assay for microcystins in blue-green alga blooms[J].Assoc Offic Anal Chem,1990,73:451-456.
[9] 卫涛,冯小刚,袁春伟,等.水中痕量微囊藻毒素的检测[J].环境科学研究,2005,18(5):15-17.
WEI T,FENG X G,YUAN C W,et al.Determination of trace level microcystins in water[J].Research of Environmental Sciences,2005,18(5):15-17.
[10] 季林丹,刘慧刚,徐进,等.用高效液相色谱法检测天然水体中的微囊藻毒素[J].水生生物学报,2007,31(4):604-606.
JI L D,LIU H G,XU J,et al.Detection of microcystins in natural water by high-performance liquid chromatography[J].Acta Hydrobiologica Sinica,2007,31(4):604-606.
[11] 吴溶,崔莉凤,张冲,等.微囊藻毒素检测方法改进和圆明园实际水样的测定[J].北京工商大学学报:自然科学版,2010,28(1):24-29.
WU R,CUI L F,ZHANG C.et al.Improvement of microcystins detection and determination of Yuanmingyuan water[J].Journal of Beijing Technology and Business University:Natural Science Edition,2010,28(1):24-29.
[12] 庄一廷.固相萃取——高效液相色谱法测定某水库型水源地微囊藻毒素[J].福建分析测试,2008,17(3):31-34.
ZHUANG Y T.Determination of microcystis in a reservoir as drinking water source by SPE-HPLC[J].Fujian A-nalysis & Testing,2008,17(3):31-34.
[13] 陈建波,夏春谷,李树本.水-有机溶剂混合体系中辣根过氧化物酶的催化反应[J].上海师范大学学报:自然科学版,2005,34(3):71-75.
CHEN J B.XIA C G.LI S B.Studies on horseradish peroxidase in water-organic solvents[J].Journal of Shanghai Teachers University:Natural Science,2005,34(3):71-75.
[14] METCALF J S,BEATTIE K A,SAKER M L,et al.Effects of organic solvents on the high performance liquid chromatographic analysis of the cyanobacterial toxin cylindrospermopsin and its recovery from environmental eutrophic waters by solid phase extraction[J].FEMS Microbiology Letters,2002,216:159-164.
[15] TAKUYA K,TOMOHARU S,KEN H.et al.A new simply and effective fractionation method for cylindrospermopsin analyses[J].Toxicon,2005,46:104-107.
[16] BLÁHOVÁ,L,MICHAL ORAVEC B,MÁRSÁLEK L,et al.The first occurrence of the cyanobacterial alkaloid toxin cylindrospermopsin in the Czech Republic as determined by immunochemical and LC/MS methods[J].Toxicon,2009,53:519-524.
Ex-treatment of immunoassay method for nodularin and cylindrospermopsins
LI Shuang1, YIN Hao-wen2
(1.School of Life Science,East China Normal University,Shanghai 200062,China;2.The Bioassay and Safety Assessment,Shanghai Academy of Public Measurement,Shanghai 201203,China)
Effective solid phase extraction (SPE)ex-treatment method and sensitive enzymelinked immunosorbent asssay(ELISA)were developed for determining the nodularins(NOD)and cylindrospermopsins(CYN)in water samples.Due to the different polarities,two different ex-treatment methods were applied to NOD and CYN,respectively.The methods were developed as followed:①For NOD,firstly the C18column was activated by 10 mL methanol and 10 mL Milli-Q water;then the sample was applied to the column at 3-4 mL/min;after washing the column with10 mL water,the NOD was eluted with10 mL methanol;then the eluent was driedup with a rotary evaporator,and lastly the final volume was fixed to 1 mL with Milli-Q water for ELISA analyse.②For CYN,the carb SPE tubes were activated with10mL methanol and 10mL Milli-Q water;then the sample was applied to the tubes at 2-3 mL/min;after washing the tubes with 10mL methanol,the CYN was eluted with12 mL methanol containing 0.1%trifluoroacetic acid;then the eluent was dried up with a rotary evaporator,lastly the final volume was fixed to 1 mL with Milli-Q water containing 0.1%ammonia for ELISA analyse.The results indicated that these methods can guarantee the good recoveries of NOD and CYN for ELISA analyse,which could reach to 94.3%and 77%,respectively.
nodularins; cylindrospermopsins; ELISAs
Q89
A
10.3969/j.issn.1000-5641.2011.06.013
1000-5641(2011)06-0108-07
2010-11
上海市自然科学基金(08ZR1416600)
李双,女,硕士研究生.E-mail:lis2011@126.com.
殷浩文,男,教授级高级工程师,研究方向为环境毒理学.E-mail:yinhaowen@126.com.
