胞外分泌物对铜绿微囊藻混凝去除的影响
2011-12-20乔俊莲胡颖慧
乔俊莲,董 磊,徐 冉,胡颖慧
(同济大学 环境科学与工程学院,上海200092)
蓝藻水华已给我国国民经济和社会发展造成了巨大危害[1].由于蓝藻水华爆发的突发性和大规模性等特点,混凝沉淀除藻法依然是处理这一环境污染问题的最主要的方法之一[2].因此,如何优化混凝条件提高除藻效果并减少药剂投加量是近年来研究的热点[3].
文献表明藻形态、表面电荷、活性、细胞密度及胞外分泌物(EOM)等都是影响混凝效果的因素[4].其中EOM的组成和浓度是影响混凝剂绝对需求和除藻效果的主要因素[5].目前分析认为胞外分泌物其主要成分是多糖、特定的酶和蛋白[6].这些物质在混凝过程中均表现为阴离子特性,它们与混凝剂或形成络合物,或形成水合离子[7],因此对阳离子絮凝剂具有强烈干扰作用,特别是分泌物中一种金属酶,其对金属离子有强吸附作用,所以当水体中胞外分泌物含量很高时,混凝剂的作用即被大大削弱[8].Tomoko Takaaraa等[9]通过将胞外分泌物(EOM)与胞内分泌物(IOM)分别离心提纯后,独立研究两者对混凝的不同影响,实验发现EOM与IOM均对混凝有干扰作用.然而,目前对EOM如何影响藻混凝机理的研究未有报道.
本文采用不同类型的混凝剂,包括无机低分子混凝剂(硫酸铝、氯化铁)、无机高分子混凝剂(聚铝、聚铁)、天然高分子混凝剂(粉煤灰改性壳聚糖)等进行铜绿微囊藻混凝实验,分析了EOM对藻类混凝过程的影响,并通过可溶性有机碳(DOC)、Zeta电位和UV254的变化,探究了EOM对藻类混凝去除的影响机理,以期进一步完善人们对EOM影响藻类混凝的认识.
1 实验材料与方法
1.1 实验仪器
总 碳 分 析 仪(TOCV-CPN,岛 津),Zetasizer Nano Z 型Zeta电位分析仪(英国马尔文),叶绿素荧光仪(德国WALZ),UV-1800 紫外可见分光光度计,MY3000-6 智能型混凝试验搅拌仪,XSP-8C 三目生物显微镜,101a-1 型电热干燥箱,TGL-16C 台式离心机
1.2 药剂与材料
聚氯化铝(PAC)(市售,Al2O3,29%~32%,盐基度,50%~85%);硫酸铝(分析纯,上海美兴化工有限公司);聚硫酸铁(全铁含量22%,盐基度,12.6%,淄博天水化工有限公司);三氯化铁(分析纯,上海精化科技研究所);壳聚糖(脱乙酰度>90%,国药集团化学试剂有限公司);聚丙烯酰胺(阳离子Kingfloc 635,非离子Kingfloc 4150,阴离子Kingfloc 6180,上海美奈清工贸有限公司);粉煤灰(郑州某火力发电厂);0.45μm 微孔滤膜.
藻种(铜绿微囊藻(Microcystisaeruginosa))购于中国科学院水生生物研究所国家淡水藻种库(FACHB),编号为FACHB-469.接种好的水样置于玻璃瓶中,在光照生化培养箱中培养,培养温度为25℃,光照强度为1 000lx,光暗比(L∶D)=12∶12.
1.3 实验方法
1.3.1 粉煤灰改性壳聚糖的制备
将定量粉煤灰与20.0mL 的浓盐酸混合搅拌,在一定温度下反应2h.过滤得到活化后的粉煤灰滤液并定容至500 mL,在滤液中加入定量壳聚糖,使壳聚糖浓度为0.25g·L-1,混合1h后即得改性壳聚糖.
1.3.2 藻液预处理
(1)以培养箱中处于对数期原藻液用0.5%NaCl溶液稀释到藻细胞数为3.48×106cells·mL-1进行不同混凝剂的混凝实验,此浓度接近水华发生时藻浓度,吸光值OD680nm=0.150.
(2)分离除去EOM:原藻液12 000 r·min-1下离心5 min,弃去上清液,并用0.5%的NaCl溶液将离心管中富集的藻配置成与(1)中浓度一致的藻悬液,然后进行不同混凝剂的混凝实验.
对比(1),(2)分析EOM对混凝的影响.每次进行混凝实验时藻悬液现用现配,避免放置时间过长藻细胞活性受到影响.
1.3.3 DOC的测定
将藻原液和絮凝后上清液分别经过0.45μm 的滤膜过滤后,用总碳分析仪(TOCV-CPN,日本岛津)直接测定水中DOC,以表征胞外分泌有机物(EOM).
1.3.4 Zeta电位的测定
用Zeta电位分析仪(Zetasizer Nano Z,英国马尔文)测定藻细胞表面的Zeta电位,比较随条件变化藻细胞Zeta电位的变化情况.
1.3.5 絮凝效果的测定
600mL 烧杯中加入500mL 藻悬液,投加指定量的药剂.250r· min-1快速搅拌2 min,30r·min-1慢速搅拌5 min.静沉1h后,于液面下2cm处取上清液计藻数目.
2 结果与讨论
2.1 EOM对无机混凝剂除藻的影响
分别使用PAC、硫酸铝、聚铁、氯化铁4种无机混凝剂对原藻液(未移除EOM)和EOM移除后同样浓度的藻悬液进行混凝实验.藻去除率及EOM变化结果如图1a,1b所示.图中实线代表藻的 “去除率”;虚线代表藻液“DOC”,即EOM的变化.藻液Zeta电位和UV254的变化如图2a,2b所示,图中实线代表 “Zeta电位”;虚线代表藻 “UV254”.
由图1a可知,对于未移除EOM的藻液,4种混凝剂在投加量上都存在一个阈值.以PAC 为例,当PAC投加20mg·L-1时,藻的去除率只有26%,但DOC已从开始的14.24 mg·L-1急剧下降至7.45 mg·L-1.增加投加量至40 mg·L-1时,DOC 缓慢下降至4.61 mg·L-1,藻去除率大幅上升到92%.
由图1b可知,当大部分EOM移除后,PAC投加10 mg·L-1时,去除率就可达到83.3%,继续增加投加量,去除率增加不大,维持在90%左右.从絮体来看,移除EOM后藻液形成絮体速度快,但絮体松散细小,其形态和处于衰亡期藻混凝形成的絮体类似,静沉速度也明显比未移除EOM的藻液缓慢.

图1 EOM对无机混凝剂除藻效果的影响Fig.1 Effect of EOMon algae removal by inorganic flocculant
因此EOM对絮凝除藻影响很大,在混凝初期EOM优先与PAC 结合,消耗混凝剂减小有效投加量,当EOM下降到一定浓度后,PAC 才吸附到藻表面发挥絮凝除藻的作用,同时前期与PAC 结合的EOM有利于絮凝后续过程中的网捕卷扫,使得藻絮体大而密实,短时间内藻去除率也上升到90%以上.这与H Bernhardt等[10]的研究类似,即在条件合适时EOM起促凝作用.
硫酸铝、聚铁、氯化铁的实验结果相似,对于未移除EOM的藻液,投加量的阈值分别出现在60,40,60 mg·L-1,进一步加大混凝剂投加量后原藻液的去除率都可达到99%甚至100%,而EOM移除后的藻液中硫酸铝、聚铁、氯化铁投加量只需10 mg·L-1,藻去除率就分别可以达到60%,94.3%,92%.但最高去除率均低于95%,其中硫酸铝除藻效率最高仅75.3%.
从藻的表面电位及UV254变化来看,仍以PAC为例,由图2a可知,对于原藻液混凝剂投加到阈值40 mg·L-1时,藻液zeta 电位才恰好由初始的-40.2 mV降到-12.7 mV,去除率达到92%.其他3种混凝剂的结果相似,即藻液的Zeta电位降到-12 mV左右时,去除率可达90%以上.同时发现无机高分子混凝剂PAC和聚铁电中和的能力明显优于低分子药剂硫酸铝和氯化铁.
由图2b可知,移除EOM后藻液电位初始值在-15~-17 mV,相比原藻液急剧下降,PAC投加10 mg·L-1,藻电位就可以降到-10~-12 mV,进一步印证了混凝剂优先和EOM结合,之后再通过电性吸附等作用结合到藻细胞的表面,降低藻表面电位[11],减弱了藻细胞间静电排斥作用[12],破坏了藻液的稳定性,进而发挥网捕架桥作用絮凝去除藻细胞.

图2 EOM对无机混凝剂除藻Zeta电位及UV254的影响Fig.2 Effect of EOMfor Zeta and UV254on algae removal by inorganic flocculant
UV254的变化趋势和DOC 一致,原藻液中PAC、硫酸铝、聚铁、氯化铁投加量到阈值时UV254的去除分别为64.37%,51.35%,54.17%,60.26%,即当UV254下降到50%以上时,混凝剂除藻的效果才得以显现.而EOM移除后的藻液中UV254去除率达99%左右,进一步证明了离心去除EOM的有效性.
2.2 EOM对粉煤灰改性壳聚糖除藻的影响
本实验中所用壳聚糖经粉煤灰改性后有效地利用了壳聚糖的架桥作用和粉煤灰滤液中的Al,Fe成分.混凝剂集电中和、吸附架桥、网捕卷扫等多种作用于一身,与其他混凝剂相比优势明显,投加量小,絮凝除藻效率高.实验结果如图3,图4所示.图中实线代表藻的“去除率”;虚线代表藻液“DOC”,即EOM的变化.
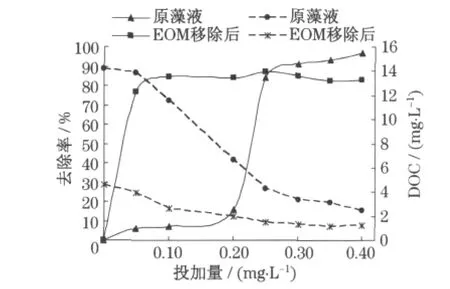
图3 EOM对改性壳聚糖除藻效果的影响Fig.3 Effect of EOMon algae removal by modified chitosan
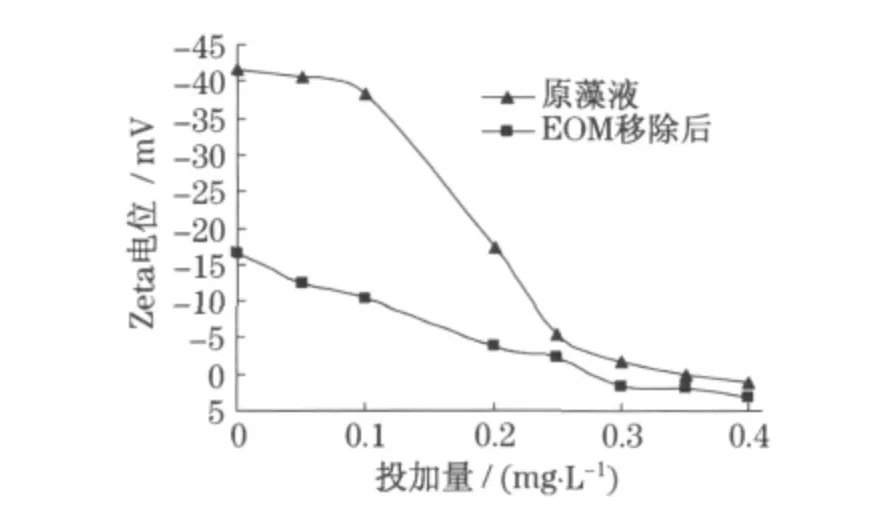
图4 EOM对改性壳聚糖除藻Zeta电位的影响Fig.4 Effect of EOMfor Zeta on algae removal by modified chitosan
由图3 可知,随着改性壳聚糖投加量的增加,DOC值急剧下降,当改性壳聚糖投加0.2mg·L-1时,DOC已由初始的13.3mg·L-1下降至5.1mg·L-1,但藻的去除率却不到20%,继续增加壳聚糖投加量,藻的去除率才开始大幅上升,到90%左右之后趋于平缓,DOC则基本稳定不变,而EOM移除后的藻液,只需投加0.05 mg·L-1的改性壳聚糖除藻率就可以达到76.7%,投加0.1 mg·L-1时即达到除藻上限在85%左右.
从藻的表面电位变化看,如图4,原藻液中当壳聚糖投加量大于0.2 mg·L-1时藻表面电位才开始由-40.6 mV下降到-14.7 mV,此时对应的藻去除率也开始上升到90%以上,而EOM移除后的藻液中藻细胞Zeta电位下降至-16.3 mV,进一步证实了EOM是阴离子聚电解质,使藻细胞成电负性,影响了藻体的絮凝.
2.3 不同浓度EOM对藻类混凝的影响
配置OD680=0.05,0.15,0.25,0.35 四种浓度的藻液进行各混凝剂的混凝实验,考察在藻、EOM浓度梯度下实验结果的差异,实验结果如图5.

图5 不同浓度EOM对藻类混凝的影响Fig.5 Influence of EOMconcentration on coagulation
PAC、硫酸铝、聚铁、氯化铁、改性壳聚糖都采用OD680=0.15时的最佳投加量,即分别投加40,80,60,70,40,0.3mg·L-1,由图5可知,不同混凝剂的絮凝结果呈现相近的趋势:低浓度藻液混凝效果明显好于高浓度藻液,高藻水的处理需要更高的药剂投加量.这与周荣等[13]的研究结果一致.
3 结论
分别使用无机混凝剂、合成高分子混凝剂,改性天然高分子混凝剂进行混凝实验,考察藻类胞外分泌物(EOM)对不同类型混凝剂除藻的影响,得到以下结论:
(1)EOM影响混凝具有利弊双重作用,具体表现在混凝前期优先结合混凝剂减小了有效投加量并阻碍了电中和作用,当适宜质量浓度的EOM(3~5 mg·L-1)下,前期与混凝剂结合的EOM有利于絮凝过程中的网捕卷扫作用,起到了很好的助凝效果,所以合理利用EOM将成为提高混凝效果,节省资金的关键.
(2)不同特性混凝剂的除藻效果存在差别,混凝除藻要达到很好的效果最好结合混凝剂的电中和、吸附架桥、网捕卷扫等多种作用,无机高分子混凝剂PAC 和聚铁电中和的能力明显优于低分子药剂硫酸铝和氯化铁.改性壳聚糖相比其他药剂,投加量少,有较强的环境适应性,是混凝除藻比较理想的药剂.
(3)低浓度EOM宏观上对混凝有促进作用,高浓度干扰混凝.因此在实际运用中,低的药剂投加量不适合高浓藻的处理,增加药剂投加量有助于缓解EOM对混凝的干扰,使高浓藻水质改善.
[1] 赵志刚,刘宏.中国科学院 “十一五”第一批知识创新工程重大项目简介(二)[J].中国科学院院刊,2008,23(4):353.ZHAO Zhigang,LIU Hong.A brief introduction of the knowledge innovation program of CAS in the 11th five year plan period(Ⅱ)[J].Bulletin of the Chinese Academy of Sciences.2008,23(4):353.
[2] Zou H,Pan G,Chen H,et al.Removal of cyanobacterial blooms in Taihu Lake using local soils.Ⅱ.Effective removal ofMicrocystisaeruginosausing local soils and sediments modified by chitosan[J].Environ Pollut,2006,141(2):201.
[3] Chen J J,Yeh H H,Tseng I C.Effect of ozone and permanganate on algae coagulation removal-pilot and bench scale tests[J].Chemosphere,2009,74(6):840.
[4] Henderson R K,Parsons S A,Jefferson B.Successful removal of algae through the control of zeta potential[J].Separation Science and Technology,2008,43:1653.
[5] Henderson R K,Parsons S A,Jefferson B.The impact of algal properties and pre-oxidation on solid-liquid separation of algae[J].Water Res,2008,42(8-9):1827.
[6] Takaara T,Sano D,Konno H,et al.Affinity isolation of algal organic matters able to form complex with aluminum coagulant[C]//Proceedings of IWAWorld Water Congress.[S.l.]:IWA World Water Congress,2004:19-24.
[7] Takaara T,Sano D,Konno H,et al.Affinity isolation of algal organic matters able to form complex with aluminum coagulant[J].Water Sci Technol:Water Supply,2005,4(5-6):95.
[8] Schwartz B,Markwalder J A,Seitz S P,et al.A kinetic characterization of the glycosyltransferase activity of Eschericia coli PBP1b and development of a continuous fluorescence assay[J].Biochemistry,2002,41:12552.
[9] Tomoko Takaaraa,Daisuke Sanoa,Hiroshi Konnob,et al.Cellular proteins of microcystis aeruginosa inhibiting coagulation with polyaluminum chloride[J].Water Research,2007,41:1653.
[10] Bernhardt H,Clasen J.Flocculation of microorganisms[J].J Water SRT-Aqua,1991,40(2):76.
[11] Taki K,Seki T,Mononobe S,et al.Zeta potential measurement on the surface of blue-green algae particles for micro-bubble process[J].Water Sci Technol,2008,57(1):19.
[12] Divakaran R,Sivasankara Pillai V N.Flocculation of algae using chitosan[J].Journal of Applied Phycology,2002,14(5):419.
[13] 周荣,罗晓鸿,王占生,等.藻类对混凝的影响[J].中国给水排水,1997,13(4):37.ZHOU Rong,LUO Xiaohong,WANG Zhansheng,et al.Influence of algae on coagulation process[J].China Water &Wastewater,1997,13(4):37.
