激光共聚焦扫描显微镜和透射电镜观察大鼠纹状体内谷氨酸能突触连接的对比观察
2011-12-15张进禄赵君朋
蔡 青 姬 曼 张进禄 赵君朋
激光共聚焦扫描显微镜和透射电镜观察大鼠纹状体内谷氨酸能突触连接的对比观察
蔡 青 姬 曼 张进禄*赵君朋*
(首都医科大学医学实验与测试中心,北京100069)
目的 探讨使用激光共聚焦扫描显微镜 (Laser scanning confocal microscope,LSCM)观察大鼠纹状体内谷氨酸能突触连接的方法的可行性。方法 12只正常大鼠分为两组,6只大鼠进行纹状体中等棘刺神经元的CM-DiI单细胞标记,然后Ⅰ型囊泡膜谷氨酸转运体(vesicular glutamate transporter 1,V Glu T1)免疫荧光标记,LSCM层扫后三维重建,观察V Glu T1阳性位点在中等棘刺神经元树突上的分布。另外6只大鼠用 TEM观察不对称性突触在纹状体神经元树突上的分布。对两种方法的结果进行比较。结果 用LSCM和TEM方法观察到的纹状体神经元上谷氨酸能突触连接分布情况一致,没有统计学差异。但LSCM更具优越性的是,可以对图像进行三维重构,从而有利于对神经元之间突触连接的空间分布观察和定量分析。结论 神经细胞荧光标记技术结合LSCM观察是考察纹状体神经元上谷氨酸能突触连接的有效方法。
激光共聚焦显微镜; 透射电镜; 免疫荧光染色; 突触
在中枢神经系统中,基底神经节回路参与对复杂运动的调控,其病变会导致运动功能异常,如帕金森病和亨廷顿病等[1-3]。纹状体是基底神经节回路的中央加工区,其中最主要的神经元是中等棘刺神经元,约占神经元总数的95%[2,3]。中等棘刺神经元主要接受来自大脑次级感觉区和更高级联络皮质的谷氨酸能纤维投射。谷氨酸能投射纤维传递控制运动的信号,形成纹状体内的绝大多数不对称性突触;另外,中等棘刺神经元还接受多巴胺、γ-氨基丁酸和胆碱能纤维投射形成对称性突触[2-5]。不同来源的突触信号在纹状体中等棘刺神经元树突上整合,从而实现运动的计划,启动和终止。因此,了解中等棘刺神经元上不同突触的空间分布特点,对于全面理解基底神经节参与运动调控的机制具有十分重要意义。最近,激光共聚焦扫描显微镜 (Laser scanning confocal microscope,LSCM)技术的不断发展,其成像分辨率大大提高;而且在图像处理软件的辅助下,还可实现图像的三维重建。为此,本研究拟采用LSCM扫描荧光标记中等棘刺神经元和谷氨酸能纤维末梢,考察成年大鼠谷氨酸能纤维末梢在中等棘刺神经元树突上的空间分布特点。同时,应用透射电镜(Transmission electron microscopy,TEM)的方法考察纹状体神经元树突上不对称性突触的分布,对LSCM方法进行评价。
材料和方法
1.动物与分组
12只正常雄性 SD大鼠,体重230-250g,由首都医科大学实验动物学部提供。6只大鼠进行中等棘刺神经元标记和免疫荧光染色,6只大鼠进行透射电镜观察。
2.仪器与试剂
振荡切片机(Leica公司),LSCM(Leica公司),透射电镜(JEOL公司),CM-DiI(Invitrogen公司),兔抗V Glu T1(Sigma公司),Alexa 488标记山羊抗兔Ig G(Invitrogen公司),气压式基因枪(宁波新芝公司)。
3.方法
3.1 CM-DiI包被钨粉颗粒的制备:将50mg基因枪用钨粉颗粒(直径≤1.6μm)均匀撒在载玻片上,将5mg CM-DiI溶解于二氯甲烷,然后滴加到钨粉颗粒上,二氯甲烷挥发完全后,CM-DiI包被到钨粉颗粒上。采集钨粉颗粒到离心管内,加入3ml去离子水,超声振荡5min,使钨粉颗粒分散,4℃保存。
3.2 中等棘刺神经元标记:大鼠水合氯醛腹腔注射过量麻醉(80 mg/kg),先后用150ml生理盐水和300ml含有 0.1%EDTA的2%多聚甲醛(paraformaldehyde,PFA)进行左心室-升主动脉插管灌注固定。取全脑,放入上述固定液中后固定2h。取含有纹状体的脑组织块,进行连续冠状面振荡切片,厚度为250μm。切片在含有0.1%EDTA的0.1mol/L磷酸盐缓冲液(Phosphate buffered saline,PBS)中4℃过夜 。每个脑选取 5张含有纹状体的切片,进行单细胞标记:用气压式基因枪(0.2-0.3MPa气压)将上述钨粉颗粒输送切片上,然后将切片放入含有0.1%EDTA的 PBS中室温放置6-8h,再转入4℃含有0.1%EDTA的4%PFA中固定6-8h。
3.3 V Glu T1免疫荧光染色:取上述CM-DiI标记的切片,用 0.01mol/L PBS浸洗10min×3次。然后在含有0.1%Tween-20的PBS中细胞膜打孔30min。PBS浸洗10min×3次后,用5%正常羊血清室温下封闭抗原 1h。随后在 1:2000兔抗V Glu T1(PBS/1%BSA配制)中孵育,4℃过夜。PBS浸洗10min×3次后,用1:400 Alexa 488标记山羊抗兔 Ig G孵育,避光室温2h。0.01MPBS浸洗10min×3次后,PBS封片。
3.4 LSCM观察:选取DiI标记的树突进行照相,然后用Leica LAS AF图像处理软件进行三维重建。LSCM参数为63×oil immersion objective[numerical aperture,1.25];Step-size:0.3μm;optical zoom:7.5;resolution:1024×1024 pixels。对三维重建的图片,测量树突段与胞体的距离,计数树突干和树突棘上的V Glu T1阳性位点的数目。
3.5 电镜标本制作:大鼠水合氯醛腹腔注射过量麻醉(80 mg/kg),先后用 37℃0.1mol/L PB(含100IU/ml肝素)和4℃含2%戊二醛的4%PFA(0.1MPB配制,p H7.4)进行左心室-升主动脉插管灌注固定。取1mm3的纹状体组织,放3%戊二醛内后固定3h。0.1mol/L PB浸洗10min×3次后,1%锇酸(0.1mol/L PB配制)作用40min。脱水,树脂包埋,超薄切片,厚度70nm,乙酰铀和醋酸铅复染。
3.6 透射电镜观察,按照随机原则选取不对称突触,进行40,000×照相。神经元超微结构的认定参考Perters A[2]:其中,树突干为不含细胞核的突起,轮廓平滑规则,含有线粒体、尼氏体和平行排列的神经原纤维等,但无高尔基复合体。树突棘较树突干小,缺乏微管和线粒体和粗面内质网,存在绒毛状物质,这些绒毛状物质常含有颗粒状小团,在一些超薄切片中,树突棘的头部或/和颈部有棘器(内质网的扁平膜囊)结构。不对称性突触的突触前末梢至少含有3个突触性囊泡,前后膜平行,前后膜的间隙大,突触后膜的PSD厚。
4.统计学方法
应用SPSS11.5统计软件,对CLSM和透射电镜方法得到的树突上V Glu T1位点分布比例进行X2检验分析。
结 果
1.LSCM观察不对称性突触连接
应用LSCM观察CM-DiI和V Glu T1标记的大鼠脑切片,可见CM-DiL标记的大鼠纹状体细胞中,有一部分细胞呈现中等棘刺神经元的典型形态[5]。其胞体中等大小,直径在15μm左右,胞体发出4-8支树突,这些树突可以再次分支;靠近胞体(20-30μm)的树突表面光滑,没有树突棘;而在远离胞体的树突上则有密集的树突棘分布,据此特征可将中等棘刺神经元与纹状体胶质细胞及其它类型神经元相区分 (图1.a)。
V Glu T1阳性标记部位呈点状;V Glu T1阳性位点很少分布于胞体近侧的树突上;在远离胞体的树突上,V Glu T1阳性标记物大多分布于树突棘上,而很少分布于树突干上(图1.b和图1.c)。并且每个树突棘上只有一个不对称性突触。统计结果显示:在中等棘刺神经元的树突(共计数32段树突)上,90.37%的V Glu T1阳性位点分布于树突棘上,9.63%的V Glu T1阳性位点分布于树突干上。

图1 CM-DiI单细胞标记中等棘刺神经元结合VGlu T1免疫荧光染色,共聚焦显微镜层描叠加后的的图像。(A)DiI标记的单个纹状体中等棘刺神经元;标尺为30μm。(B)V Glu T1阳性位点(绿色)与一个中等棘刺神经元的树突棘相接触。(E)V Glu T1阳性位点(绿色)与一个中等棘刺神经元的树突干相接触。图中的虚线显示的是 Y-Z视野(D和 F)和X-Z视野(C和 G)所在的位置;标尺=5μm。Fig.1 Identification of sites of contacts between VGlu T1 positive punctuates and CM-DiIlabeled medium spiny neurons by CLSM.(A)CM-DiIlabeled medium spiny neurons.(Bar=30μm).(B)A VGlu T1 positive punctuates(green)makes contacts with a dendritic spine(red).(E)a VGlu T1 positive punctuates(green)makes contacts with a dendritic branch(red).The dotted lines in represent the position within the X-Y view at which the Y-Z view(D,F)and the X-Z view(C,G)were generated.(Bar=5μm)
2.TEM观察不对称性突触连接
透射电镜下观察到,纹状体内有大量的对称性和不对称突触。其中,不对称性突触的突触前、后膜平行,突触后致密带厚而明显(图2);对称性突触的突触前、后膜平行,但是突触后致密带不明显,仅表现为突触后膜的轻度增厚。据此特点,两种突触可以很明显地进行区分。在本实验中,随机选取了278个不对称性突触进行分布特点观察分析,结果显示,93.53%的不对称性突触分布于树突棘上,6.47%的不对称性突触分布于树突干上,而且每个树突棘上只有一个不对称性突触。此 TEM观察结果与上述LSCM的观察结果一致,即大鼠纹状体神经元的不对称性突触连接位点在树突干和树突棘上的分布比例相同。
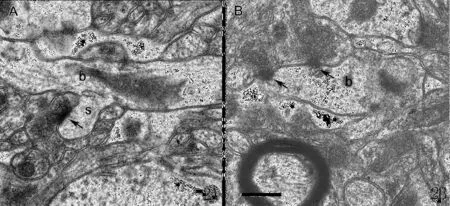
图2 正常大鼠纹状体不对称性突触的透射电镜观察。标尺 =0.5μm(A)显示一个轴突与从树突干b上伸出的树突棘s形成不对称性突触(箭头所示);(B)显示两个轴突与一个树突干b形成两个不对称性突触(箭头所示);标尺=0.5μm。Fig.2 Micrographs of electron microscopy showing asymmetric synapses in the striatum。White bar=5μm(A):an axon terminal makes a asymmetric synaptic contact(black arrow)onto a dendritic spine“s”which project from a dendrite branch“b”.(B):Two axon terminals make asymmetric synaptic contacts(black arrow)onto a dendrite branch“b”.(Bar=5 μm)
3.LSCM方法观察谷氨酸能不对称性突触连接分布的特征
使用LSCM观察CM-DiI和V Glu T1双标记的谷氨酸能不对称性突触连接位点并测量树突段与胞体的距离后,可以绘制出V Glu T1阳性突触位点在树突距胞体近侧段和远侧段的分布图(图3)。分布图显示:V Glu T1阳性位点在中等棘刺神经元树突上的分布呈现出由低到高再到低(沿树突近侧→远侧方向)的趋势。这与以住应用神经束路示踪方法得到的结果相类似[6]。
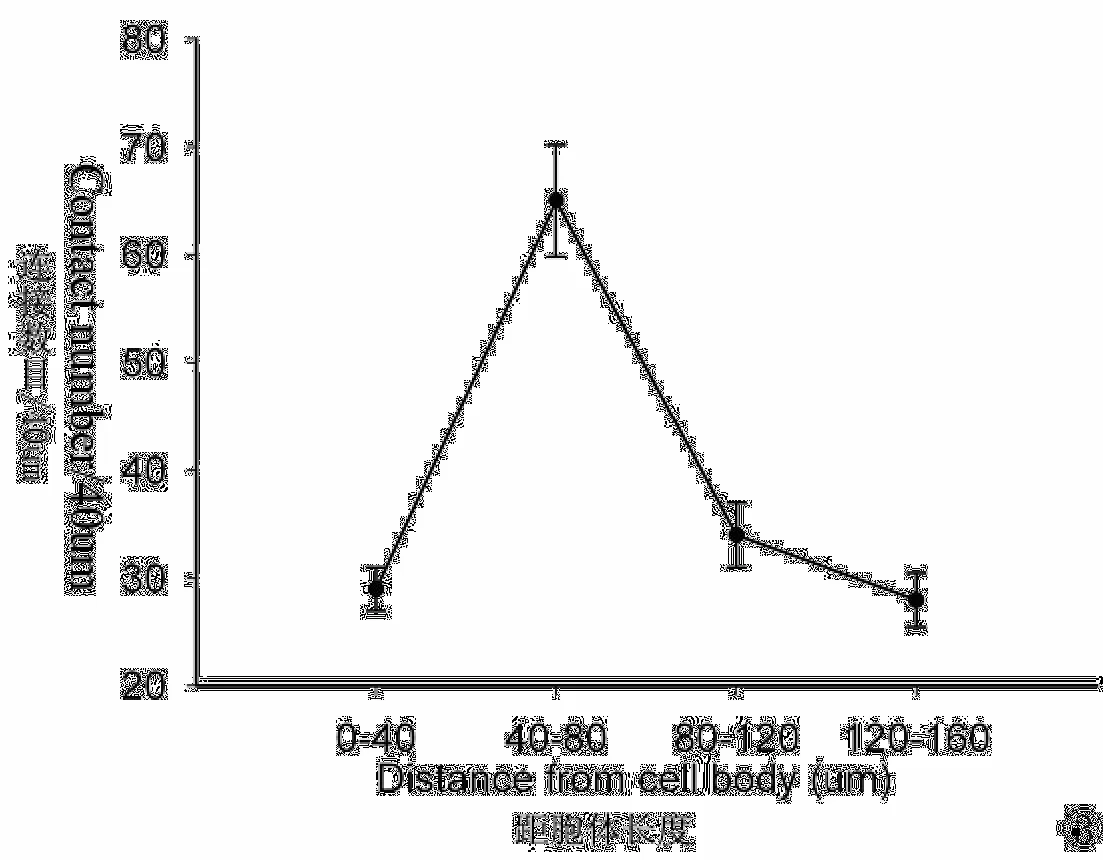
图3 VGlu T1阳性位点在中等棘刺神经元树突上的分布统计图Fig.3 The distributions of V Glu T1 positive punctates making contact with the dendrites of medium spiny neurons.
讨 论
当前,TEM是考察中枢神经系统突触连接的最常用方法[6-9]。但这一方法对组织处理有特殊要求;并且在电镜样品中标记突触前、后神经元不仅费时且不经济有效。因此TEM往往只用作突触连接的定性研究,也很难实现对突触前末梢在突触后神经元上的空间分布进行定量考察[7,9]。而这些信息对于了解神经元上突触信号的整合又极为重要。本研究中,我们应用CM-DiI单细胞标记中等棘刺神经元。CM-DiI是脂溶性荧光染料DiI的一种衍生物可在细胞膜上扩散,因此可以被清楚地显示出细胞的轮廓。并且,经甲醛固定后CM-DiI可以抵抗去污剂 Tween-20(用 Tween-20进行细胞膜打孔时CM-DiI不会在细胞膜间扩散),所以CM-DiI标记样品还可以进行免疫荧光染色。V Glu T1(Ⅰ型囊泡膜谷氨酸转运体)是皮质纹状体谷氨酸能纤维末梢的标记物[4,7]。我们应用 CM-Dil和V Glu T1分别标记纹状体内的中等棘刺神经元和谷氨酸能纤维末梢,实现对观察样品中突触前、后神经元的标记。
以住研究发现,来自于大脑皮质的谷氨酸能神经纤维投射至纹状体中等棘刺神经元,形成不对称性突触;γ-氨基丁酸和多巴胺等其它递质类型的投射纤维则形成对称性突触[1-5]。所以,分布在纹状体神经元上的不对称性突触中的突触前末梢即是谷氨酸能纤维末梢。本研究中,CLSM和 TEM观察结果均显示每个树突棘上通常都只有一个不对称性突触。统计分析结果显示:V Glu T1阳性位点在树突干和树突棘上的分布比例与不对称性突触在树突干和树突棘上的分布比例,二者没有显著性差异(P>0.05)。综上所述说明,1)LSCM观察到的V Glu T1阳性位点与中等棘刺神经元的接触位点即是谷氨酸能突触所在;2)LSCM方法可以有效地用于观察谷氨酸能纤维末梢与纹状体神经元树突的突触连接。
另外,本研究发现V Glu T1阳性位点在中等棘刺神经元树突上的分布呈现由低到高再到低(从树突近侧→远侧)的趋势,这与以住应用逆行束路追踪和免疫荧光组织化学双标技术研究结果相一致[6]。这说明,LSCM方法不仅是一种有效地观察谷氨酸能纤维末梢在中等棘刺神经元上的空间分布简易方法,并且也可用于突触空间分布定量研究。与普通光镜相比,CLSM不仅分辨率高,而且可在三维重建后从X-Y,Y-Z和X-Z三个视野观察突触前末梢和突触后神经元是否真正连接,从而排除了普通光镜下突触前末梢和突触后神经元假阳性连接被计数的情况[9]。与 TEM方法相比,CLSM方法所需的组织处理,切片染色等环节步骤简易,并可实现对突触前末梢、突触后神经元的双标记,因而可以实现对突触的分布情况的进行空间定量观察。所以,CLSM方法填补了普通光镜和电镜之间的空缺。此外,在CLSM方法中可利用多重荧光标记不同种类的突触前末梢,从而可以同时观察多种突触在同一神经元空间分布特点,为全面理解神经元信息分析整合机制奠定形态学基础。
[1]Fujiyama F,Unzai T,Nakamura K.et al.Difference in organization of corticostriatal and thalamostriatal synapses between patch and matrix compartments of rat neostriatum.Eur J Neurosci,2006,224:6483-6492
[2]Peters A.The fine structure of the nervous system:The Cells and Their Processes.New York:Oxford University Press,1991,140-168
[3]Oginsky MF,Rodgers EW,Clark MC,et al.D(2)receptors receive paracrine neurotransmission and are consistently targeted to a subset of synaptic structures in an identified neuron of the crustacean stomatogastric nervous system.J Comp Neurol,2010,518(3):255-76
[4]Tsumori T,Yokota S,Ono K,et al.Synaptic organization of GABAergic projections from the substantia nigra pars reticulata and the reticular thalamic nucleus to the parafascicular thalamic nucleus in the rat.Brain Res,2002,957(2):231-41
[5]Kawaguchi Y.Neostriatal cell subtypes and their functional roles.Neurosci Res,1997,27:1-8
[6]Van-Haeften T,Wouterlood FG.Neuroanatomical tracing at high resolution.J Neurosci Meth,2000,103:107-116
[7]Vinkenoog M,van den Oever MC,Uylings HB,et al.Random or selective neuroanatomical connectivity.Study of the distribution of fibers over two populations of identified interneurons in cerebral cortex.Brain Res Brain Res Protoc,2005,14(2):67-76
[8]Salin P,Castle M,Kachidian P.et al.High-resolution neuroanatomical tract-tracing for the analysis of striatal microcircuits.Brain Res,2008,1221:49-58
[9]Cabirol-Pol MJ,Mizrahi A,Simmers J,et al.Combining laser scanning confocal microscopy and electron microscopy to determine sites of synaptic contact between two identified neurons.J Neurosci Meth,2000,9:175-181
Comparative study on glutamatergic synaptic connections in rat str iatum with laser scanning confocal microscopy and electron microscopy
Cai Qing,Ji Man,Zhang Jinlu*,Zhao Junpeng*
(Medical Center f or Ex periment and Test,Capital Medical University,Beijing 100069,China)
Objective To evaluate the advantage of the use of laser scanning confocal microscopy(LSCM)for observing the glutamatergic striatal synaptic connections in comparison with the observation with transmission electron microscopy(TEM).Methods 12 normal adult rats were divided into two groups:6 ratsfor LSCM or TEM each.With CM-DiIand V Glu T1 immunofluorescence labeling,the distribution of the asymmetrical glutamatergic synaptic connections on the dendrites of striatal neurons was observed,and 3-D reconstruction was done.The 6 rats were studied with TEM.Results There is no significant difference in the distribution characters of the glutamatergic striatal synaptic connections obtained with either LSCM or TEM.However,the whole view of the synapses and dendrites and the three-dimensional reconstruction of synaptic connections between neurons can be obtained with LSCM but not TEM.Conclusion LSCM is an effective and quantitative technique to investigate the glutamate synaptic connections of striatal neurons.
Confocal laser microscopy; Transmission electron microscopy; Immunofluorescence staining; Synaptic connections
R322.811
A
10.3870/zgzzhx.2011.03.007
2011-01-14
2011-03-31
北京市自然基金资助项目资助(7062008)
蔡青,女(1960年),汉族,实验师。
*通讯作者(To whom correspondence should be addressed)
