慢性复合应激对成年海马FGF-2的表达及神经发生的影响
2011-12-15肖娟娟王秋桂张敏海
肖娟娟 王秋桂 张敏海
慢性复合应激对成年海马FGF-2的表达及神经发生的影响
肖娟娟1*王秋桂1张敏海2
(1咸宁学院基础医学院组织与胚胎学教研室,湖北437100;2华中科技大学同济医学院解剖学系组织与胚胎学教研室,武汉430030)
目的 通过观察慢性复合应激后大鼠海马FGF-2表达的变化,来探讨慢性复合应激对FGF-2表达的影响及其与海马神经发生的联系。方法 成年雄性大鼠随机分为复合应激组和正常对照组。复合应激组动物每天交替无规律暴露于复合应激原中达6周。然后运用免疫组织化学方法、Western-blot和RT-PCR技术观察海马 FGF-2表达的变化。结果 慢性复合应激组动物海马FGF-2阳性细胞的表达量增多(P<0.05);海马FGF-2蛋白的表达明显增加(P<0.05);海马FGF-2 mRNA水平明显上调(P<0.05)。结论 慢性复合应激可引起海马FGF-2阳性细胞表达量增加和FGF-2表达水平升高,提示应激后内源性FGF-2的表达增高可能是慢性复合应激促海马神经发生的因素之一。
慢性复合应激; 海马; FGF-2; 神经发生; 大鼠
FGF-2,又名bFGF,碱性成纤维细胞生长因子,是由146个氨基酸组成的单链多肽,能促进神经干细胞或前体细胞有丝分裂并具有神经营养作用,而且能促神经前体细胞向神经元方向分化[1-3]。有报道[4]认为FGF-2参予了成年海马神经发生,外源性FGF-2还能促进神经元的存活和轴突的生长。本室在前期实验中多次证实慢性复合应激促进成年大鼠海马神经发生[5,6],因此本实验采用4种应激模型,对动物进行长达6周的无规律间歇式复合应激,然后采用免疫组织化学方法、Western-blot和RT-PCR技术分别对应激后大鼠海马结构内源性FGF-2蛋白的表达和FGF-2 mRNA转录水平进行测定,旨在通过研究慢性复合应激后海马结构内FGF-2蛋白及其mRNA的表达变化来探讨慢性复合应激促进神经发生的可能机制。
材料和方法
1.动物分组及模型制备
成年雄性Wistar大鼠(湖北中医学院实验动物中心提供)32只,体重150-200g。将动物随机分为2组:(1)正常对照组(n=16;简称对照组);(2)慢性复合应激组(n=16;简称应激组)。两组动物常规摄食饮水,动物饲养室温度为18-22℃,光暗周期为12/12h。应激组动物每天随机暴露于垂直旋转(持续25-40s/间隔4-7min)、睡眠剥夺、捆绑、及夜间光照(持续4-7min/间隔12-20min)等4种应激原中达6周,其中前3项于白天进行,每天持续6 h;后者在晚间进行,光照呈无规律、间歇式。
2.FGF-2免疫细胞化学染色反应
应激组和对照组大鼠各8只,7%水合氯醛麻醉,经常规灌流固定,取脑并修取含海马脑段,常规脱水,透明,石蜡包埋,冠状连续切片,片厚5um,每个动物均依次等距离间隔选取切片,共取8张,进行免疫细胞化学染色。所用主要试剂:兔抗FGF-2多克隆抗体(1:100,Santa Cruz公司);链霉菌抗生物素蛋白-过氧化物酶(streptavidin-peroxidase complex,S-P)即用型试剂盒(北京中山试剂公司)。用1%抗体稀释液替代兔抗FGF-2多克隆抗体进行阴性对照,反应呈阴性。在O-lympus显微镜高倍镜下,利用Image-Pro Plus Version 5.0彩色图像分析系统分析FGF-2阳性细胞的平均面积计数密度(简称面密度N),并测定阳性细胞的平均光密度(OD)。
3.海马总蛋白提取与Western-blot的测定
应激组和对照组大鼠各8只,大鼠快速断头,取出脑组织并分离左侧海马:(1)提取海马总蛋白并用BCA法进行蛋白定量,其蛋白含量在5-8mg/ml之间。(2)SDS-PAGE电泳:配制12%分离胶和5%浓缩胶,每孔加样 20ul,电压 110V进行电泳。(3)转膜:恒流275mA。(4)抗原抗体反应及DAB/H2O2显色,主要试剂为兔抗FGF-2多克隆抗体(1∶200),小鼠抗 GAPDH单克隆抗体(1∶5000,上海康成生物工程有限公司),HRP标记的羊抗兔Ig G、羊抗小鼠Ig G(1∶5000,北京中山试剂公司)。应用Image-Pro Plus Version 5.0软件,以目的条带FGF-2与内参照 GAPDH的平均光密度比值表示FGF-2蛋白水平,进行半定量分析。
4.海马组织总RNA的提取与RT-PCR的测定
应激组和对照组大鼠各8只,大鼠快速断头,取出脑组织并分离右侧海马:(1)海马总RNA的提取和鉴定。按RNA抽提试剂盒RNArose Reagent(上海华舜生物工程有限公司)步骤提取RNA。紫外分光光度计(UV-300,德国 Eppendorf AG)检测 OD260/OD280在1.8-2.0之间,提取RNA:纯度符合实验要求。(2)逆转录反应:反应总体系40μl,含有样品 RNA25μl。70℃孵育 5min,立即冰水浴,加入 M-MLV(100U/μl,Promega,USA)2μl,37℃温浴90 min,90℃孵育5min终止反应,冰上冷却。合成的cDNA进行PCR扩增反应。(3)PCR扩增反应:FGF-2及 GAPDH引物均根据GenBank登录的大鼠目的基因cDNA序列,由上海Invitrogen公司合成。具体如下:上游引物 5’-CAGCTCCAAGCAGAAGAGAGA-3’;下游引物 5’-TGCCCAGTTCGTTTCAGT-3’,扩增产物大小为 209 bp。内参照GAPDH:上游引物 5’-CCC ACG GCA AGT TCA ACG G-3’;下游引物 5’-CTT TCCAGA GGG GCCATC CA-3’,扩增产物大小为428bp。PCR扩增反应体系:反应总体系 25?l,含有 cDNA 2μl,dNTP 1μl,10 ×buffer 2.5μl,MgCl2 1.5μl,Taq酶(购自北京 TIANGEN公司)0.5μl,上下游引物各1μl,DEPC水 16μl。PCR 反应条件:94℃预变性5 min,94℃变性45sec,62℃退火30sec,72℃延伸 45sec,共31个循环,最后 72℃延伸 8min。(4)PCR产物测定及分析:PCR扩增产物用2%琼脂糖凝胶进行电泳,运用凝胶成像系统(复日 Smartview2001生物电泳图像分析系统S/N:SV-0002202)对条带进行吸光光度值分析。以目的基因FGF-2与内参照GAPDH的平均光密度的比值表示FGF-2 mRNA水平,进行半定量分析。
5.统计学处理
应用SPSS统计分析软件对数据进行统计分析,数据都用均值±标准差(mean±SD)表示,P<0.05为差异具有统计学意义。
结 果
1.免疫组织化学方法显示慢性复合应激后海马结构中FGF-2的表达
FGF-2染色阳性细胞散在分布于对照组和应激组海马结构中,CA1,CA3,齿状回及其门区可见较多染成棕黄色的细胞,CA2区可见神经元胞核染色较深呈圆形或椭圆形。成年海马的神经发生存在于齿状回的颗粒下区,所以我们选择齿状回及其门区的阳性细胞进行平均光密度(OD)分析,并且对单位面积下的阳性细胞数目即面密度N(个/平方毫米)进行比较。与对照组相比,应激组齿状回及其门区FGF-2阳性细胞染色加深,其平均光密度提高,有统计学意义(P<0.05),但二者面密度无明显改变(P>0.05)(图1,表1)。

图1 对照组(A.B)和应激组(C.D)大鼠海马齿状回及其门区阳性细胞的分布。SP法 (×100,DG齿状回,Hi门区)Fig.1 The expression of FGF-2 in the dentate gyrus and the hilusof the dentate gyrus between the control group(A.B)and the stressed group(C.D).(×100)
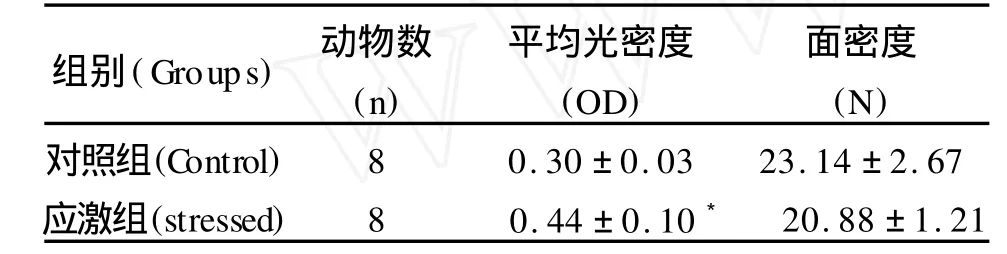
表1 齿状回及其门区FGF-2阳性细胞的平均光密度及面密度(mean±SD)Table 1 The immunohistochemical reaction in the dentate gyrus and the hilusof the dentate gyrus(mean±SD)
2.Western-blot分析慢性复合应激对海马组织FGF-2蛋白表达水平的影响
FGF-2和 GAPDH的分子量分别为17KD和36KD,条带清晰。以 GAPDH的平均光密度值作为内参照,对各组条带的平均光密度值进行校正,进行半定量分析。与对照组相比,应激组动物海马FGF-2蛋白水平明显上调(P<0.05)(图2,表2)。

图2 Western blotting检测对照组(泳道1)和应激组(泳道2)大鼠海马 FGF-2蛋白水平。Fig.2 Thelevelsof FGF-2 protein in the rat hippocampus of control group(lane 1)and stressed group(lane 2)by Western blotting.

表2 海马FGF-2蛋白的表达水平(mean±SD)Table 2 Expression levels of FGF-2 in hippocampus(mean±SD)
3.RT-PCR分析慢性复合应激对海马组织FGF-2 mRNA水平的影响
FGF-2和 GADPH mRNA扩增的片断长度分别为209bp和428bp,条带清晰,无杂带出现。以GADPH的平均光密度值作为内参照,对各组条带的平均光密度值进行校正,进行半定量分析。与对照组相比,应激组动物海马 FGF-2 mRNA水平明显上调(P<0.05)(图3,表3)。
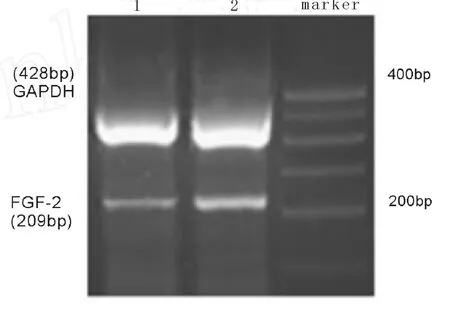
图3 RT-PCR检测对照组(泳道1)和应激组(泳道2)大鼠海马FGF-2 mRNA水平。Fig.3 The levelsof FGF-2 mRNA in the rat hippocampus of control group(lane 1)and stressed group(lane 2).RTPCR

表3 FGF-2 mRNA在海马中转录水平的分析结果(mean±SD)Table 3 Level of FGF-2 mRNA in the hippocampus(mean±SD)
讨 论
1.慢性复合应激促神经发生
许多研究表明成年海马齿状回存在神经发生[7,8],成年脑区神经发生的部位主要局限于海马齿状回和环绕侧脑室的室管膜下层。海马齿状回的神经干细胞位于海马门区与颗粒细胞层间的下颗粒带(SGZ),其终身保持着增殖分化的能力,新生成的神经元从门区移入颗粒层,接受内嗅区突触传入冲动,通过苔状纤维通路与CA3区形成突触联系,整合到海马功能的神经环路中。成年大鼠的DG区每天可生成数千个新神经元,随着年龄的增加,其神经发生的能力随之下降。这些成年神经干细胞受到包括应激在内的多种因素的调控。许多研究表明单一应激会抑制海马神经发生,使依赖海马的空间学习记忆能力发生障碍[9,10]另有研究显示,丰富的环境促进海马齿状回前体细胞的增殖,可以拮抗年龄或脑损伤引起的神经可塑性的降低,改善脑功能[11]。我室采用慢性复合应激模型,改善了动物应激的条件,使其在丰富多变的环境下接受挑战。多次研究证实:慢性复合应激促进海马齿状回神经发生[5,6],应激后动物空间学习记忆能力提高[12-14]。
2.慢性复合应激促进FGF-2的表达
FGF-2是一种重要的促有丝分裂剂,广泛存在于中枢及外周神经系统,在脑内主要由星形胶质细胞表达,存在于星形胶质细胞的胞质和胞核内。海马CA2区的锥体神经元和纹状体的多巴胺能神经元也存在FGF-2[15]。本实验用免疫组织化学方法观察到FGF-2在脑内广泛表达,而成年海马神经发生主要位于齿状回,所以我们对齿状回及其门区FGF-2免疫反应阳性细胞进行分析得出,慢性复合应激后细胞表达FGF-2的量增加而免疫反应阳性细胞数目并无增加。Western-blot和 RT-PCR技术也分别得到,应激后海马 FGF-2蛋白及mRNA水平提高。提示慢性复合应激促进海马 FGF-2的表达可能是促进细胞内FGF-2mRNA的合成及蛋白表达,并未增加表达FGF-2的细胞数。
3.FGF-2促进神经发生
据文献报道,内源性或外源性FGF-2都对海马神经发生有一定的促进作用[16,17]。局部的细胞和分子微环境也会影响海马内多潜能神经前体细胞在不同的条件下选择不同的命运,FGF-2的增加是其影响因素之一。Palmer等[18]将取自成年脑内能产生胶质细胞的部位如脑室下区和海马齿状回的神经干细胞,在体外培养中加入 FGF-2后能诱导产生更多的神经元,发现FGF-2不仅可以起到有丝分裂原的作用还能促进细胞向神经元的方向分化。
我们推测FGF-2的表达增加是慢性复合应激促进神经发生的机制之一。FGF-2可能通过两条信号传导途径发挥生理作用,一是经受体--胞浆激酶链入核,启动靶基因转录;另一经细胞内吞--胞浆转运结构--核孔复合体入核作用于靶基因,调节神经细胞的增殖、迁移和分化[19]。而 FGF-2又是通过何种途径促进神经发生的?其一,FGF-2通过两条信号传导途径直接作用于SGZ神经前体细胞,促进神经前体细胞增殖迁移分化为神经元。其二,Doetsch F等发现在成年哺乳动物室管膜下区的星型胶质细胞显示出神经干细胞的特性[20],Seri B也发现星形胶质细胞可生成新的神经细胞[21],同时星形胶质细胞还能促进神经干细胞的增殖,并诱导成年干细胞向神经细胞分化[22]。而 FGF-2主要在星型胶质细胞中表达,应激后表达增加,提示FGF-2可能促进星型胶质细胞有丝分裂产生新的神经元。其三,Yamashima T等人研究证实脑缺血后海马SGZ增殖的神经前体细胞大部分起源于毛细血管的周细胞和/或动脉外膜细胞[23],FGF-2可能同时也促进毛细血管的周细胞和/或动脉外膜细胞分裂产生神经前体细胞进而分化为神经元。
成年海马神经发生的影响因素很多,慢性复合应激增强FGF-2的表达,从而促进神经发生只是其中之一,慢性复合应激后BDNF表达也有增加[24],FGF-2与BDNF及其它因子的协同作用还有待进一步研究。
[1]Richards LJ,Kilpatrick TJ,Bartlett PF.De novo generation of neuronal cells from the adult mouse brain.Proc Natl Acad Sci USA,1992,89:8591-8595
[2]Yoshimura S,Takagi Y,Harada J,et al.FGF-2 regulation of neurogenesis in adult hippocampus after brain injury.Proc Natl Acad Sci USA,2001,98(10):5874-5879
[3]Palmer TD,Markakis EA,Willhoite AR,et al.Fibroblast growth factor-2 activates a latent neurogenic program in neural stem cells f rom diverse regions of the adult CNS.J Neurosci,1999,19:8487-8497
[4]Abe K,Saito H.Effects of basic fibroblast growth factor on central nervous system functions.Pharmacol Res,2001,43(4):307-312
[5]周艳玲,刘能保,张敏海,等.慢性复合应激对大鼠学习和记忆功能及齿状回神经前体细胞增殖的影响.神经解剖学杂志,2006,22(4):441-444
[6]周艳玲,刘能保,张敏海,等.慢性复合应激增强大鼠海马Doublecortin的表达.解剖学报,2007,38(1):18-22
[7]Gould E,Mc Ewen BS,Tanapat P,et al.Neurogenesis in the dentate gyrus of the adult tree shrew is regulated by psychosocial stress and NMDA receptor activation.J Neurosci,1997 Apr 1,17(7):2492-2498
[8]Altman J,Das GD.Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats.J Comp Neurol,1965 Jun,124(3):319-335
[9]Ohl F,Fuchs E.Differential effects of chronic stress on memory processes in the tree shrew.Brain Res,Cogn Brain Res,1999,7(3):379-387
[10]Bartolomucci A,Biurrun G,Czeh,et al.Selective enhancement of spatial learning under chronic psychosocial stress.Eur J Neuroscience,2002,15(11):1863-1866
[11]Kempermann G,Kuhn HG,Gage FH.More hippocampal neurons in adult mice living in an enriched environment.Nature,1997 Apr 3,386(6624):493-495
[12]刘能保,李辉,刘向前等.慢性复合应激增强大鼠空间学习和记忆能力.生理学报,2004,56(5):615-619
[13]李晓恒,刘能保,张敏海等.慢性复合应激性学习记忆增强大鼠海马神经细胞增殖和突触后致密物Fyn表达的变化.解剖学报,2005,36(6):591-596
[14]洪小平,刘能保,张敏海等.慢性复合应激对大鼠学习和记忆功能及海马内 PKA-Cβ表达的影响.华中科技大学学报(医学版),2005,34(3):257-261
[15]朱长庚.神经解剖学.第1版,北京:人民卫生出版社,2002年3月,380
[16]Miller D L,Ortega S,Bashayan O,et al.Compensation by fibroblast growth factor 1(FGF1)does not account for the mild phenotypic defects observed in FGF2 null mice.Mol Cell Biol,2000,20(6):2260-2268
[17]Wagner JP,Black IB,Dicicco-Bloom E.Stimulation of neonatal and adult brain neurogenesis by subcutaneous injection of basic fibroblast growth factor.J Neurosci,1999,19:6006-6016
[18]Palmer TD,Markakis EA,Willhoite AR,et al.Fibroblast growth factor-2 activates a latent neurogenic program in neural stem cellsf rom diverse regionsof the adult CNS.J Neurosci,1999,19:8487-8497
[19]王廷华,冯忠堂.多肽生长因子与脊髓损伤.新疆:新疆科技卫生出版社,2003,51-86
[20]Doetsch F,Caille I,Lim DA,et al.Subventricular zone astrocytes are neural stem cells in the adult mammalian brain.Cell,1999,97:703-716
[21]Seri B,Garcia-Verdugo JM,Mc Ewen BS,et al.Astrocytes give rise to new neurons in the adult mammalian hippocampus.J Neurosci,2001,21(18):7153-7160
[22]Song H,Stevens CF,Gage FH.Astroglia induce neurogenesis from adult neural stem cells.Nature,2002,417(6884):39-44
[23]Yamashima T,Tonchev AB,Vachkov IH et al.Vascula adventitia generates neuronal progenitors in the monkey hippocampus after ischemia.Hippocampus,2004,14:861-875
[24]Li X,Liu N,Zhang M et al.Effects of chronic multiple stresson learning and memory and the expression of Fyn,BDNF,TrkB in the hippocampus of rats.Chinese Medical Journal,2007,120(8):669-674
Expression of FGF-2 in rat hippocampusafter chronic multiple stressand its effect on neurogenesis
Xiao Juanjuan1*,Wang Qiugui1,Zhang Minhai2
(1Department of Histology and Embryology,Medical School,Xianning University,Hubei 437100;2Department of Histology and Embryology Tongji Medical School,Huazhong University of Science and Technology,Wuhan 430030,China)
Objective To explore the relationship of FGF-2 with hippocampal neurogenesis by observing the effect of chronic multiple stresson the expression of FGF-2 in the hippocampus of rats.Methods Adult male Wistar rats were randomly divided into two groups:the multiple stressed group and the control group.Rats in the multiple stressed group were irregularly and alternatively exposed to the chronic multiple stressfor 6 weeks.Then the expression of FGF-2 immunoreactive positive cells in the hippocampus of ratsof two groups were compared by using immunohistochemisery,and the expressionsof FGF-2 protein and mRNA in the hippocampusof rats were assayed by using Western-blot and RT-PCR respectively.Results(1)The expression of FGF-2 immunoreactive cells in the hippocampusof the multiple stressed rats was significantly higher than in the control group(P<0.05);(2)The protein and mRNA levelsof FGF-2 in,the hippocampus of the multiple stressed rats were remarkably higher than those of the control group(P<0.05).Conclusion The enhanced expression of FGF-2 in the hippocampus may be induced by the chronic multiple stress,and it implies that endogenous FGF-2 may play a rolein facilitating hippocampal neurogenesis in stressed rats.
Chronic multiple-stress; Hippocampus; FGF-2; Neurogenesis; Rat
R322.811
A
10.3870/zgzzhx.2011.03.016
2011-01-06
2011-03-22
咸宁学院校级基金资助(KY0876)
肖娟娟,女(1983年),汉族,助教。
*通讯作者(To whom correspondence should be addressed)
