配合物的统一轨道场理论与应用研究 *
2011-12-12王成云
王成云
(潍坊学院,山东 潍坊 261061)
配合物的统一轨道场理论与应用研究*
王成云
(潍坊学院,山东 潍坊 261061)
将配合物的价键理论、晶体场理论和分子轨道理论有机地结合在一起,提出了研究配合物结构的新理论—统一轨道场理论,应用该理论能更好的研究配合物的结构,更全面地解释、预测配合物的光谱性、磁性、稳定性、空间构型及构型畸变等性质。
配合物;统一轨道场;价键理论;晶体场理论;分子轨道理论
目前研究配合物结构与性质的三个著名理论[1]是价键理论、晶体场理论和分子轨道论。由于价键理论、晶体场理论和分子轨道理论从不同的角度研究配合物的结构与性质,因此各个理论有着明显的优点和缺陷[3]。价键理论认为,中心离子与配体形成配合物时,中心离子以空的杂化轨道接受配体的孤对电子形成σ配位键。该理论考虑到了中心离子与配体之间的价层轨道的相互作用,但没有考虑中心离子与配体之间的静电作用及产生的结果,该理论本身存在问题。因此价键理论不能解释配合物的光谱性、光谱化学序列、构型畸变及化学活性等一系列问题。晶体场理论只考虑中心离子与配体间的静电吸引与排斥作用,完全忽略了中心离子与配体间的轨道相互作用,这与现代轨道理论不符,显然是片面的,不合理的,理论本身不完善。因此晶体场理论不能解释配合物的光谱化学序列、有机烯炔配合物、羰基配合物、分子氮配合物、夹心型配合物及零价和负价金属配合物[4]。配合物的分子轨道理论,是将中心原子的纯原子轨道作为基函数与配体的电子轨道进行线性组合,得到配合物的分子轨道及能级图。电子进入分子轨道,形成配位化学键,生成配合物。配合物的分子轨道理论考虑了电子轨道之间的相互作用,但没有考虑中心离子与配体之间的静电作用,因此理论本身也不完善。结果不能解释配合物几何结构的畸变现象、配合物的化学活性等问题。为了更好地在理论上研究各种配合物的几何结构、电子结构、性质及用途。有效地解释和推测配合物结构和性质。因此有必要研究提出新的理论。
1 统一轨道理论
配合物的中心离子(或原子)采取外轨道杂化,形成的空杂化轨道与配体的含有孤对电子的σ型轨道组合成分子轨道,配体的孤对电子进入成键分子轨道,形成共价配位化学键。由于键合在一起的中心离子(或原子)和配体之间存有静电作用,使中心离子的内轨道(n-1)d能级分裂。若配体中含有∏型轨道(如F-、C1-、Br-、I-、CN-、CO、等),它将与中心离子的对称性匹配的∏型(n-1)d轨道发生重叠作用,组合成∏型分子轨道。由此得到的配合物的新轨道能级图,称为配合物的统一场轨道能级图。有了该图就可以全面解释和预测配合物的结构及性质。
1.1 配合物的几何结构与杂化轨道
在形成配合物中,中心离子(或原子)的ns、np和nd杂化,形成空的外轨杂化轨道与配体的占有孤对电子的原子轨道(如F-、C1-、Br-、I-等)或者杂化轨道(如NH3、H2O等)在最大重叠方向上进行线性组合,即

中心离子的n个杂化轨道与配体的n个轨道组合成n个成键MO和n个反键MO。配体的孤对电子进入能量低的成键MO,形成共价σ配位键,对配合物的稳定性、平衡几何构型起重要作用。对于羰基配合物、分子氮配合物等尤为重要。由于中心离子采取杂化轨道与周围配体成键,因此配合物的几何构型主要取决于中心离子的杂化轨道。例如:sp3d2-八面体构型、sp3-四面体构型、sp2d-平面正方型等等。
1.2 中心离子(n-1)d轨道能级分裂
配体σ孤对电子进入成键MO,在中心离子与配体间形成了共价配位键,使中心离子周围占据了外来的带负电荷的电子对或配体的负电荷,必然与中心离子的(n-1)d价层电子发生强烈的静电作用。由于d轨道最大伸展方向与配体的相对位置不同,静电作用不同,因此使(n-1)d轨道能级分裂,有的能级升高,有的能级降低,消除了(n-1)d轨道的简并性。通过以上两点表明,中心离子与配体之间的作用力有轨道作用和静电作用。通过中心离子的空的外轨杂化轨道与配体的含孤对电子的轨道相互作用形成共价配位键,而静电相互作用使内轨(n-1)d轨道能级分裂。
1.3 配合物统一轨道场能级图
按照上述观点,可以得到配合物统一场轨道能级图,能级图对研究配合物的结构及结构与性质的关系是至关重要的。
1.3.1 正八面体统一轨道场能级图
根据对中心离子的原子轨道与配体提供的σ型轨道进行对称性分析,中心离子的ndx2-y2、ndz2和ns、npx、npy、pz等6个原子轨道与6个配体的σ轨道对称性匹配[5],这6个原子轨道杂化,形成6个空的杂化轨道sp3d2。中心离子的ndxy、ndxz和ndyz与配体的σ轨道对称性不匹配,是不参与杂化的。中心离子的6个sp3d2空的杂化轨道在最大伸展方向上与6个配体σ轨道对称性匹配,最大重叠组合成6个σ成键MO和6个σ*反键MO,同时由于中心离子与配体的静电作用使(n-1)d轨道能级分裂。(n-1)dx2-y2和(n-1)dz2的最大伸展方向与配体迎头相碰,能级升高,而dxy、dxz和dyz的极值在配体之间能级下降。同时考虑到中心离子与配体间的轨道重叠作用和静电作用两方面因素,所形成的八面体统一轨道场能级图见图1。
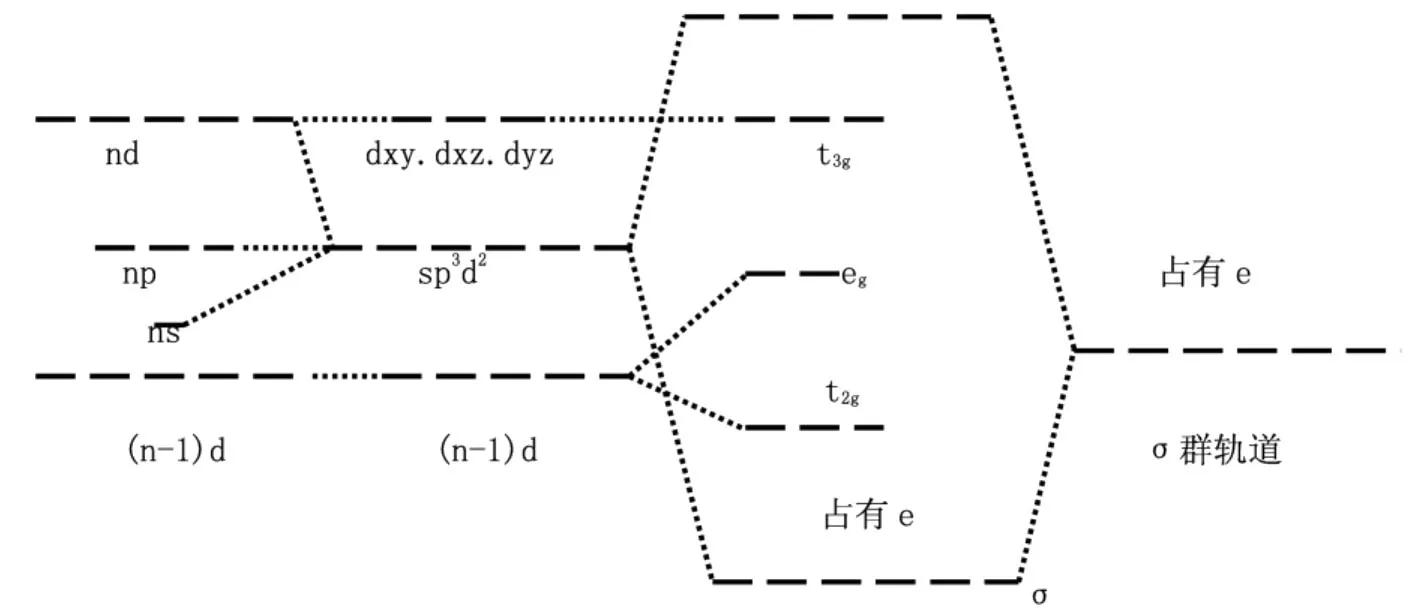
图1 八面体统一轨道能场能级图
1.3.2 正四面体统一轨道场能级图
在正四面体配合物中,中心离子采取sp3杂化轨道,4个空的sp3杂化轨道与4个配体的σ成键轨道组合成4个σ成键MO和4个σ*反键MO,配体提供4对孤对电子进入4个σ成键轨道,形成4个σ配位键。中心离子的(n-1)d轨道在配体的静电作用下,能级发生分裂,dxy、dxz和dyz能级升高,dx2-y2、dz2能级降低,其统一轨道场能级图见图2。

图2 正四面体统一轨道场能级图
1.3.3 平面正方形统一轨道场能级图
平面正方形配合物也是常遇到的一类配合物,在这类配合物中,配体位于±x、±y轴上,中心离子在中心位置。根据轨道对称性分析,中心离子的s、px、py和dx2-y2杂化,形成4个空的sp2d杂化轨道,这4个sp2d杂化轨道与4个配体的σ轨道组合成4个σ成键MO和4个σ*反键MO。4个配体提供4对孤对电子进入4个σ成键MO,形成4个配位键。中心原子的(n-1)d轨道在配位体的作用下,(n-1)d轨道能级发生分裂,其统一轨道场能级见图3。

图3 平面正方形统一轨道场能级图
1.4 各种配合物的统一轨道场能级
运用杂化轨道理论,分子轨道理论和晶体场理论,根据上述方法,可以得到各种配合物中的σ个成键MO,σ*反键MO及(n-1)d轨道能级分裂的相对值,现将各种配合物的杂化轨道及(n-1)d轨道能级列入表1中。
1.5 统一轨道场中的电子排布
在配合物中,有σ成键MO和σ*反键MO,(n-1)d轨道能级又进行了分裂。不同构型配合物的统一场轨道能级图不同。电子是如何排布在这些轨道上的,配体的σ孤对电子进入σ成键MO,在中心离子和配体间形成σ配位共价键。中心离子(n-1)d轨道上的电子进入分裂的d轨道,强场配合物(△>p),电子优先占满低能级d轨道,再向高能级(n-1)d轨道排布。对于弱场配合物(△<p),电子尽可能分布不同的分裂d轨道上。
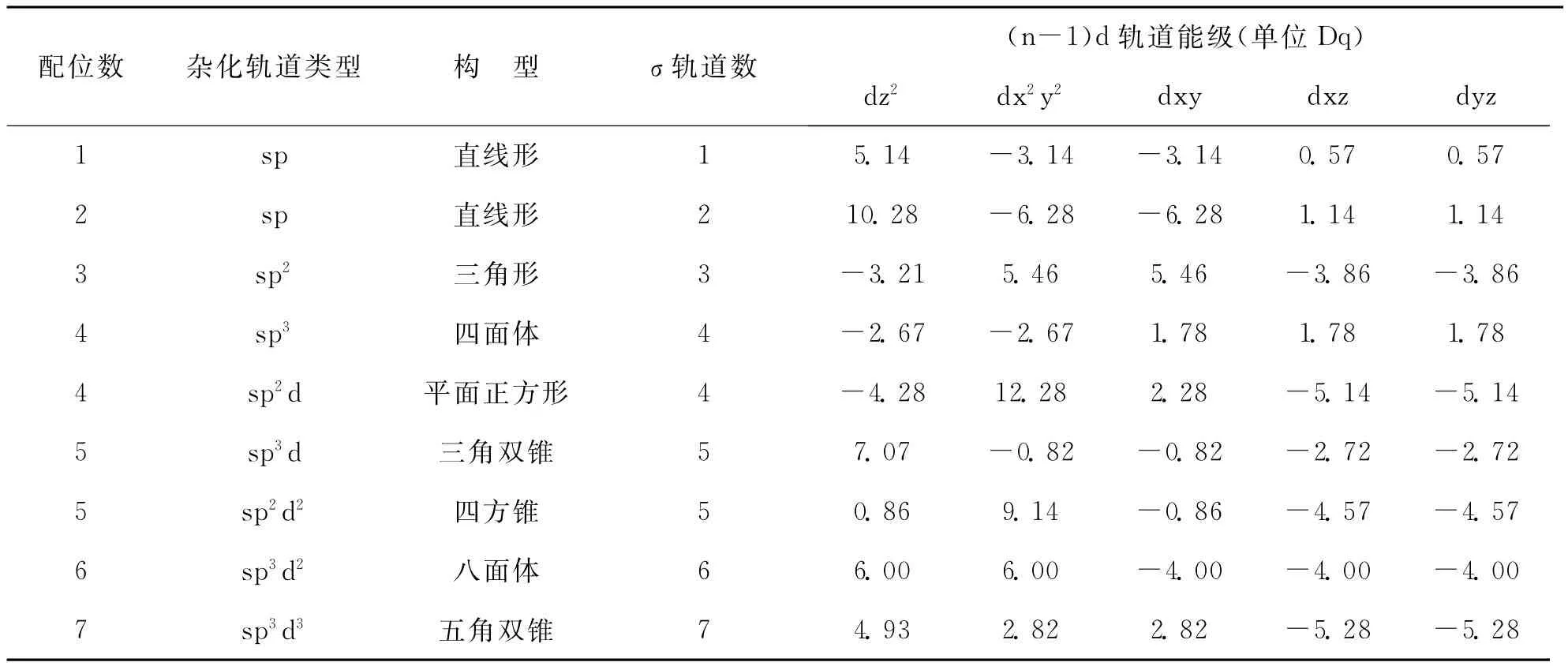
表1 统一场中的杂化轨道与(n-1)d轨道能级
1.6 八面体配合物的统一轨道场σ、∏能级图
配体结构类型不同,统一场轨道能级图不同,对于F-、C1-、Br-、I-、CN-、CO、等配体,分子中除含有σ孤对电子轨道还有∏型轨道。当∏轨道与中心离子的(n-1)d轨道对称性匹配时,就组合成∏型分子轨道。下面以常见的八面体配合物为例,构建统一场轨道能级图。一般有三类,第一类配体为NH3、H2O等,分子中只含有σ孤对电子对,无∏型轨道,称为σ配体。这类配合物所服从的统一场轨道能级图见图1所示。第二类配体为F-、C1-、Br-、I-、等,除含有σ孤对电子对还含有∏电子对,称成为σ、∏配体。这类配合物所服从的统一轨道场能级图见图4。
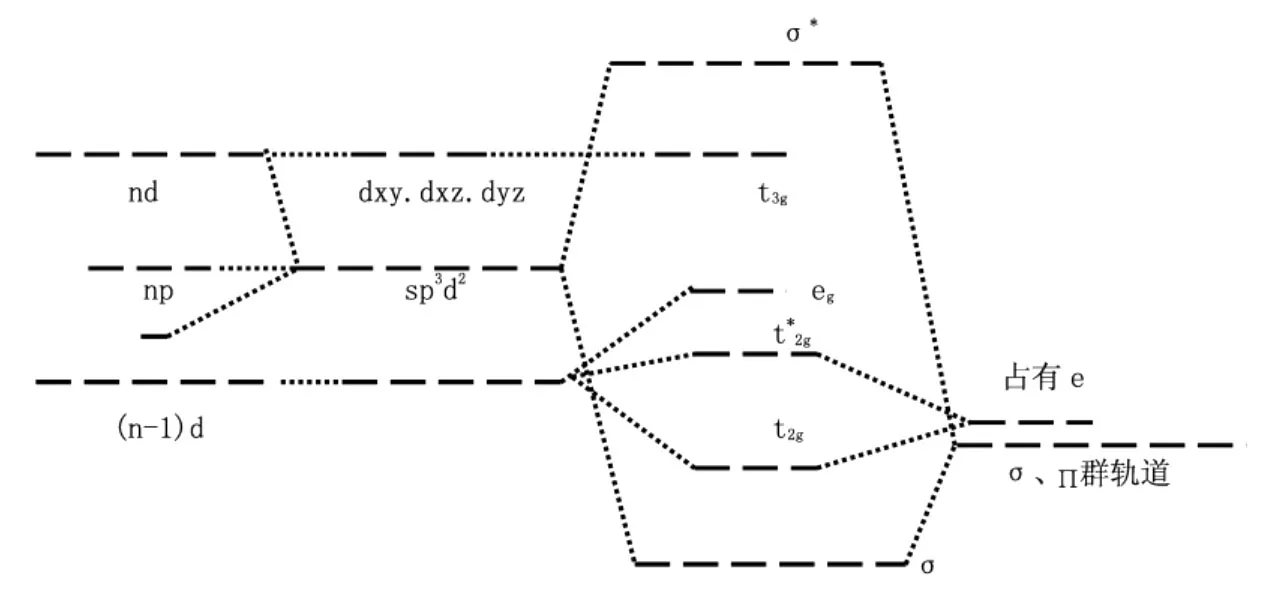
图4 八面体统一轨道场σ、∏能级图
在图4中,中心原子的t2g轨道与配体的∏型轨道对称性匹配,可组合成3个成键分子轨道和3个反键分子轨道,分裂能变小了。配体的18个电子,其中12个电子进入6个σ轨道,生成6个σ配键,其余6个电子进入3个成键t2g分子轨道,形成3个∏配键。中心原子的(n-1)d轨道电子分占t*2g和eg轨道,形成弱场高自旋配合物。第三类配合物为CN-、CO等,称为σ、∏*配体。这类八面体配合物所遵从的统一轨道场能级图见图5。

图5 八面体统一轨道场σ、∏(反馈键)能级图
在第三类配合物中,中心原子的t2g轨道与配体的∏*空轨道对称性匹配,可组合成3个∏型成键分子轨道t2g和3个∏型反键分子轨道,分裂能变大了。配体的σ电子对进入成键σ分子轨道,生成σ配位键。中心离子的(n-1)d轨道上的电子优先占满t2g轨道,形成∏反馈键,再去占据eg轨道,形成强场低自旋配合物。
2 应用实例
例1 配合物[Co(NH3)6]3+是八面体配合物,已知(△>P)是强场配合物,根据配合物的统一场理论,可画出[Co(NH3)6]3+的统一轨道场能级图见图6。
在[Co(NH3)6]3+配合物中有6个σ配位键,这是决定配合物稳定性的重要因素,因△>P,(n-1)d电子排布为(t2g)6,统一轨道场稳定化能

可见统一轨道场理论计算的体系稳定化能考虑到了σ配位键的贡献,更接近于分子的真实值。根据[Co(NH3)6]3+的统一轨道场能级图,可解释光谱性,而价键理论无能为力,还可以说明几何结构,磁性等性质。
例2 配合物[Cr(CO)6]是一个强场八面体配合物,其统一轨道场能级见图7。
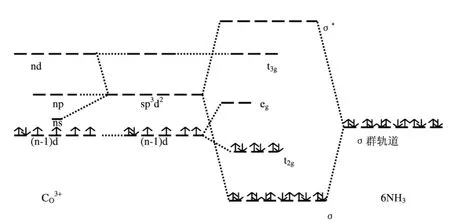
图6 [Co(NH 3)6]3+的八面体统一轨道场能级图

图7 [Cr(CO)6]的统一轨道场能级图
根据[Cr(CO)6]的统一轨道场能级图,在[Cr(CO)6]配合物中,有6个σ配位键和3个反配位键,对配合物的稳定性起决定作用。统一轨道场稳定化能

根据图7可以说明[Cr(CO)6]的光谱性、磁性、稳定性、几何结构及Cr为什么是零价等一系列性质。
3 结束语
配合物的统一轨道场理论将中心离子采取外轨道杂化,所形成的杂化轨道与配体的σ轨道线性组合成分子轨道,形成σ配位键,同时又考虑到了中心离子与配体间的静电作用,使(n-1)d轨道能级分裂,所得的配合物的统一轨道场能级图,在理论上克服了价键理论和晶体场理论各自本身的缺陷,因此在应用中不但可以解释价键理论与晶体场理论各自能解释的配合物性质,而且还可以解释两者不能解释的问题。使用该理论可以更好地研究配合物的结构与性质,如配合物的几何结构、配位键、稳定性、光谱性、磁性及构型畸变等等。对于含有Л型轨道的配体(如F-、Cl-、Br-、I-等)和Л*轨道的配体(如CN-、CO等),可与中心离子的t2g轨道(dxy、dxz、dyz)组合成Л型分子轨道,形成Л配位键和Л反配位键,可解释光谱化学序列,稳定性等性质。统一轨道场理论比配合物的分子轨道理论简便,无需复杂的数学运算,对称性分析,所得到的轨道能级顺序易于判断。同时统一轨道场理论可明确地分析配合物的几何构型,畸变等一系列问题。而配合物的分子轨道理论不能简便地给出空间构型,也不能说明配合物的构型畸变,对于配合物取代反应也不能给出简易的计算方法。由此可见,配合物的统一轨道场理论简便实用,对研究配合物的结构、性质具有一定的参考和应用价值。
[1]周公度.结构化学[M].北京:北京大学出版社,1989.
[2]戴安邦.配位化学[M].北京:科学出版社,1987.
[3]孟庆金,戴安邦.配位化学的创始与现代化[M].北京:高等教育出版社,1998.
[4]孙为银.配位化学[M].北京:化学工业出版社,2004:17-28.
[5]王成云.LCAO中轨道对称性匹配的两种判别方法[J].化学通报,2000,63(6):59-62.
[6]王成云.配位化学[M].北京:中国环境科学出版社,1996.
(责任编辑:刘乃生)
Study of Theory and Application of Unification Orbtai Field about Coorination Compounds
WANG Cheng-yun
(Weifang University,Weifang 261061,China)
Combineing the valence bond theory with the crystal field theory and molecular orbital theorf of complexes,the unification field theory to research the structure of complexes is put forward.And this theory is better for a research the strucrure of complexes,explain and predict more completely about the properties of spectrum,magnetism,stability,space configuration and configurationall mutation.
complex compound unification field theory,valence bond theory,crystal field theory,molecular orbital theory
2010—06—10
王成云(1953—),男,山东五莲人,潍坊学院化学化工学院教授。
O64.31 文献标识码:A 文章编号:1671-4288(2011)06-0062-06
