二氧化钛与碳化钨纳米复合材料制备及其对甲醇的电催化氧化活性
2011-12-11胡仙超施斌斌李国华
胡仙超 陈 丹 施斌斌 李国华,3,4,*
(1浙江工业大学化学工程与材料学院,杭州310032;2浙江工业大学分析测试中心,杭州310032;3浙江工业大学绿色化学合成技术国家重点实验室培育基地,杭州310032;4浙江工业大学纳米科学与技术研究中心,杭州310032)
二氧化钛与碳化钨纳米复合材料制备及其对甲醇的电催化氧化活性
胡仙超1,2陈 丹1施斌斌1李国华1,3,4,*
(1浙江工业大学化学工程与材料学院,杭州310032;2浙江工业大学分析测试中心,杭州310032;3浙江工业大学绿色化学合成技术国家重点实验室培育基地,杭州310032;4浙江工业大学纳米科学与技术研究中心,杭州310032)
以市售纳米二氧化钛(TiO2)为载体,六氯化钨为钨源,将浸渍法与原位还原碳化技术相结合制备了核壳结构碳化钨(WC)/TiO2纳米复合材料;应用X射线衍射分析、透射电子显微镜、高分辨扫描透射成像和X射线能量散射谱等手段对样品晶相、形貌、微结构和化学组成等特征进行了表征.结果表明,样品的晶相由金红石型TiO2、Ti4O7、WC、W2C和WxC构成,钨碳化物负载于钛氧化物外表面,构成比较典型的核壳结构.采用三电极体系和循环伏安法测试了样品在碱性溶液中对甲醇的电催化氧化活性,结果表明,相比于纯碳化钨和二氧化钛,复合材料的电催化活性得到了明显的提升.样品电催化活性的提升与前驱体钨钛摩尔比、还原碳化时间、核壳结构壳层的完整性和晶相组成以及核壳结构中二氧化钛和碳化钨之间的协同效应有关.这说明金红石是能够提升碳化钨电催化氧化活性的载体材料之一.
碳化钨;二氧化钛;纳米复合材料;核壳结构;电催化活性
1 引言
自上世纪中叶发现碳化钨(WC)具有类铂的催化性能以来,其制备与应用研究引起了人们广泛关注.1-5因为,WC不仅在有机物的加氢脱氢反应6-8中具有明显的电催化活性,而且还对燃料电池中的氢阳极氧化9,10和甲醇的直接阳极氧化11-14具有良好的电催化活性.在实际应用过程中,人们发现WC的催化性能远不如铂15等贵金属催化剂.因此,如何提高WC的类铂催化活性,是其替代或部分替代铂等贵金属并走向实际应用的关键.
正如上文所述,纯WC的电催化活性远不如铂等贵金属.因此,将WC与其它材料复合就成了提高碳化钨基电催化材料的主要技术途径之一.研究发现,在众多的复合材料载体中,贵金属与二氧化钛(TiO2)载体之间存在“强相互作用”.16这种作用是由于贵金属的被占据d轨道与Ti4+的空d轨道重叠而形成金属—金属键所致.16这一发现促使TiO2在催化领域的应用越来越广泛.受这种“强相互作用”的启发,我们意识到,既然贵金属与二氧化钛之间存在“强相互作用”,碳化钨与铂等贵金属又具有类似的催化活性,那么碳化钨与二氧化钛之间是否也存在“强相互作用”呢?或者说二氧化钛是否也可作为碳化钨的载体,以提升其电催化活性?为探索上述问题的答案,我们课题组17,18以无机材料为载体,将浸渍法与原位还原碳化技术结合制备了碳化钨基复合材料,并报道了其对对硝基苯的电催化性能;还将机械化学法与原位还原碳化技术相结合,制备了晶相组成不同的WC/TiO2纳米复合材料,并报道了其电催化活性.19
虽然上述两条技术途径均成功制备了碳化钨与二氧化钛的复合材料,并证明两者之间在电催化性能方面存在协同效应,但其电催化性能仍然有待提高.因此,本文在分析总结上述技术方法的基础上,将浸渍法与原位还原碳化技术结合,首次以六氯化钨为钨源,市售纳米TiO2为载体,获得了具有核壳结构的WC/TiO2纳米复合材料,报道了影响WC/TiO2纳米复合材料电催化活性的因素.
2 实验部分
2.1 样品制备
按不同的钨(W)/钛(Ti)摩尔比称取适量六氯化钨(WCl6)(中国湖南长沙市华京粉体材料科技有限公司)和二氧化钛(TiO2)(中国广东广州华力森有限公司),在室温下将TiO2分散于酒精溶液中,采用恒温磁力搅拌器(H01-1B型)(中国上海梅颖浦仪器仪表制造有限公司)以600 r·min-1的条件下搅拌2 h,直至两种物相混合均匀,再将WCl6加入到上述液体中,持续搅拌4 h,然后置于干燥箱中80°C干燥,即得前驱体.按上述方法分别制备了W/Ti摩尔比为1: 3、1:1和3:1的三种前驱体.
每次取上述三种前驱体(记为TA)的一种2 g置于石英舟内,然后放置于管式炉中,通入N230 min后切换为H2(纯度≥99.999%)和CH4(纯度≥99.9%)混合气.其中,H2与CH4摩尔比为4:1;在通气体的同时,将管式炉升温到900°C,分别保温2、4、5、6和8 h后,在N2保护下冷至室温,取出后即得不同W/Ti比的复合材料样品,记为TR-a:b-n.其中,a:b为钨钛摩尔比,n为还原碳化时间(h).
2.2 样品表征
采用X射线衍射分析(XRD)、透射电子显微镜(TEM)、高分辨扫描透射成像[即高分辨或原子分辨原子序数Z衬度像(high resolution scanning transmission Z-contrast imaging),也叫做扫描透射电子显微镜高角环形暗场像(STEM)]和X射线能量散射谱(EDS)对样品晶相组成、形貌、微结构和化学组成进行了表征.其中TEM、STEM测试采用Philips CM 200 ultratwin高分辨电镜(附有可分析Ti、C、W和O的X射线EDS设备及液氮温度冷却台).XRD在荷兰PANalytical公司生产的XʹPert PRO型X射线衍射仪上进行,Cu Kα射线源(λ=0.1541 nm),电压40 kV,电流40 mA,步长0.033°,扫描范围10°-80°.样品的物相分析采用仪器自带的分析软件High Score.分析处理过程中,仪器本征宽化的扣除用厂家提供的仪器调试用的多晶硅标准样品.
2.3 粉末微电极的制备
将直径为60µm铂丝一端与导线相连,另一端与玻璃管熔封在一起,将封有铂丝的一端磨平抛光制成铂微盘电极,置于沸腾王水中腐蚀,并测量被腐蚀铂丝的深度,直到腐蚀深度为60µm左右,再将电极置于样品中轻轻挤压,即可制成粉末微电极,其结构详见文献.20
2.4 电化学性能测试
电化学测试使用CHI 620B型电化学工作站(上海辰华仪器公司).测试过程中采用三电极电解池,工作电极为粉末微电极,辅助电极为1 cm2光亮铂电极(自制),参比电极为饱和甘汞电极(SCE).实验测试在298 K下进行.文中所给出电极电位值均相对于SCE,峰电流值已扣除背景电流.
3 结果与讨论
3.1 XRD结果
图1为由W/Ti摩尔比为1:3的前驱体制备的样品XRD图.从图1中可看出,前驱体(TA),即反应时间为0 h的曲线中出现了15个主要衍射峰.其中,2倍衍射角(2θ)为27.47°、36.08°、41.26°、54.32°、56.68°和69.02°的6个衍射峰可归属于金红石型TiO2(PDF:73-2224)的特征衍射峰,2θ为25.32°、37.79°、48.03°、55.06°、62.76°和75.10°的6个衍射峰可归属于锐钛矿型TiO2(PDF:84-1286)的特征衍射峰,2θ为25.7°、34.2°和35.08°的3个衍射峰可归属于WO3(PDF:43-0679)的特征衍射峰.TA经过2 h还原碳化以后,锐钛矿型TiO2的三个特征衍射峰消失,在2θ为26.37°、28.97°和64.30°出现了3个新衍射峰,可归属于Ti4O7(PDF:50-0787)的特征衍射峰.这可能是由于样品在还原碳化反应过程中较薄的WO3壳层未能阻止H2对TiO2核的还原作用,使得TiO2转变成了Ti4O7.锐钛矿的衍射峰消失是由于锐钛矿为TiO2的低温稳定相,在高温条件下会转变成为TiO2的高温稳定相——金红石相.除上述衍射峰外,还可以发现三氧化钨的特征衍射峰也同时消失,取而代之的是在2θ为31.58°、35.72°和48.41°处出现的可归属于WC(PDF:51-0939)的特征衍射峰,在2θ为34.52°、38.03°和39.57°出现了可归属于W2C(PDF:35-0776)的特征衍射峰,以及在2θ为36.85°、62.03°和74.20°处出现了可归属于WxC (PDF:20-1316)的特征衍射峰.
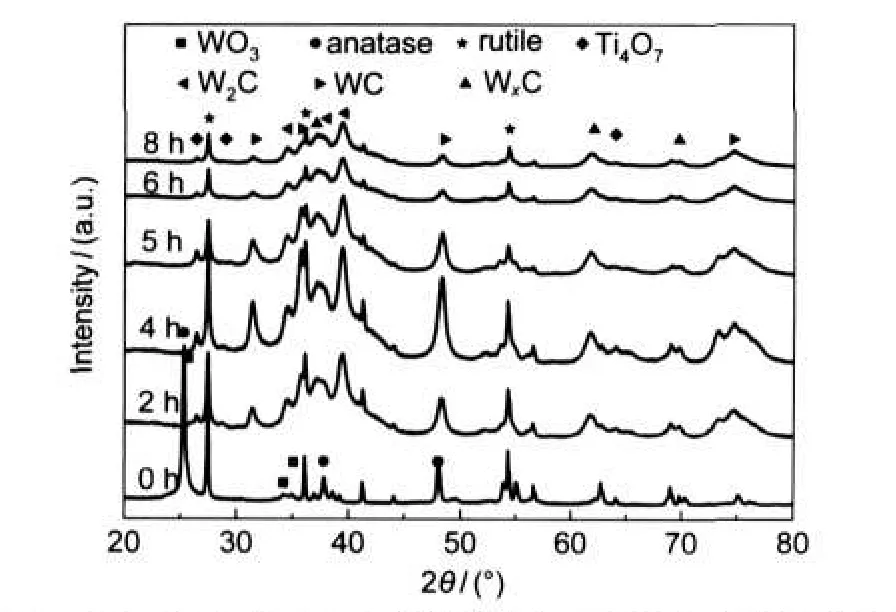
图1 W/Ti摩尔比为1:3的前驱体在不同还原碳化时间后所制备样品的XRD图Fig.1 XRD patterns of the samples prepared from the precursor with a molar ratio of W/Ti at 1:3 after different reduction and carbonization time
还原碳化4、5、6和8 h的样品的晶相组成与还原碳化2 h样品的晶相组成相同,即存在金红石型TiO2、Ti4O7、WC、W2C和WxC这五种晶相,但各种晶相的特征衍射峰的相对强度略有不同.这说明不同还原碳化时间下,上述五种晶相在样品中的相对含量略有不同;还说明虽然还原碳化时间不同,但其还原碳化过程基本类似;Ti4O7和WxC两种晶相的出现,说明相对于制备纯WC/TiO2复合材料而言,样品存在不同程度的还原过度.此外,对比所有还原碳化后的样品发现,在2θ为34°-45°范围内的基线均出现了不同程度的上拱现象.这种现象可能由两个方面的因素引起:一方面,碳化钨壳层包裹氧化钛核之后,两者之间必然存在一个界面.由于碳化钨与氧化钛的晶格常数有一定的差异,界面附近两种物相的晶格必然存在明显的畸变现象;另一方面,样品的氧化钛中存在三种物相,即金红石、锐钛矿和非化学计量比的Ti4O7,碳化钨中也存在三种物相,即WxC、WC和W2C,这些物相之间存在相互作用.
图2为由W/Ti摩尔比为1:1的前驱体所制备的样品XRD分析结果.从图2中可看出,W/Ti摩尔比为1:1的前驱体与W/Ti摩尔比为1:3的前驱体晶相组合相同,即由金红石型TiO2、锐钛矿型TiO2和三氧化钨这三种物相构成.还原碳化2、4、5和6 h的样品由金红石型TiO2、WC和W2C三种物相组成.与W/Ti摩尔比为1:3的前驱体所制备的样品相比,不存在WxC和Ti4O7两种物相.这可能是因为随着W/ Ti摩尔比的增加,复合材料的壳层厚度增加.当还原碳化时间为2-6 h时,较厚的WO3壳层既阻止了H2对TiO2核还原作用,还保护了复合材料中TiO2核的晶相稳定性,避免了Ti4O7晶相的形成;同时,由于壳层厚度增加延长了渗碳作用的过程,使得复合材料中的壳层未能生成WxC晶相;与还原碳化2、4、5和6 h的样品相比,还原碳化8 h的样品出现了Ti4O7的晶相.这说明经过8 h的还原碳化后,W/Ti摩尔比为1:1的前驱体的壳层未能阻止H2对TiO2核还原作用,致使Ti4O7晶相的形成.
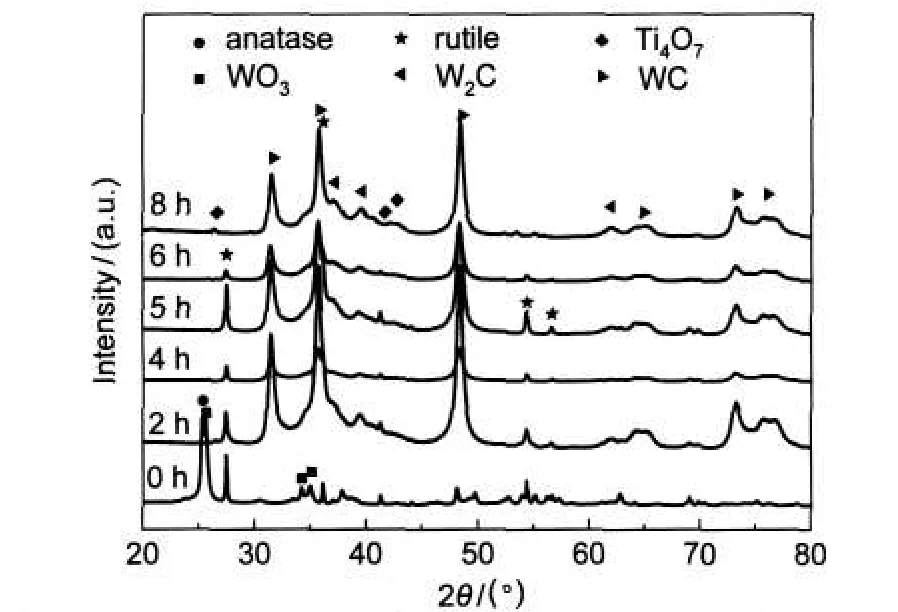
图2 W/Ti摩尔比为1:1的前驱体在不同还原碳化时间后所制备样品的XRD图Fig.2 XRD patterns of the samples prepared from the precursor with a molar ratio of W/Ti at 1:1 after different reduction and carbonization time
图3为W/Ti摩尔比为3:1的前驱体所制备的样品XRD分析结果.从图3中可以看出,与上述两种W/Ti的前驱体相比,晶相组成基本相同,即由金红石型TiO2、锐钛矿型TiO2和三氧化钨这三种物相构成.还原碳化2、4、5、6和8 h的样品由金红石型TiO2、WC和W2C三种物相构成.这说明W/Ti摩尔比为3:1的前驱体所制备的样品在小于8 h的还原碳化过程中,较厚的WO3壳层彻底地阻止了H2对TiO2核的还原作用,保护了TiO2核的晶相稳定性,又延长了壳层渗碳作用的过程,使得复合材料的壳层无法生成WxC物相.

图3 W/Ti摩尔比为3:1的前驱体在不同还原碳化时间后所制备样品的XRD图Fig.3 XRD patterns of the samples prepared from the precursor with a molar ratio of W/Ti at 3:1 after different reduction and carbonization time
对比图1、图2和图3可看出,样品中物相越复杂,X射线衍射分析图谱的基线上拱越明显.这说明X射线衍射分析图谱的基线上拱不仅与样品的核壳结构有关,也与样品的晶相组合有关.
3.2 TEM结果
图4是由W/Ti摩尔比为1:3前驱体制备的样品TR-1:3-6的TEM照片.图4A为样品颗粒的形貌与表面结构,从中可看出样品颗粒的直径多在100 nm以下,仅有少量颗粒的直径大于100 nm,部分颗粒还具有核壳结构特征,如图4A中方框内的颗粒.图4B为样品颗粒的局部放大.从中可看出,以图中白色曲线为界,可将颗粒划分为两个部分,外围部分的灰度相对较高,构成厚薄稍有差异的壳层,并包裹内部灰度相对较浅的部分,具有明显的核壳结构特征.这可能是由于W/Ti摩尔比较小,样品中碳化钨不足,碳化钨在样品内的分布不均匀,影响样品颗粒的分散性,并致使多数颗粒的核壳结构不明显,仅部分颗粒具有核壳结构,且壳层厚度也不均匀.
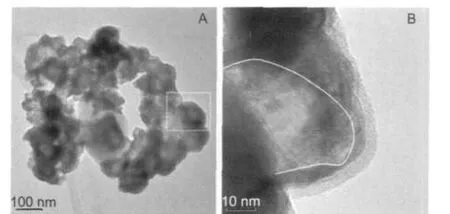
图4 样品TR-1:3-6的TEM照片Fig.4 TEM images of sample TR-1:3-6(A)morphology,(B)microstructure;TR:symbol of the sample; in TR-1:3-6:1:3 refers to molar ratio of tungsten to titanium and 6 means reduction and carbonization time(h).
图5是由W/Ti摩尔比为1:1前驱体制备的样品TR-1:1-6的TEM照片.图5A为样品的颗粒大小与整体形貌,从中可看出,样品颗粒的直径均在50 nm以下,图中白色方框内的颗粒具有明显的核壳结构特征.为了进一步确认其微结构特征,将该颗粒局部放大,结果如图5B所示.从图5B中可以看出,样品颗粒依据其灰度可以分为两个部分,其中中心部分的灰度较浅,经在Philips CM 200 ultratwin高分辨电镜中测量和计算,其晶格条纹的间距为0.34 nm,与金红石(PDF:73-2224)的(110)晶面间距接近;外围壳层部分的灰度较高,经在Philips CM 200 ultratwin高分辨电镜中测量和计算,其一组晶面的晶格条纹间距为0.22 nm,与碳化钨(PDF:51-0939)的(100)晶面间距接近.上述晶面间距的实测结果与标准卡片的晶面间距数值有一定的差异.这些差异可能是系统误差和测量误差所致.结合样品的XRD分析结果,可以认为样品的核由金红石构成,壳层主要由碳化钨构成,两者构成了核壳结构纳米复合材料,且碳化钨与金红石之间存在共晶格和半晶格现象,如图5C所示.与样品TR-1:3-6相比,样品TR-1: 1-6的核壳结构更完整,壳层厚度也相对均匀.
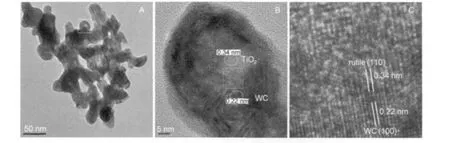
图5 样品TR-1:1-6的TEM照片Fig.5 TEM images of sample TR-1:1-6(A)morphology,(B)microstructure,(C)lattice structure
图6是由W/Ti摩尔比为3:1前驱体制备的样品TR-3:1-6的TEM照片.从图6A中可看出,样品颗粒直径多在100 nm以下,与样品TR-1:3-6和TR-1:1-6相比,颗粒团聚严重.样品中部分颗粒也具有核壳结构特征,如图6B所示.与样品TR-1:3-6和TR-1: 1-6相比,其核壳结构特征不是那么显著.这可能是由于钨钛比过大,过多碳化钨颗粒包裹在载体二氧化钛外表面,致使碳化钨分布不均匀,并导致样品颗粒团聚.

图6 样品TR-3:1-6的TEM照片Fig.6 TEM images of sample TR-3:1-6(A)morphology;(B)microstructure
综合比较样品TR-1:3-6、TR-1:1-6和TR-3:1-6的形貌和微结构特征可认为,WC/TiO2纳米复合材料核壳结构的完整性与前驱体的钨与钛摩尔比值相关.
3.3 STEM结果
样品TR-1:1-6的EDS分析结果如图7所示.从图7中可看到,样品的EDS图谱中有O、Cu、W、Ti和C五种元素的谱峰.其中,Cu来源于分析时承载样品的铜网;C的谱峰源自两个方面,一是分析时承载样品铜网上的碳膜,另一是样品颗粒本身的碳元素;其它三种元素均源自样品颗粒.这说明样品的化学组成由W、Ti、O和C四种元素构成.
样品TR-1:1-6的STEM测试结果如图8所示.图8a和8b为采用EDS面扫时样品颗粒的形貌,图8 (c-g)为样品中元素的分布密度,图中颜色的深浅代表元素分布密度的高低,颜色越深,元素的分布密度越高,反之则越低.从图8f和8g中可看出,钨元素L和M线的密度分布轮廓与样品颗粒的形貌基本一致;从图8c中可看出,碳元素的K线密度分布较样品颗粒的形貌范围大;从图8d和8e中可看出,氧元素和钛元素的分布范围基本一致,且比样品颗粒的形貌的范围略小.
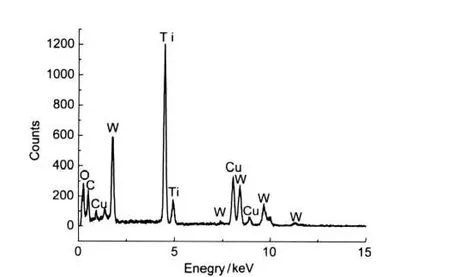
图7 样品的EDS分布图谱Fig.7 EDS results of the sample

图8 STEM模式下EDS各元素W、Ti、O和C面分布图Fig.8 EDS elemental mapping of W,Ti,O,and C elements under STEM model
结合样品的XRD分析结果,说明样品由碳化钨和氧化钛这两种化合物组成.上述结果说明碳化钨的分布范围大于氧化钛的分布范围,且碳化钨将氧化钛包裹在其内部.这与TEM的表征结果一致.其中,碳元素的分布范围大于样品颗粒形貌的范围,这是由于样品在分析过程中需要负载于铜网的碳支持膜上,受碳支持膜的影响所致.
基于上述结果和分析可认为:样品TR-1:1-6的晶相由WC和TiO2构成,前者包裹于后者外表面,形成了较完整的以TiO2为核,WC为壳层的核壳结构.
3.4 电催化性能
不同还原碳化时间样品在碱性条件下对甲醇的循环伏安曲线如图9所示.其中,图9(A,B,C)分别是TiO2、WC和复合材料对甲醇的循环伏安曲线.由图9(A)可见,TiO2只具有一个氧化峰和一个还原峰;由图9(B)可见,WC对甲醇的电催化氧化没有明显的活性;由图9(C)可见,样品TR-1:1-2,TR-1:1-4, TR-1:1-5和TR-1:1-6在甲醇的电催化氧化过程中均具有两个氧化峰和一个还原峰,TR-1:1-8只具有一个氧化峰,还原峰不明显.这说明还原碳化2-6 h的样品对甲醇具有明显的电催化活性.为了更加直观并便于对比,将图9中各样品氧化峰和还原峰的峰电位和峰电流汇总列于表1中.
由表1可看出,样品TR-1:1-2、TR-1:1-4、TR-1: 1-5、TR-1:1-6和TR-1:1-8的第一个氧化峰电位分别为-0.208、-0.188、-0.202、-0.114和-0.031 V,相应的氧化峰电流分别为13.49、15.40、9.173、3.056和4.814µA.对比所有样品发现,随着还原碳化时间的增加氧化峰电位逐渐增大.这说明在碱性溶液中样品对甲醇的电催化氧化活性随着还原碳化时间的增加而逐渐减弱,样品的电催化活性与还原碳化时间有着密切关系.样品TR-1:1-2、TR-1:1-4、TR-1:1-5和TR-1:1-6的第二个氧化峰电位分别为0.434、0.628、0.391和0.581 V,相应的氧化峰电流分别为12.00、14.13、9.708和3.247µA.对比样品第二个氧化峰的峰电位,对甲醇的电催化活性最好的为TR-1:1-5.虽然与炭载铂等贵金属催化剂21-24相比,碳化钨与氧化钛复合材料的峰电流明显较小,但其氧化峰电位明显负移.这说明若能进一步提高复合材料的导电性能,其对甲醇的电催化氧化将具有很好的应用前景.
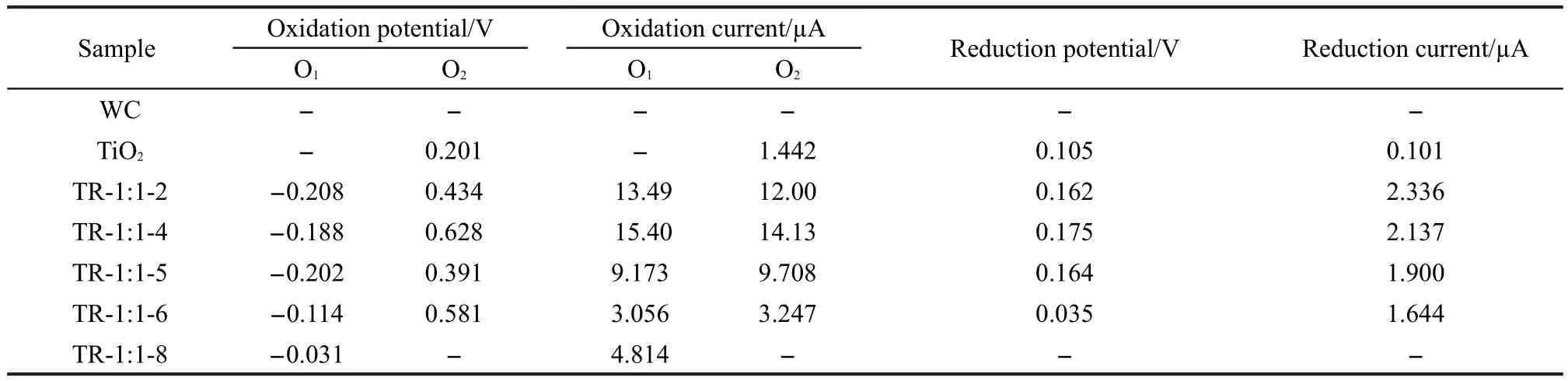
表1 样品对甲醇的电催化活性Table 1 Electrocatalytic activities of the samples for methanol
由表1还可以看出,样品TR-1:1-2、TR-1:1-4、TR-1:1-5和TR-1:1-6的第一个还原峰电位分别为0.162、0.175、0.164和0.035 V,相应的还原峰电流分别为2.336、2.137、1.900和1.644µA.对比上述还原峰电位,还原碳化时间介于2-5 h时,电位变化不明显,还原碳化6 h后,还原峰电位明显减小.这说明样品对甲醇的电催化还原活性与还原碳化时间有关.
对比表1中的氧化峰和还原峰的峰电位和峰电流,除还原碳化8 h的样品外,其它样品均具有两个氧化峰和一个还原峰.这组氧化还原峰很可能是复合材料的载体氧化钛中的钛离子对(Ti4+/Ti3+)在碱性条件下的氧化与还原可逆反应:

上述反应在碱性溶液中有利向右进行而使其在循环伏安曲线中出现不对称的氧化峰和还原峰.扣除载体的一对氧化还原峰,复合材料的循环伏安曲线中的另一个氧化峰即为其对甲醇的电催化氧化峰.Frelink等25研究表明,甲醇在电催化氧化过程中在催化剂表面的主要反应是:

碳化钨与二氧化钛复合材料在碱性溶液的循环伏安过程中是否按上述机理进行,有待于采用气相质谱与电化学联机,以及电化学现场红外光谱分析等方法进行深入探讨.
综上所述,纯WC在碱性溶液中对甲醇没有明显的电催化氧化活性,二氧化钛在碱性溶液中对甲醇的电催化氧化活性也不强.两者复合后,复合材料在碱性溶液中对甲醇的电催化氧化活性明显高于二氧化钛对甲醇的电催化活性.这说明碳化钨与氧化钛复合后,两者对甲醇的电催化氧化活性具有显著的协同作用.
图10是不同钨钛摩尔比的样品在碱性条件下对甲醇的循环伏安曲线.由图10可见,样品TR-1: 3-4、TR-1:1-4、TR-3:1-4和TR-5:1-4在甲醇的电催化过程中存在两个氧化峰和一个还原峰.这说明上述样品对甲醇具有明显的电催化活性.为了更加直观并便于对比,将图10中各样品的氧化峰和还原峰峰电位和峰电流汇总列于表2.
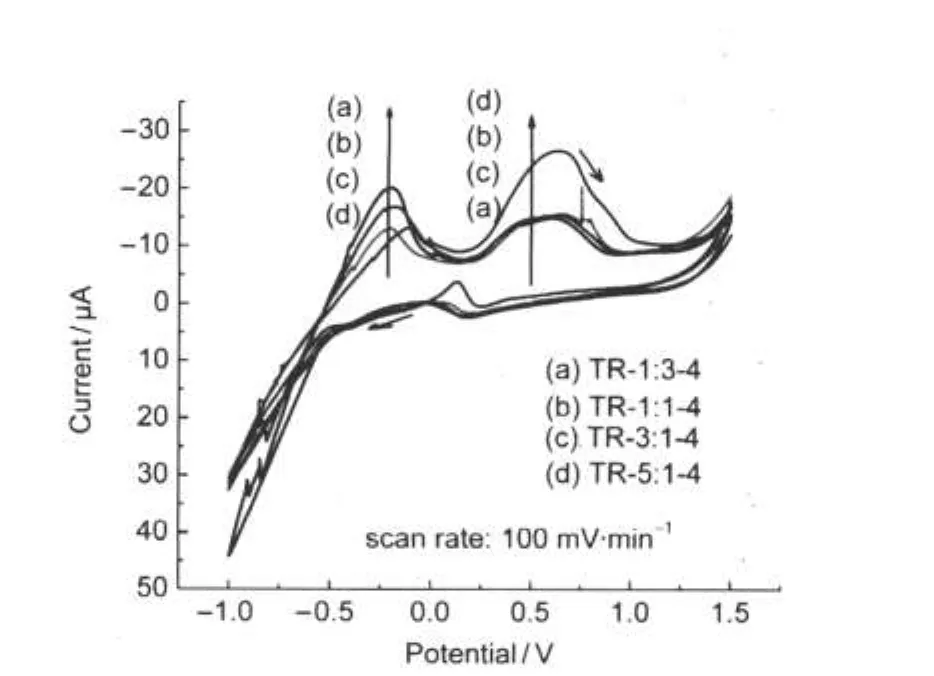
图10 样品在0.25 mol·L-1CH3OH+0.1 mol·L-1 NaOH溶液中的CV曲线Fig.10 Cyclic voltammograms of the samples in 0.25 mol·L-1CH3OH+0.1 mol·L-1NaOH solution
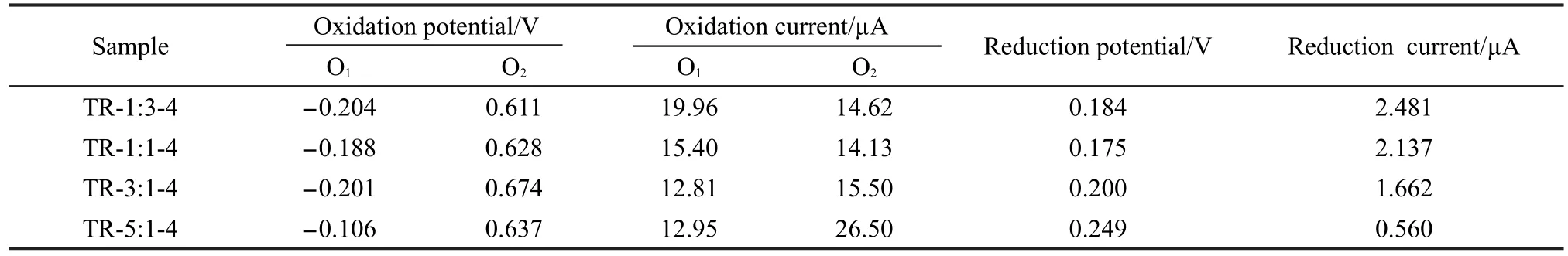
表2 样品的电催化性能Table 2 Electrocatrlytic properties of the samples
由表2可看出,TR-1:3-4、TR-1:1-4、TR-3:1-4和TR-5:1-4的第一个氧化峰电位分别为-0.204、-0.188、-0.201和-0.106 V,相应的氧化峰电流分别为19.96、15.40、12.81和12.95µA.比较上述四个峰电位数据发现,随着样品内钨钛摩尔比的增加,第一个氧化峰的电位变化没有明显的规律.这说明样品对甲醇的电催化氧化活性随钨钛摩尔比的增加呈现不规律变化.样品TR-1:3-4、TR-1:1-4、TR-3:1-4和TR-5:1-4的第二个氧化峰电位分别为0.611、0.628、0.674和0.637 V,相应的氧化峰电流分别为14.62、14.13、15.50和26.50µA.比较上述四个峰电位数据发现,随着样品内钨钛摩尔比的增加,第二个氧化峰的电位先升高后降低.这说明样品对甲醇的电催化氧化活性随钨钛摩尔比的增加而增强.当钨钛摩尔比达到3:1时,活性最强.这是由于当样品的钨钛摩尔比较小时,复合材料主要以TiO2/WC核壳结构的形式存在.这种结构具有优异的表面性能,使得样品具有良好的催化性能.当样品的钨钛摩尔比增大时,由于WC的团聚作用破坏了核壳结构材料的分散性,致使样品颗粒的团聚现象严重,从而使样品成为镶嵌TiO2的WC块体复合材料.这必然降低样品的比表面积,减弱了TiO2载体对催化反应的作用,降低了复合材料的催化反应活性.
由表2还可以发现,样品TR-1:3-4、TR-1:1-4、TR-3:1-4和TR-5:1-4的第一个还原峰电位分别为0.184、0.175、0.200和0.249 V,相应的还原峰电流分别为2.481、2.137、1.662和0.560µA.这说明样品对甲醇的电催化还原活性随钨钛摩尔比的增大先降低后升高,还原活性最高的样品是TR-5:1-4.
4 结论
将浸渍法与原位还原碳化法相结合,成功制备了核壳结构WC/TiO2纳米复合材料;样品的晶相组成以金红石型TiO2、Ti4O7、WC、W2C和WxC这五种晶相为主,各个样品的具体晶相组合不仅与其前驱体的钨钛摩尔比值有关,还与其还原碳化时间有关.不论样品的晶相组成如何,其化合物为钨碳化物和钛氧化物两种.其中,前者负载于后者的外表面,构成比较典型的核壳结构.钨碳化物在钛氧化物载体的外表面分布的均匀性,以及核壳结构中壳层的完整性和厚度与制备样品时的前驱体内的钨钛摩尔比值相关.相比于碳化钨和二氧化钛而言,复合材料对甲醇的电催化氧化活性得到了明显的提升.这与样品制备时前驱体复合材料的钨钛摩尔比、还原碳化时间和碳化钨壳层的完整性,以及核壳结构中二氧化钛和碳化钨之间的协同效应有关.
(1) Levy,R.B.;Boudart,M.Science 1973,181,547.
(2) Böhm,H.Nature 1970,227,483.
(3) Xiao,T.C.;Hanif,A.;York,A.P.E.;Green,J.S.Phys.Chem. 2002,4,3522.
(4) Xue,H.X.;Song,G.X.;Wang,L.;Chen,J.M.Acta Chim.Sin. 2003,61,208.[薛华欣,宋国新,王 琳,陈建民.化学学报, 2003,61,208.]
(5) Zhang,Y.F.;Lin,W.;Wang,W.F.;Li,J.Q.Acta Chim.Sin. 2004,62,1041.[章永凡,林 伟,王文峰,李俊篯.化学学报, 2004,62,1041.]
(6) Sinfelt,J.H.;Yate,D.J.C.J.Catal.1968,10,362.
(7) Lee,J.S.;Volpe,L.;Ribeiro,F.H.;Boudart,M.J.Catal.1988, 112,44.
(8) Keller,V.;Wehrer,P.;Garin,F.;Ducros,R.;Maire,G.J.Catal. 1997,166,125.
(9) Fleischmann,R.;Boehm,H.Electrochim.Acta 1977,20,1123.
(10)Ma,C.A.;Yang,Z.W.;Zhou,Y.H.;Zha,Q.X.Acta Phys.-Chim.Sin.1990,6,622.[马淳安,杨祖望,周运鸿,查全性.物理化学学报,1990,6,622.]
(11) Hwu,H.H.;Chen,J.G.J.Phys.Chem.B 2001,105,10037.
(12) Hwu,H.H.;Polizzotti,B.D.;Chen,J.G.J.Phys.Chem.B 2001,105,10045.
(13) Hwu,H.H.;Chen,J.G.J.Phys.Chem.B 2003,107,2029.
(14) Baresel,D.;Gellert,W.;Heidemeyer,J.;Scharner,P.Angew. Chem.Int.Edit.1971,10,194.
(15) Miles,R.Chem.Tech.Biotechnol.1980,30,35.
(16) Tauster,S.J.;Fung,S.C.;Garten,R.L.J.Am.Chem.Soc. 1978,100,170.
(17)Yao,G.X.;Shi,B.B.;Li,G.H.;Zheng,Y.F.Acta Phys.-Chim. Sin.2010,26,1317.[姚国新,施斌斌,李国华,郑遗凡.物理化学学报,2010,26,1317.]
(18)Wang,X.J.;Ma,C.A.;Li,G.H.;Zheng,Y.F.Acta Chim.Sin. 2009,67,367.[王晓娟,马淳安,李国华,郑遗凡.化学学报, 2009,67,367.]
(19) Shi,B.B.;Yao,G.X.;Li,G.H.;Zheng,Y.F.Chin.J.Catal. 2010,31,466.[施斌斌,姚国新,李国华,郑遗凡.催化学报, 2010,31,466.]
(20) Cha,C.S.;Li,C.M.;Yang,H.X.;Liu,P.F.J.Electroanal. Chem.1994,368,47.
(21)Tan,W.Y.;Li,G.;Yang,H.;Xing,W.;Lu,T.H.Journal of Nanjing Normal University(Natural Science Edition)2003,26, 111.[唐文亚,李 纲,杨 辉,邢 巍,陆天虹.南京师大学报(自然科学版),2003,26,111.]
(22)Zhao,Y.C.;Lan,H.X.;Deng,B.B.;Tian,J.N.;Yang,X.L.; Wang,F.Y.Acta Phys.-Chim.Sin.2010,26,2255.[赵彦春,兰黄鲜,邓彬彬,田建袅,杨秀林,王凤阳.物理化学学报, 2010,26,2255.]
(23) Ding,L.X.;Wang,S.R.;Zheng,X.L.;Chen,Y.;Lu,T.H.; Cao,D.X.;Tang,Y.W.Acta Phys.-Chim.Sin.2010,26,1311. [丁良鑫,王士瑞,郑小龙,陈 煜,陆天虹,曹殿学,唐亚文.物理化学学报,2010,26,1311.]
(24) Peng,C.;Cheng,X.;Zhang,Y.;Chen,L.;Fan,Q.B.Acta Phys.-Chim.Sin.2004,20,436. [彭 程,程 璇,张 颖,陈 羚,范钦柏.物理化学学报,2004,20,436.]
(25) Frelink,T.;Visscher,W.;Van Veen,J.A.R.J.Electroanal. Chem.1995,382,65.
July 21,2011;Revised:September 2,2011;Published on Web:September 7,2011.
Preparation of Tungsten Carbide and Titania Nanocomposite and Its Electrocatalytic Activity for Methanol
HU Xian-Chao1,2CHEN Dan1SHI Bin-Bin1LI Guo-Hua1,3,4,*
(1School of Chemical Engineering and Materials Science,Zhejiang University of Technology,Hangzhou 310032,P.R.China;2Research Center of Analysis and Measurement,Zhejiang University of Technology,Hangzhou 310032,P.R.China;3State Key Laboratory Breeding Base of Green Chemistry Synthesis Technology,Zhejiang University of Technology,Hangzhou 310032,P.R. China;4Research Center of Nanoscience and Technology,Zhejiang University of Technology,Hangzhou 310032,P.R.China)
Tungsten carbide and titania nanocomposite with a core-shell structure was fabricated by combing chemical immersion with carbonization-reduction,using titania nanopowder as a support and tungsten hexachloride as a tungsten precursor.The crystal phase,morphology,microstructure,and chemical composition of the sample were characterized by X-ray diffraction,transmission electron microscopy,high resolution scanning transmission imaging,and energy dispersive spectroscopy(EDS). The results show that the crystal phase of the sample is composed of rutile,Ti4O7,WC,W2C,and WxC.The tungsten carbide particles coat onto the surface of the rutile support and thus form a core-shell structure. The electrocatalytic activity of the sample for methanol was measured by cyclic voltammetry with a three-electrode system in an alkaline solution.The results indicate that the electrocatalytic activity of the sample is higher than that of a pure titania phase and WC.The improvement in electrocatalytic activity is related to the reduction-carbonization time,the W to Ti molar ratio,the completeness of the shell layer in the core-shell structure,and the crystal phase of the sample.These factors can be correlated to a synergistic effect between titania and tungsten carbide in the nanocomposite.These imply that titania is a suitable support for the enhancement of the electrocatalytic activity of tungsten carbide.
Tungsten carbide;Rutile;Nanocomposite;Core-shell structure; Electrocatalytic activity
10.3866/PKU.WHXB20112863
∗Corresponding author.Email:nanozjut@zjut.edu.cn;Tel:+86-571-88320418.
The project was supported by the National Natural Science of Foundation of China(21173193),Natural Science Foundation of Zhejiang Province, China(Y406094,Y4080209),and Scientific Fund of Zhejiang Province,China(2007F0039).
国家自然科学基金(21173193)、浙江省自然科学基金(Y406094,Y4080209)和浙江省科技计划(2007F0039)资助项目
O646
