普通PCR与TD-PCR扩增叶尔羌高原鳅抗菌肽Hepcidin基因的比较
2011-12-10刘书东王娟娟陈根元李莲瑞
刘书东 王娟娟 陈根元 李莲瑞*
(1 塔里木大学生命科学学院,新疆阿拉尔 843300)
(2 塔里木畜牧科技兵团重点实验室,新疆阿拉尔 843300)
叶尔羌高原鳅[triplophysa(Hedinichthys)yarkandensis(Day)]为鳅科、高原鳅属、鼓鳔亚属的鱼类,俗名叶尔羌条鳅、狗头鱼[1,2]。主要分布新疆南部的塔里木河水系,但近年来,由于环境污染、病害频繁,造成了资源的缺乏,成为濒危鱼类。对叶尔羌高原鳅病害的防治,除了保护好当地的环境,还可以提高鱼本身的免疫能力。在病害早期,鱼类主要依靠非特异性体液免疫来抵御病原体感染,而在此过程中抗菌肽起到一定的重要作用。(Antibacterial peptides)是一类由基因编码的小分子多肽,是机体免疫防卫系统的重要组成部分,生物体产生的对抗外源性病原体侵袭致病作用的防御性肽类活性物质,一般由10~50个氨基酸组成[3]。抗菌肽分子量小,活性强,功能广泛,应用基因工程克隆与表达抗菌肽基因,改造合成抗菌肽基因以及动物的转抗菌肽基因工程等已越来越受到人们的重视。Hepcidin作为鱼类抗菌肽的一种类型备受关注,是一种有肝脏特异表达的抗菌肽,相对分子质量小(4 kD左右),具有显著的广谱抗菌活性,是机体天然免疫的一种效应子,也是调节铁代谢的重要分子,目前被认为是调节维持铁稳态极其重要的负激素[4]。降落PCR(touchdown PCR,TD—PCR)是一种设计多循环以使相连循环的退火温度越来越低,从而达到最佳扩增条件的方法。本实验利用降落式PCR技术扩增叶尔羌高原鳅抗菌肽基因特定片段,获得良好效果。
1 材料和方法
1.1 材料
1.1.1 实验动物:
叶尔羌高原鳅(Triplophysa(Hedinichthys)yarkandensis(Day))试验用鱼,系塔里木河流域阿拉尔河段,人工小抬网和地笼捕捞而得。
1.1.2 仪器与试剂:电泳仪DYY-12稳压电泳仪、TC-512型PCR仪、凝胶成像仪;PCR扩增所用的主要试剂dNTPs、TaqDNA酶、DL 2000 Marker购自TakaRa、超纯净水;琼脂糖由北京百泰克生物技术有限公司生产。
1.2 试验方法
1.2.1 总RNA的提取:
本研究参照徐丽君等提取叶尔羌高原鳅肝胰脏总RNA的方法进行提取[5]。
1.2.2 琼脂糖凝胶电泳
采用分子克隆[6]方法进行。
1.2.3 第一条链合成
取 RNA8 μL,dNTP 1 μL ,OligdT 1 μL 65 ℃,5 min,冰上1~2 min;在分别加入5×Primesoript buffer 4 μL,RNA Inhibiter 0.5 μL,Primer script RTase1 μL,PCR H2O,混匀,42 ℃ 45 min,70 ℃ 15 min,冰浴。
1.2.4 引物设计
根据 GenBank上已报道的鱼类Hepcidin基因序列设计引物:
PF:5'-ggcGAATTCATGAAGACATCAGTGTTTGCTG-3'
PR:5'-ggcCTCGAGTAGTGGTCACAGGACCCGTCA-3'
引物由北京华大中生科技发展有限公司合成,引物PF和PR用无RNA酶水稀释成20 pmol/μL的工作浓度备用。
1.2.5 普通PCR反应体系与反应程序:
普通PCR反应体系(20 μL)及反应程序:PCR反应体系:dNTP 2 μL,d3H2O 12.5 μL,10 × Buffer 2 μL, PF0.5 μL, PR0.5 μL, DNA 1 μL,Taq 0.4 μL。
反应程序为:94℃预变性5 min;94℃变性l min;59.5℃退火30 s;72℃延伸l min进行32个循环;72℃延伸10 min。
PCR扩增结束,取5 μL扩增产物于l%琼脂糖凝胶,100 V电泳20 min,用VP凝胶成像系统观察并成像分析。
1.2.6 降落PCR反应体系与反应程序:
PCR 反应体系:dNTP 2 μL,d3H2O 12.5 μL,10 × Buffer 2 μL,PF 0.5 μL,PR 0.5 μL,DNA 1 μL,Taq 0.4 μL;PCR 扩增程序:94℃ 5 min;94℃30 s,63 ℃ 30 s,72 ℃ 90 s,2 次循环;94 ℃ 30 s,62℃ 30 s,72 ℃ 90 s,2 次循环;94 ℃ 30 s,61 ℃ 30 s,72 ℃ 90 s,2次循环;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,2 次循环;94 ℃ 30 s,59 ℃ 30 s,72 ℃ 90 s,2 次循环;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,2次循环;94℃ 30 s,57 ℃ 30 s,72 ℃ 90 s,2 次循环;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 90 s,2 次循环;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,2 次循环;94 ℃30 s,54 ℃ 30 s,72 ℃90 s,2 次循环;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 90 s,2次循环;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 90 s,2 次循环;94℃30 s,55 ℃ 30 s,72 ℃ 90 s,26次循环;72 ℃10 min。PCR扩增结束,取5 μL扩增产物于l%琼脂糖凝胶,100 V电泳20 min,用UVP凝胶成像系统观察并成像分析。
1.2.7 胶回收
采用北京百泰克生物技术有限公司生产的琼脂糖回收试剂盒回收目的基因片段,回收方法按试剂盒提供的方法。
1.2.8 叶尔羌高原鳅降落式 PCR基因片段与pMD18-T载体连接
回收的RT-PCR产物与pMD18-T载体于1.5 mL离心管中。于16℃连接过夜。
1.2.9 连接产物的转化
从-70℃取出感受态克隆细胞DH5α后放置冰水中5 min使之融化,加入连接产物,混匀。冰浴30 min;42℃热冲击90 s,冰浴2 min;加入LB液体培养基500 μL,37 ℃水浴10 min,后于37 ℃、200 r/min振荡培养50 min。取100 μL转化菌混匀后涂LB Amp+(50 mg/mL)平板,将Amp+板置于37℃培养箱培养12 h。
1.2.10 转化产物的培养
将转化的单菌落接种于3 mL LB液体培养基(Amp+50 mg/ml)中,于37℃、160 r/min摇床中培养10 h。
1.2.11 转化菌的PCR鉴定
反应条件:90℃预变性5 min后进行循环,包括95 ℃、50 s,55 ℃、50 s,72 ℃、50 s,30 个循环后,72℃延伸10 min。
2 结果与分析:
获得的总RNA中,28S和18S带型整齐,基本不拖尾,而且28S rRNA带的亮度明显高于18S rRNA,无降解,说明RNA完整性好(图1)。经过降落式PCR目的基因在387 bp,大小与预期的结果基本一致(图2),而普通PCR并没有特异性条带(图3)。测序后在与加州鲈鱼、小口黑鲈抗菌肽Hepcidin同源性达90%以上,在抗菌肽Hepcidin成熟肽有八个半胱氨酸,与已报道的抗菌肽一致(图4)。通过MEGA4.1构建进化树,可以看出叶尔羌高原鳅与黑棘鲷在抗菌肽Hepcidin基因亲缘关系最近(图5)。
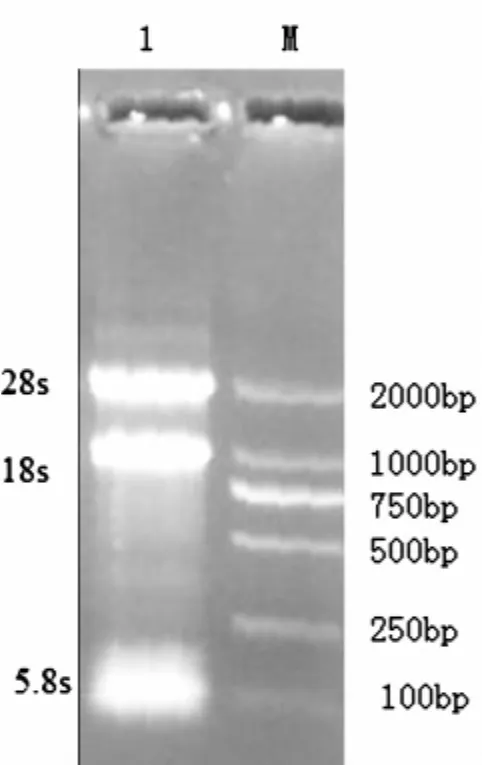
图1 叶尔羌高原鳅肝胰脏总RNA
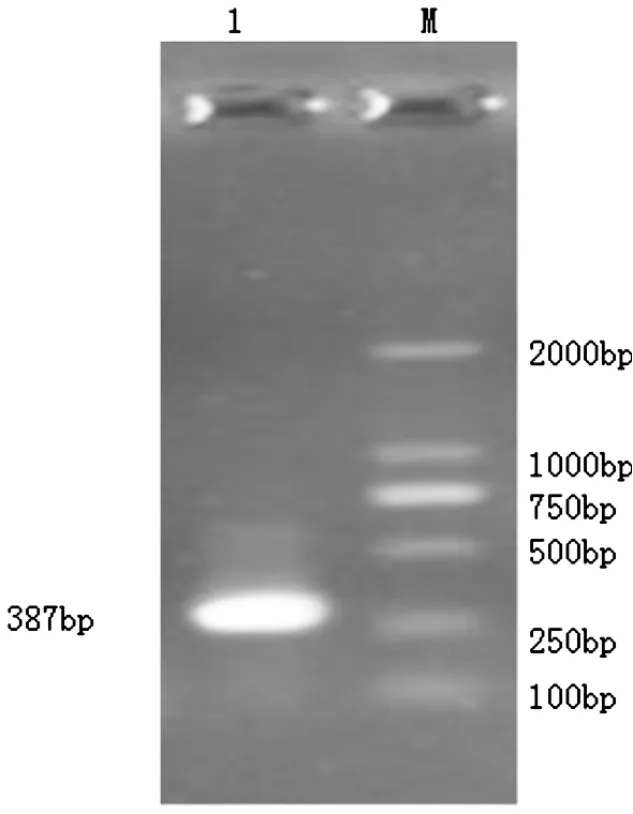
图2 降落式PCR扩增抗菌肽Hepcidin基因
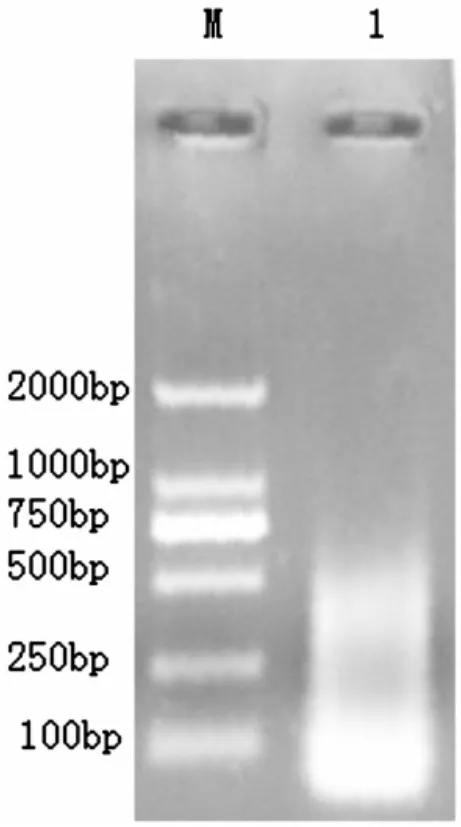
图3 普通式PCR扩增抗菌肽Hepcidin基因

图4 叶尔羌高原鳅Hepeidin抗菌肽序列及其编码的氨基酸序列

图5 叶尔羌高原鳅Hepeidin抗菌肽基因进化树
3 讨论
抗菌肽Hepcidi是一类由基因编码的小分子多肽,是机体免疫防卫系统的重要组成部分,生物体产生的对抗外源性病原体侵袭致病作用的防御性肽类活性物质。抗菌肽分子量小,活性强,功能广泛。其杀菌过程为抗菌肽分子α-螺旋上的正电荷与细菌质膜磷脂分子上的负电荷在静电力作用下,相互吸引而靠近;然后借助于分子中N端与C端间的柔性,抗菌肽分子中的疏水端插入质膜中;随后,α-螺旋也插入质膜中,这样就破坏了脂质双分子层原有的有序结构,由于β-折叠的两亲性使抗菌肽分子通过膜内分子间的位移而相互聚集在一起,从而在膜上形成离子通道,细菌最终不能保持正常渗透压而致死[7,8]。
鱼类抗菌肽基因工程方面的报道主要集中在对hepcidin的研究,肝脏是Hepcidin的主要合成场所,脊髓、心脏、肺也有少量的表达,但睾丸、卵巢、前列腺、膀胱、结肠和小肠几乎没有表达[9,10]。
本试验将退火温度范围设定为63℃至55℃,主要是为了提高特异性引物与非特异性在该循环范围内出现的明显程度。对于低于退火温度的范围也会有非特异性,但不明显[11]。不过与特异性扩增的目的基因相比是微不足道。本实验经过普通PCR扩增Hepcidin基因重复多次末见特异性条带,而利用TD-PCR法成功地扩增出了该基因,大小与预期结果及前人的论述一致[12]。
从抗菌肽Hepcidin基因来看普通PCR和TDPCR,前者的优点是:程序省时,简单,一般的PCR仪都可完成,缺点是:退火温度不适当时容易出现假阳性或结果不明显;而TD-PCR程序虽然复杂,但能非常有效地降低或避免假阳性,且在不理想的工作条件下也可扩增出特异性产物,可用于普通PCR难以扩增的基因片段[13]。
通过GenBank数据库分析发现叶尔羌高原鳅抗菌肽hepcidin基因与黑棘鲷、小口黑鲈同源性达90%,在进化树可以看出黑棘鲷亲缘性最近。从而证明了,降落式PCR可用于普通PCR难以扩增的基因片段。
[1]朱松泉.中国条鳅志[M].南京:江苏科学技术出版社,1989,129 -131.
[2]中国科学院动物研究所,中国科学院新疆生物土壤沙漠研究所,新疆维吾尔自治区水产局.新疆鱼类志[M].乌鲁木齐:新疆人民出版社.1979:49-50.
[3]Michael Zasloff.Antimicrobial peptides of multicellular organisms[J].Nature,2002,415(24):389 -395.
[4]Ivana De Domenico,Elizabeta Nemeth,Jenifer M.Nelson,et al.The Hepcidin - Binding Site on Ferroportin Is Evolutionarily Conserved[J].Cell Metabolism ,2008,8(2):146-156.
[5]徐丽君,潘辉,贺艳艳,等.叶尔羌高原鳅肝胰脏总RNA提取方法的比较[J].塔里木大学学报,2010,22(4):18-21.
[6]J.萨姆布鲁克,E.F.弗里奇,T.曼尼阿蒂斯.分子克隆实验指南(第二版)[M].北京:科学出版社,1992.
[7]Chanprapa Imjongjirak,Piti Amparyup,Anchalee Tassanakajon.Molecular cloning,genomic organization and antibacterial activity of a second isoform of antilipopolysaccharide factor(ALF)from the mud crab[J].Scylla paramamosain Fish or Shellfish Immunology,2011,30(1):58-66.
[8]Margitta Dathe,Heike Nikolenko,Jana Meyer,et al.Optimization of the antimicrobial activity of magainin peptides by modification of charge [J].FEBS Letters,2001,501(2 -3):146 -150.
[9]Hunter H N,Fulton D B,Ganz T,et a1.The solution structure of human hepcidin,a peptide hormone with antimicmbial activity that is involved in iron uptake and hereditary hemochromatosis[J].BIO Chem,2002,277(40):37597-37603.
[10]Weinstein D A,Roy C N,Fleming M D,et a1.Inappropriate expression of hepcidin is associated with iron re-fractory anemia:implication for the anemia of chronic disease[J].Blood,2002,100(10):3776 -3781.
[11]张艳萍,郭大玮,马莉莉.降落PCR扩增人类常染色体 STR D15S128[J].中国现代医生,2010,48(2):38-39.
[12]Yin ZhiXin,He Wei,Chen WeiJian,et al.Cloning,expression and antimicrobial activity of an antimicrobial peptide,epinecidin-1,from the orange- spotted grouper,Epinephelus coioides[J].Aquaculture,2006,253(1-4):204-211.
[13]Piraee M,Ving L C.Use of degenerate primers and touchdown PCR to amplify a halogenase gene flagment from Streptomyces venezuelae ISP5230[J].Journal of Industrial Microbiology & Biotechnology,2002,29(1):1-5.
