花花柴耐盐相关基因NHX的克隆与分析
2011-12-10李彬康少锋张莉邓芳王彦芹
李彬 康少锋 张莉 邓芳 王彦芹,3*
(1 塔里木大学生命科学学院,新疆阿拉尔 843300)
(2 四川农业大学水稻研究所,四川温江 611130)
(3 新疆生产建设兵团塔里木盆地生物资源保护与利用重点实验室,新疆阿拉尔 843300)
我国土地面积非常广大,堪称地大物博,但由于现代化建设和住房用地以及城市扩张、自然灾害、土地沙漠化等诸多因素的影响可用耕地面积并不多,大多数土地由于盐碱的危害而并不适于农作物的生长,所以农业发展也受到了相应的限制。地处我国西部地区的新疆,土壤盐渍化非常严重,但有一些植物却能很好的生长,依据基因决定性状,这些植物自身一定拥有丰富的能够调节其在高盐碱环境下生存的基因资源。充分挖掘这些耐盐碱植物基因资源并将其进行合理高效的利用,转入在新疆大面积种植的棉花、旱稻、果树等经济作物中,扩大其种植面积,不仅可以改善当地人的经济收入问题,也将会为解决我国粮食生产、土地的利用率和环境保护等一系列社会问题起到巨大作用。
花花柴(Karelinia caspica),菊科,多年生草本植物。具有泌盐器官,属于泌盐生植物。盐胁迫下,花花柴植株叶片肉质化,而肉质化是真盐生植物的一个典型特征,故花花柴特殊的耐盐机理值得研究。而Na+/H+逆向转运蛋白则是位于细胞的质膜或者液泡膜上,PM-ATPase或V-ATPase和VPPase产生的跨膜H+梯度,可以将细胞质内的Na+进行外排或区隔化到液泡中,具有调节细胞内pH值和Na+浓度以及维持细胞内离子稳态等多种功能。拟南芥中AtNHX1基因是植物中最早克隆的编码质膜和液泡膜Na+/H+逆向转运蛋白的基因,随后又在多种植物中相继克隆得到了它们的同源基因。GeneBank数据库中已有60多种植物中编码NHX蛋白的220多条cDNA序列登录。总结前人研究成果,本研究将以新疆生长的耐盐植物花花柴为材料,从中克隆相关的耐盐基因NHX(控制Na+/H+逆向转运蛋白合成)并进行简单分析以便供人们参考,为后期进行相关转基因研究奠定基础,为提高农作物的耐盐特性提供候选基因及其转基因材料等具有重要意义。
1 材料与方法
1.1 材料
1.1.1 植物材料
菊科植物花花柴(Karelinia caspia(Pall.)Less.),采于新疆阿拉尔市塔里木河畔。2010年6月采集花花柴野生植株,采集前用5%NaCl溶液诱导4 d,取其叶片,提取总RNA。2010年10月采集了花花柴的种子,阴凉干燥处保存。种子消毒后,28℃条件下发芽,待幼苗长出真叶后用5%(w/v)NaCl溶液诱导4 d,取其叶片提取总RNA。
1.1.2 菌种及载体
E.coli DH10B,pMD18T-Vector购于 TaKaRa公司。
1.1.3 主要试剂及实验仪器
试剂:TRNzol Reagent,Agarose,M -MLV Reverse Transcriptase, Ribonuclease Inhibitor, dNTP mixture;25mM,Sangon,DEPC,TaqDNAPolymerase,pMD18T - Vector,CaCl2,DNAMarkerDL2000
仪器:高速冷冻离心机,显微移液器,电泳仪,凝胶成像仪,生物分光光度计,卧式冷冻冷藏转换柜,PCR仪,制冰机
1.2 方法
1.2.1 引物设计
Oligo(dT)18采用TaKaRa公司网站发布序列。Actin primer采用马清等[1]2009 年发表于《生物技术》的碱蓬(Suaeda glauca(Bunge)Bunge)Actin基因片段引物序列。
从NCBI/Nucleotide数据库中搜索并下载已发表的编码植物NHX基因的mRNA序列,然后分离ORF(open reading frame)序列。应用DNAMAN软件进行多序列比对,并应用EMBL/ClustalW2构建NHX基因同源进化树。本研究比对了矮牵牛(Petunia xhybrida,PhNHX1),花花柴(Karelinia caspaca,NHX1,NHX2),拟南芥(Arabidopsis thaliana,AtNHX1),水稻(Oryza sativa,OsNHX1),盐角草(Salicornia europaea,SeNHX1)的 ORF,Identity=94.53%,保守区域长度为1653 bp,从ATG开始到TAA或TGA结束。根据保守区域两端设计了适合于扩增菊科科植物NHX基因的特异性引物。搜索分析了所有已报道的NHX基因序列的酶切位点种类,在设计的引物两端添加限制性内切酶酶切位点HindⅢ和EcoR I。
引物:由上海捷瑞生物工程有限公司合成

Oligo(dT)18TTTTTTTTTTTTTTTTTT Actin primerP1:5’-GTGGTCGTACAACAGGTATTGTG-3’P2:5’-GACCCTCCAATCCAGACACTG-3’NHX primerP3:5’-CGAGGACGAATATTGGTTCTCTTGAGCTGG-3’P4:5’-CCCAGCCCCTGCTCCTAAAAGTGTGC-3’M13 primerP5:5’-CAGGAAACAGCTATGAC-3’P6:5’-GTAAAACGACGGCCAGT-3’
1.2.2 植物总RNA的提取
用Trizol法。
1.2.31 st-cDNA 的合成
1.2.3.1 Microtube 管中配制下列模板 RNA/引物混合液,总体系为12 μL。
1st-cDNA的合成反应体系:Oligo(dT)18(50 μM),2μL;total RNA,2 μg;ddH2O,up to 12
1.2.3.2 70℃保温10 min后迅速在冰上急冷2 min以上。
反转录反应液:RNA/引物变性溶液,12 μL;5× M - MLV Buffer,4 μL;dNTP Mixture(10 mM each),1 μL;RNase Inhibitor(40 U/μL),0.5 μL;RTase M - MLV(RNase H - )(200 U/μL),1 μL;RNase Free Water,1.5 μL.
1.2.3.3 42 ℃保温 75 min。
1.2.3.4 70 ℃保温15 min 后冰上冷却。
1.2.4 Actin 基因片段的克隆
1.2.4.1 Microtube管中配制下列 PCR 反应液,总体系为 50 μL。
PCR反应液:10×Buffer,5μL;MgCl2(25 mM),4μL;dNTP Mixture(25 mM each),0.5 μL;P1(25 μM),0.5 μL,P2(25 μM),0.5 μL;Taq DNA Polymerase(5 U/μL),0.5 μL;1st- cDNA,2.5 μL;ddH2O,36.5 μL.
1.2.4.2 按如下程序进行PCR反应:
94 ℃,4 min,1 cycle;94 ℃,30 s ,52 ℃,30 s,72 ℃,30 s,30 cycles;72 ℃,10 min,1 cycle;15℃,∞。
1.2.4.3 1%琼脂糖凝胶电泳检测PCR产物。
制备1%琼脂糖凝胶,以1×TAE Buffer为介质,在5 V/cm的电场下电泳检测PCR产物,以DNA Marker DL2000为标准物。
1.2.5 PCR扩增NHX基因及目的片段的回收
1.2.5.1 Microtube管中配制下列 PCR 反应液,总体系为 50 μL。
PCR 反应液 :10 ×Buffer,5 μL;MgCl2(25 mM),4μL;dNTP Mixture(25 mM each),0.5 μL;P3(25 μM),0.5 μL,P4(25 μM),0.5 μL;Taq DNA Polymerase(5 U/μL),0.5 μL;1st- cDNA,2.5 μL;ddH2O,36.5 μL.
1.2.5.2 按如下程序进行PCR反应:
94 ℃,4 min,1 cycle;94 ℃,30 s,58 ℃,30 s,72 ℃,60 s,30 cycles;72 ℃,10 min,1 cycle;15℃,∞。
1.2.5.3 1%琼脂糖凝胶电泳检测 PCR产物及回收。
1.2.6 NHX基因PCR产物TA克隆及鉴定
1.2.6.1 连接反应
Microtube管中配制下列连接反应液,总体系为10 μL。
连接反应液 :NHX,4.5 μL;pMD18T - Vector,0.3 μL;T4 DNA Ligase,0.2 μL;10 × T4 DNA Ligase Buffer,1.0 μL;ddH2O,4.0 μL。
16℃连接过夜,4℃放置,待转化 E.coli DH10B感受态细胞。
1.2.6.2 氯化钙法制备 E.coli DH10B 感受态细胞
1.2.6.3热激法转化重组 DNA1.2.6.4重组质粒构建
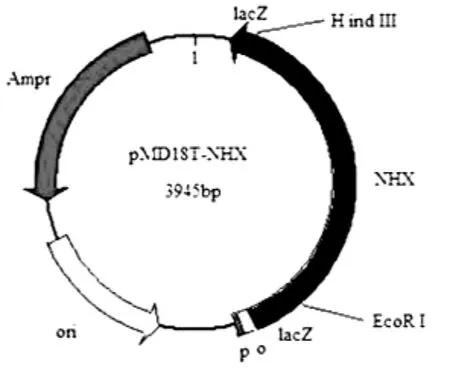
图1 pMD18T-NHX测序质粒图
测序质粒的构建利用的是 pMD18T-Vector(TaKaRa),大小为2692 bp,目的基因大小为1253 bp,构建成功的质粒大小在3945 bp(图1)。
1.2.6.5 阳性克隆的鉴定
(1)PCR鉴定
(2)酶切鉴定:
1.2.7 NHX 基因测序
取经过PCR鉴定和质粒酶切鉴定均符合要求的阳性菌落做成穿刺管菌种寄送上海生物工程技术服务有限公司测序。
2 结果与分析
2.1 植物总RNA的提取
1%琼脂糖凝胶电泳检测花花柴总RNA结果如下:
图2中,泳道M为DNA Marker DL2000,泳道1和泳道2同为花花柴总RNA样品。
由电泳图可以看出,总RNA已提取到。点样孔有荧光,说明总RNA样品中存在蛋白质杂质。28 S与18 S条带比例基本接近2∶1,说明RNA完整性较好,可用于反转录实验。
2.2 1 st-cDNA的合成及Actin基因的克隆
1%琼脂糖凝胶电泳检测Actin基因片段PCR扩增产物,结果如图3。图3中M为DNA Marker DL2000,泳道1为花花柴Actin基因片段。

图2 花花柴总RNA

图3 花花柴Actin基因片段

图4 扩增目的条带

图 5NHX基因片段TA克隆质粒
由图可以看出,花花柴已扩增到预期的598 bp的Actin基因片段,说明反转录合成1st-cDNA已成功。
2.3 PCR扩增NHX基因
1%琼脂糖凝胶电泳检测结果显示扩增到预期的1253 bp的目的片段。
由图4可以看到,已成功克隆到1253 bp的目的条带。
2.4 NHX基因片段的TA克隆
2.4.1 1%琼脂糖凝胶电泳检测TA克隆质粒如图5。

图6 NHX基因片段TA克隆质粒PCR鉴定
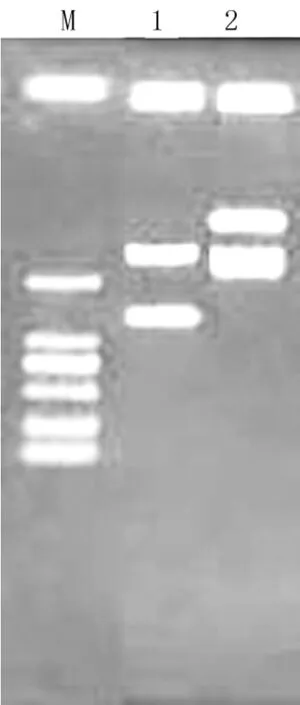
图7 酶切鉴定结果
图5中,泳道2为花花柴NHX基因片段TA克隆质粒。从图5可以看出,TA克隆质粒已成功提取到。
2.4.2 PCR鉴定 TA克隆质粒,如图6中,M 为DNA Marker DL2000泳道1,2为花花柴NHX基因片段TA克隆质粒PCR鉴定结果。从图6中可以看出,花花柴NHX基因片段TA克隆已成功。
2.4.3 酶切鉴定图
图7为克隆质粒的酶切鉴定图,泳道1-酶切质粒,泳道2-重组质粒。酶切结果显示克隆成功。
2.5 花花柴NHX测序结果同源性比对
将花花柴 (Kareliniacaspaca,NHX),(Karelinia caspaca,NHX1),矮牵牛 (Petunia xhybrida,PhNHX1),牵牛花(Ipomoeanil,InNHX1),胡杨(Populus euphratica ,NHX1),拟南芥(Arabidopsis thaliana,AtNHX1),水稻 (Oryza sativa,OsNHX1),盐角草 (Salicornia europaea,SeNHX1),大肠杆菌 (Escherchia coli,NhaA/NhaB),大麦 (Hordeum vulgare,HvNHX1),盐爪爪(Kalidiumfoliatum),酵母(Saccharomyces cerevisiae,Nhap1),灰绿藜(Chenopo diumglaucum, CgNHX1), 人(Homosapiens,NHE2)的核酸序列利用生物学软件DANMAN对测序结果进行同源性比对分析,发现获得的基因与GeneBank上已经提交的花花柴(Karelinia caspaca,NHX2)同源性高达81%。与盐角草、盐爪爪高耐盐植物同源性达到68%,从基因的同源性比对分析来看本实验克隆得到的是一个与已提交的NHX序列不同的新的序列。
2.6 构建NHX基因的进化树
将测序结果与GeneBank中提交的Na+/H+逆向转运蛋白基因用DNAMAN构建系统进化树,以大肠杆菌NHX基因作为外群,以大麦、水稻为代表的禾本科植物NHX基因与以灰绿藜、盐角草、盐爪爪为代表的藜科植物和茄科植物牵牛花等相比,在进化关系上更为原始。花花柴的NHX基因与茄科植物NHX基因处于同一个进化分支,具有相近的亲缘关系。本试验研究所得到的花花柴基因与NCBI中已提交的花花柴NHX1、NHX2也存在细微差异,导致这种差异的结果可能是由不同地域环境下的个体差异所造成。
2.7 翻译获得氨基酸序列
对测序结果利用DNAMAN进行翻译获得氨基酸序列。KcNHX的蛋白高度保守区均包括一个特殊的序列LFFIYLLPPI(图8中加粗倾斜下划线部分),此序列已被证明在动植物的Na+/H+反向运输体蛋白氨基酸组成中具有高度保守性,为氨氯吡嗪咪结合位点。
将本实验获得的核酸序列利用DNAMAN进行翻译成氨基酸序列,同花花柴(Karelinia caspaca,NHX1,DQ303231,NHX2,),拟南芥 (Arabidopsis thaliana,AtNHX1),牵牛花 (Ipomoeanil,InNHX1),胡杨(Populus euphratica,NHX1),水稻(Oryza sativa,OsNHX1),盐角草 (Salicornia europaea ,SeNHX1),大麦 (Hordeum vulgare,HvNHX1),灰绿藜(Chenopo diumglaucum ,CgNHX1)的氨基酸序列进行同源性比对结果。比对结果显示一致性达到了68.77%,证明本次克隆得到的序列较好,可以用于构建植物表达载体进行相应的功能鉴定。
3 讨论
3.1 植物逆向转运蛋白功能
NHX(Na+/H+antiporter)是液泡膜上的一种Na+/H+反向运输体,能够将细胞质中大量的Na+转运入细胞质,减轻盐胁迫对植物的损害。已有的研究表明,拟南芥、油菜和番茄中过量表达 At-NHX1,可在液泡膜中积累大量的运输体,极大地提高了它们的耐盐性[3]。Na+/H+逆向转运蛋白基因的表达还具有组织特异性。如NaCl胁迫下,拟南芥的AtNHX1基因在叶中的转录水平比对照高出4倍,而根中的转录水平则与对照几乎没有差异[2]。由于植物RNA表达具有时空特异性,根据相关文献,菊科植物在其叶片中NHX的表达量受盐胁迫变化最大。所以本研究直接采用经过盐胁迫处理的幼嫩花花柴叶片作为实验材料。
3.2 PCR扩增耐盐相关基因NHX
PCR扩增NHX基因过程中常遇到如下问题:一、引物与模板的互补性不好;二、退火温度太低,非特性条带很多。多次PCR结果表明,本研究所用的引物与模板的互补性不是很理想,PCR结果常常是没有任何条带。经多次探索发现,增大反应体系致50 μL,提高退火温度,可以提高PCR的特异性。

图8 翻译获得氨基酸
3.3 NHX基因片段的TA克隆
3.3.1 用于TA克隆的大肠杆菌菌株容易退化或突变,必须定期对其进行分离纯化。一般情况下,每半年即需对保存的菌种进行一次纯化。通常采用蘸取甘油菌在平板上进行划线分离,挑取单菌落接种液体培养基制成菌悬液后制备新的甘油菌菌种。划线分离可多次重复进行以便筛选活力较高菌株。
3.3.2 DNA重组必须在16℃的环境中进行,连接时间以10~12 h为宜,转化前在4℃环境中放置15 min,以便重组DNA能够形成稳定的cccDNA结构,才能在宿主菌细胞中稳定存在。
3.3.3 本研究采用将重组DNA转化到生长活性更高的DH10B细胞中,利用抗生素筛选克隆,最后,根据T载体上M13引物序列采用PCR鉴定阳性克隆。实验结果表明,选用DH10B作为宿主菌可缩短实验时间约12 h,采用M13-PCR能更有效的鉴定阳性克隆,同时克隆质粒可用于测序等其他实验。
3.4 序列分析
KcNHX的蛋白高度保守区均包括一个特殊的序列LFFIYLLPPI,此序列已被证明在动植物的Na+/H+反向运输体蛋白氨基酸组成中具有高度保守性,为氨氯吡嗪咪结合位点(氨基酸序列翻译结果),这表明KcNHX确实属于NHX基因家族的不同成员,在植物体内可能行使着不同的生理功能。此外,KcNHX与已克隆注册的盐生植物NHX基因同源性相差较远。分析原因可能是由于种属的差异性及其耐盐机制的特异性,灰绿黎(Chenopodium glaucum)属于非肉质化的泌盐生植物,盐角草(Salicorniaeuropaea),盐爪爪(Kalidium foliatum)属于真盐生植物,它们均属于黎科。而花花柴属于肉质化的泌盐生的菊科植物,NHX基因在这些植物不同的耐盐机制中也许起着不同作用。
4 结论
4.1 本研究已成功提取了盐生植物花花柴总RNA,并合成了1st-cDNA,成功克隆了花花柴的Actin基因片段,并从1st-cDNA中成功克隆到NHX基因,大小为1253 bp。将其与GeneBank中已经 提 交 的Kareliniacaspaca,NHX1,NHX2;
Arabidopsisthaliana, AtNHX1;Ipomoeanil,InNHX1;Populus euphratica,NHX1;Oryza sativa,OsNHX1;Salicornia europaea,SeNHX1;Hordeum vulgare,HvNHX1;Chenopo diumglaucum ,CgNHX1的氨基酸序列进行同源性比对。结果显示一致性达到68.77%,可以用于构建植物表达载体进行相应的功能鉴定。
4.2 目前约有超过200个编码Na+/H+反向运输载体(Na+/H+hydrogen exchangers NHEs)已经在GeneBank和Pfam的数据库中注册,该Na+/H+反向运输载体广泛存在于自然界各种生物,如原核生物霍乱弧菌(Tlibrio cholerae),大肠杆菌(E.coli),酵母,各类植物等,其主要可分为以下两种:定位于质膜上的一类和定位于胞质内膜系统(如内质网,线粒体及植物中液泡)的一类。本研究所克隆的NHX基因属于后一类型,且已被报道在多种植物中存在,如拟南芥NHX基因家族AtNHX-6,水稻OsNHX1,盐角草SeNHX等,这些植物分别属于中生植物,甜土植物和盐生植物。
4.3 盐胁迫对植物的伤害主要来自2个方面:一是较高的盐分降低了土壤水势,从而抑制植物根系的吸水,引发渗透胁迫;二是过量的盐分进入植物细胞后,会破坏细胞质的离子平衡,产生离子毒害[3]。其中,离子胁迫效应是又高盐分直接引起的,为盐胁迫所特有。因此,如何消除离子胁迫效应就成为了了解植物耐盐性机理和培育耐盐植物的关键。已有证据表明,这一过程主要是盐离子的区隔化、盐离子的外排和减少盐离子的吸收等生理机制实现的[5]。其中,盐离子的区隔化是盐生植物消除离子胁迫效应的核心机制,这一机制有位于液泡膜上H+-ATPase、H+-PPase 和 NHX 蛋白的建立的[4]。大量研究表明,过量表达NHX基因可以提高植物的耐盐性[6,7],说明NHX 基因是赋予植物耐盐性的主要因素,具有广泛的研究价值。本研究得到了花花柴NHX基因的cDNA片段,为进一步分离该基因的全长序列奠定了基础。对NHX基因的深入分析,不仅有利于了解花花柴的耐盐性机理,有助于为耐盐基因育种工作提供新的耐盐基因资源。
[1]马清,周向睿,伍国强,王锁民.盐生植物植物碱蓬Actin基因片段的克隆及序列分析[J].生物技术,2009,19(1):1-3.
[2]Quintero F J,Batt M R ,Pardo J M.Fuctional conservation between yeast and plant endosomal Na+/H+antiporters[J].FEBS Letter,2000 ,471:224 -228.
[3]王艳,曾幼玲,贺宾,等.农杆菌介导NHX基因转化甘蓝型油菜的研究[J].作物学报,2006,32(2):278-282.
[4]MUNNS R.Genes and salt tolerance:bringing them together[J].New Phytol,2005,167(3):645 - 663.
[5]TESTER M,DAVENPORT R.Na+tolerance and Na+transport in higher plants[J].Ann B OT(lond),2003,91(5):503-527.
[6]ZHANG G H,SU Q,AN L J,et al.Characterization and expression of a vacuolar Na+/H+antiporter gene from the monocot halophyte Aeluropus littoralis[J].Plant Physiol Biochem,2008,46(2):117 -126.
[7]RUKUDA A,NAKAMURA A,TAGIRI A.Function,intracellular localization and the importance in salt tolerance of a vacuolar Na+/H+antiporter from rice[J].Plant Cell Physiol,2004,45(5):600 -607.
