鞘内注射巴氯酚对神经病理性痛大鼠的镇痛作用及其对脊髓GABA转运体-1的影响
2011-12-08朱珊珊谭珊珊曾因明
朱珊珊,谭珊珊,,曾因明
巴氯酚(baclofen,Bac)是 GABAB受体的激动剂,在脊髓的中间神经元可产生突触前和突触后抑制效应。在行全膝关节置换术的患者鞘内使用巴氯酚,可减少阿片类药物的用量和慢性疼痛的形成[1]。目前的研究认为,巴氯酚的镇痛作用可能与其促进抑制疼痛信息传递的递质如GABA、内啡肽的释放有关[2],但具体机制还不清楚。GABA转运体(GABA transporter,GAT)能够高效地将突触间隙的GABA转运回细胞内,从而终止GABA的突触后效应,因此GAT数目和功能的改变将直接影响间隙内GABA的含量。已有研究表明,大鼠脊髓水平GAT-1表达的上调参与神经病理性疼痛的形成。巴氯酚的镇痛作用是否与其对GAT-1的影响有关,目前还不清楚。因此,本研究在坐骨神经结扎致神经病理性痛大鼠模型上,采用行为学、免疫组织化学和Western blot方法,观察鞘内应用GABAB受体激动剂巴氯酚对神经病理性痛大鼠触诱发痛、热痛敏等特征性痛觉行为学反应和脊髓GAT-1蛋白表达的影响,以探讨巴氯酚对神经病理性痛的镇痛作用及其可能机制。
1 材料与方法
1.1 神经病理性疼痛动物模型的制备 慢性坐骨
神经结扎损伤(chronic constriction injury,CCI)致神经病理性痛大鼠模型[3]的制备 SD♂大鼠,(250±20)g,饲养1周。戊巴比妥钠40 mg·kg-1腹腔注射后,选择左侧后肢,消毒皮肤,切开皮肤,分离皮下及肌肉,暴露坐骨神经,以3-0丝线相隔1 mm松结扎4道,直到神经外膜稍稍收压为止,打结时可见左下肢肢体轻微抽动。逐层缝合。假手术组步骤与神经结扎大鼠相同,但只暴露神经,而不加结扎。
1.2 鞘内给药方法 将大鼠头置于麻醉箱内,吸入0.4 ml异氟烷。一手定位大鼠L5-6腰椎棘突,16 G粗针破皮,另一手持25 μl微量注射器,按 Mestre等[4]报道的方法刺入蛛网膜下腔,出现典型鼠尾侧向甩动和抖动视为穿刺成功。药物均溶于10 μl生理盐水中,于10 s内推完。停止吸入异氟烷后动物将在1 min内恢复翻正反射。巴氯酚〔R(±)baclofen〕购自美国Sigma公司。
1.3 动物分组 行为学实验部分,采用结扎大鼠左侧坐骨神经的方法建立神经病理痛模型,神经结扎后d 3出现痛觉过敏的大鼠32只随机分为4组(n=8):Bac1组、Bac2组、Bac3组、NS组,鞘内分别注射10 μl的 0.1、0.3、1.0 μg 巴氯酚、生理盐水。分别于给药前、给药后 0.5、1、2、4、8、12、24 h 测大鼠机械刺激缩足反射阈值(mechanical withdrawl threshold,MWT)和热刺激缩足反射潜伏期(thermal withdrawl latency,TWL)以及运动功能。免疫组织化学实验部分,大鼠分为NS组与Bac组,鞘内分别给予0.3 μg 巴氯酚(10 μl)或生理盐水10 μl,分别于给药前、给药后1、4、8 h取大鼠脊髓腰段,用免疫组织化学方法检测脊髓节段GAT-1免疫阳性染色的灰度值。Western blot实验部分,SD大鼠分为NS组与Bac组,鞘内分别给予 0.3 μg巴氯酚(10 μl)或生理盐水10 μl,分别于给药前、给药后30 min、1、2、4、8、12 和 24 h 取大鼠脊髓腰段,用 Western blot方法测定脊髓节段GAT-1蛋白含量。
1.4 行为学指标的测定
1.4.1 机械缩足反射阈值(mechanical withdrawl threshold,MWT)的测定 按Chaplan等[5]报道方法测定MWT。置大鼠于透明的有机玻璃箱中,底为(0.5×0.5)cm2的铁丝网。实验前使之适应30 min。以不同折力(buckling force)的Von Frey纤毛(Stoelting公司,美国)刺激大鼠足底。从2.0 g开始,以up-down法推测阈值,并在阈值上下各刺激5次,用内推法算出50%反应阈值(即引起5次试验中2.5次反应的值)。最大折力为15 g,大于此值时记为15 g。每次实验至少间隔15 s,并等刺激引起的行为反应(如舔足等)完全消失后再给予下一次刺激。
1.4.2 热缩足反射潜伏期(thermal withdrawl latency,TWL)的测定 将有机玻璃箱置于3mm厚的玻璃板上,将大鼠放入有机玻璃箱内,使其自由活动30 min以适应测试环境和温度。室温稳定在25℃±1.0℃。按 Hargreaves等[6]法用 BME-410A 型热痛刺激仪(中国医学科学院生物医学研究所制作)照射大鼠足底。照射开始至大鼠出现抬腿回避时间为TWL。刺激部位为紧贴玻璃板的后爪部分。当后爪移动时,停止照射。照射自动切断时间为20 s,以防止组织损伤。整个实验中,热刺激强度保持相同。重复刺激5次,取后3次TWL的平均值[7]。
1.4.3 运动功能评分 为了评定和排除药物对大鼠运动功能的影响,给药后观察动物运动情况并根据下述情况进行评分[8]:0分:没有运动改变,正常的行走;1分:轻度运动功能减弱,对足底的刺激缩爪反应正常;2分:自主活动减弱,中度运动功能减弱,正常行走,对足底的刺激有缩爪反应,但减弱;3分:不能自主活动,不能行走,对足底的刺激没反应。评分≥2,表示有明显的运动功能障碍。
1.5 免疫组织化学染色 大鼠在戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉下行左心室穿刺灌注,取腰段脊髓,4%多聚甲醛后固定。行连续冰冻切片,切片厚度为40 μm,每间隔5张取1张,收集在0.01 mol·L-1PBS液中。切片冲洗孵育后,加入GAT-1一抗(1∶300)。4℃孵育48 h后用PBS洗去未结合的一抗,顺序加入工作液。以上各步骤均用0.01 mol·L-1PBS彻底漂洗切片,最后用即用型DAB显色,干燥,脱水,透明,中性树胶封片。每只动物随机取脊髓片3张,高倍镜下以Olympus DP11数码相机在脊髓背角截取一屏,以Leica图像分析系统对上述部位GAT-1的染色灰度进行分析。
1.6 Western blot 戊巴比妥钠麻醉大鼠,取腰段脊髓放入液氮中冷冻保存备用。提取胞膜蛋白,取40 μg蛋白样本SDS聚丙烯酰胺凝胶上电泳,然后电转至硝酸纤维素膜上,与GAT-1一抗(1∶300)孵育过夜,加入兔二抗(1∶500),孵育冲洗,用NBT/BCIP进行呈色反应,反应条带进行定量分析。
2 结果
各组大鼠基础 MWT分别为:(13.2±1.7)g、(12.9±1.9)g、(13.5±1.4)g、(13.4 ±1.5)g;基础TWL分别为:(14.2±3.9)s、(15.4±4.0)s、(16.1±3.8)s、(15.5 ±4.3)s。坐骨神经结扎后 d 3,各组大鼠的MWT分别降低为:(4.2±2.1)g、(4.9±2.7)g、(4.5±1.7)g、(4.5±1.7)g;TWL 分别缩短为:(6.8 ±2.4)s、(6.6 ±1.6)s、(7.4 ±1.9)s、(7.42±2.7)s;均明显低于各自的基础值(P<0.01)。
2.1 鞘内注射巴氯酚对坐骨神经松结扎致神经病理性痛大鼠MWT和TWL的影响 鞘内分别注射0.1、0.3、1 μg 巴氯酚后0.5 ~2 h,Bac1 组、Bac2 组与Bac3组大鼠MWT和TWL均较NS组明显升高(P <0.01,P <0.05),鞘内给药后4 h,Bac2与 Bac3组大鼠MWT和TWL仍较 NS组明显升高(P<0.01,P<0.05),但Bac1组与NS组相比无差别(P>0.05),给药后 8 h,Bac1组与 Bac2组 MWT与TWL均降至给药前水平,但Bac3组MWT与TWL仍高于NS组(P>0.05)。见Tab 1,2。
2.2 鞘内注射巴氯酚对坐骨神经结扎致神经病理性痛大鼠运动功能的影响 鞘内分别注射0.03、0.3 μg巴氯酚后,大鼠均能保持自主活动,对足底的刺激反应灵敏,运动功能评分均为0或1。鞘内注射1 μg巴氯酚后,在该实验组的8只动物中有5只大鼠出现不同程度的自主运动障碍,运动功能评分均≥2,持续时间约为15~30 min。
2.3 鞘内注射巴氯酚对坐骨神经结扎致神经病理性痛大鼠脊髓背角GAT-1免疫阳性神经元的影响
与NS组比较,鞘内注射0.3μg巴氯酚后1、4 h,大鼠脊髓背角浅层GAT-1免疫阳性染色灰度值明显降低(P<0.01,P<0.05);给药后8 h,Bac组脊髓背角浅层GAT-1染色灰度虽然降低,但与NS组相比差异无统计学意义(P>0.05)。见Fig 1。
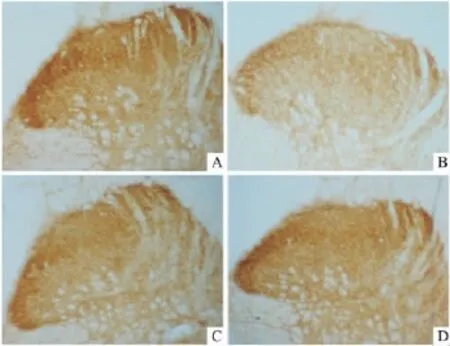
Fig 1 Effects of intrathecal injection of baclofen on the expression of GAT-1 in spinal cord of neuropathic rats with chronic constriction injury(×100)
2.4 鞘内注射巴氯酚对坐骨神经结扎致神经病理性痛大鼠脊髓GAT-1蛋白含量的影响 与NS组和给药前比较,鞘内注射0.3 μg巴氯酚后0.5~4 h,大鼠脊髓节段的GAT-1蛋白含量均明显降低(P<0.01,P <0.05),至给药后 8 h,GAT-1 的表达逐渐增多,与NS组和给药前相比差异均无统计学意义(P>0.05)。见Tab 3。
3 讨论
目前认为,巴氯酚可激活突触前GABAB受体使背根节C及Aδ纤维传入神经动作电位时程缩短,Ca2+电流减小,复极化过程加快,一方面可抑制致痛物质,如P物质、谷氨酸等兴奋性氨基酸的释放;另一方面,巴氯酚可促进抑制疼痛信息传递的递质如GABA、内啡肽的释放。但目前还不清楚巴氯酚促进GABA释放的机制。
Tab 1 Effects of intrathecal injection of baclofen on mechanical withdrawl threshold in neuropathic rats with chronic constriction injury(g,¯±s,n=8)
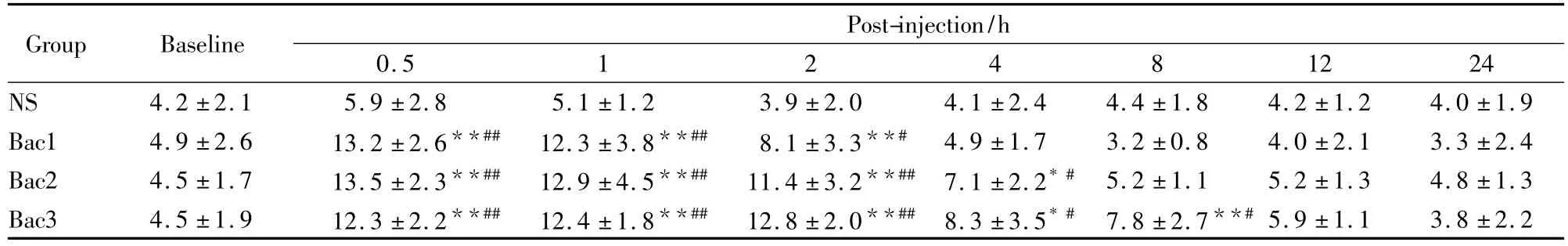
Tab 1 Effects of intrathecal injection of baclofen on mechanical withdrawl threshold in neuropathic rats with chronic constriction injury(g,¯±s,n=8)
*P <0.05,**P <0.01 vs NS group;#P <0.05,##P<0.01 vs the baseline values
0.5 1 2 4 8 12 24 NS 4.2 ±2.1 5.9 ±2.8 5.1 ±1.2 3.9 ±2.0 4.1 ±2.4 4.Group Baseline Post-injection/h 4 ±1.8 4.2 ±1.2 4.0 ±1.9 Bac1 4.9 ±2.6 13.2 ±2.6**## 12.3 ±3.8**## 8.1 ±3.3**# 4.9 ±1.7 3.2 ±0.8 4.0 ±2.1 3.3 ±2.4 Bac2 4.5 ±1.7 13.5 ±2.3**## 12.9 ±4.5**## 11.4 ±3.2**## 7.1 ±2.2*# 5.2 ±1.1 5.2 ±1.3 4.8 ±1.3 Bac3 4.5 ±1.9 12.3 ±2.2**## 12.4 ±1.8**## 12.8 ±2.0**## 8.3 ±3.5*# 7.8 ±2.7**#5.9 ±1.1 3.8 ±2.2
Tab 2 Effects of intrathecal injection of baclofen on the thermal withdrawl latency in neuropathicrats with chronic constriction injury(s±s,n=8)

Tab 2 Effects of intrathecal injection of baclofen on the thermal withdrawl latency in neuropathicrats with chronic constriction injury(s±s,n=8)
*P <0.05,**P <0.01 vs NS group;#P <0.05,##P<0.01 vs the baseline values
24 NS 6.8 ±2.4 5.2 ±2.2 7.1 ±1.5 6.4 ±2.5 7.3 ±2.7 6.Group Baseline Post-injection/h 0.5 1 2 4 8 12 3 ±1.9 6.8 ±1.3 7.7 ±2.5 Bac1 6.5 ±1.6 18.2 ±4.2**## 11.67 ±3.7**## 9.1 ±1.8*## 6.4 ±2.2 5.7 ±1.5 6.2 ±2.6 6.9 ±2.2 Bac2 7.4 ±1.9 17.5 ±4.0**## 18.2 ±5.3**## 15.9 ±3.8**## 10.9 ±2.8*# 7.0 ±1.8 7.4 ±1.5 6.5 ±1.6 Bac3 7.4 ±2.7 16.8 ±3.7**## 17.9 ±4.8**## 16.6 ±4.2**## 13.6 ±3.3**##10.8 ±2.3**#8.6 ±1.9 6.6 ±3.1
Tab 3 Effects of intrathecal injection of baclofen on the expression of GAT-1 proteinin spinal cord of neuropathic rats with chronic constriction injury(%of Baseline,¯ ± s,n=4)

Tab 3 Effects of intrathecal injection of baclofen on the expression of GAT-1 proteinin spinal cord of neuropathic rats with chronic constriction injury(%of Baseline,¯ ± s,n=4)
**P<0.01 vs NS group;△P<0.05,△△P<0.01 vs the baseline values;##P<0.01 vs Pre-injection values
Group Baseline Pre-injection Post-injection/h 0.5 1 2 4 8 12 24 NS 100±0 179±29△△ 172±18△△ 165±23△△ 181±35△△ 175±26△△ 168±27△△ 174±25△△ 169±24△△Bac 103±24 182±31△△ 116±17**##95±16**## 107±19**##100±23**## 149±21△ 159±26△ 165±30△
本实验在坐骨神经结扎致痛觉过敏大鼠鞘内给予巴氯酚,能抑制大鼠的触诱发痛和热痛觉过敏,其镇痛效应的持续时间随剂量的增加而延长,0.3 μg巴氯酚可提供至少4 h的镇痛。在本实验所用的三个剂量中,1.0 μg的巴氯酚虽然镇痛效应持续时间较其它两个剂量的作用时间长,但是其对大鼠的运动功能影响较大。在该实验组中,部分大鼠的运动功能评分≥2,出现了不同程度的自主运动障碍和对足底刺激反应降低,表明大剂量的GABAB受体激动剂对大鼠的运动功能有一定影响,这也是GABAB受体激动剂用于临床镇痛受限制的原因之一。
在本实验中,鞘内给予0.3 μg巴氯酚后,大鼠脊髓背角浅层GAT-1样免疫阳性染色灰度明显降低,表明GAT-1的表达明显减少,且与NS组及给药前比较差异均有统计学意义(P<0.05)。0.3μg巴氯酚使GAT-1表达减少的效应持续至给药后4 h,至给药后8 h,脊髓背角浅层GAT-1的表达逐渐升高,但与对照组相比差异无统计学意义,这与该剂量在神经病理性痛大鼠模型上的镇痛效应持续时间是一致的,提示鞘内注射巴氯酚可能通过调节脊髓水平GAT-1的表达来发挥镇痛作用。最近有研究发现[9],GAT可与钙/钙调蛋白依赖激酶Ⅱ以及谷氨酸脱羧酶(GAD)形成复合体,共同调节GABA的合成与释放。Kang等[10]研究证实,在沙土鼠的海马,GABAB受体的激活可使囊泡GABA转运体(VGAT)减少,减少突触前GABA的释放,增加突触间隙GABA的含量。因此推测在本实验中,巴氯酚可能通过激活了突触前的自身 GABAB受体,使脊髓背角GAT-1的含量降低,减少GABA的重摄取,进而增加突触间隙GABA的含量,从而抑制疼痛信息的传递。
综上所述,鞘内注射GABAB受体激动剂巴氯酚可减轻坐骨神经结扎致神经病理性痛大鼠的痛觉过敏,其镇痛作用可能与抑制脊髓水平GABA转运体-1的表达有关。
[1] Sanders J C,Gerstein N,Torgeson E,Abram S.Intrathecal baclofen for postoperative analgesia after total knee arthroplasty[J].J Clin Anesth,2009,21(7):486-92.
[2] Chung K M,Kim Y H,Song D K,et al.Differential modulation by baclofen on antinociception induced by morphine and beta-endorphin administered intracerebroventricularly in the formalin test[J].Neuropeptides,1999,33(6):534 -41.
[3] 马 骋,李翠贤,易建良,闫丽萍.不同材料制备大鼠神经病理性疼痛CCI模型的比较[J].中国药理学通报,2008,24(4):555-7.
[3] Ma C,Li C X,Yi J L,Yan L P.Comparision of the chronic constriction injury of the sciatic nerve(CCI)models performed by different materials in neuropathic pain of rats[J].Chin Pharmacol Bull,2008,24(4):555 -7.
[4] Mestre C,Pelissier T,Fialip J,et al.A method to perform direct transcutaneous intrathecal injection in rats[J].J Pharmacol ToxicolMethods,1994,32(4):197 -200.
[5] Chaplan S R,Bach F W,Pogrel J W,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J NeurosciMethods,1994,53(1):55-63.
[6] Hargreaves K,Dubner R,Brown F,et al.A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia[J].Pain,1988,32(1):77 -88.
[7] 孙焱芫,罗 层,李 震,陈 军.鞘内注射孤啡肽对大鼠足底注入蜜蜂毒诱致长时程自发痛、痛敏和炎症的不同效果[J].生理学报,2004,56(3):321-7.
[7] Sun Y Y,Luo C,Li Z,Chen J.Differential actions of intrathecal nociceptin on persistent spontaneous nociception,hyperalgesia and inflammation produced by subcutaneous bee venom injection in conscious rats[J].Acta Physiol Sin,2004,56(3):321 -7.
[8] Hwang J H,Yaksh T L.The effect of spinal GABA receptor agonists on tactile allodynia in a surgically-induced neruopathic pain model in the rat[J].Pain,1997,70(1):15 - 22
[9] Jackson M F,Esplin B,Capek R.Reversal of the activity-dependent suppression of GABA-mediated in hippocampal slices from gamma-vinyl GABA(vigabatrin)-pretreated rats[J].Neurophamacology,2000,39(1):65-74.
[10] Kang T C,Park S K,Hwang I K,et al.Presynapticγ-aminobutyric acid B receptor-mediated regulation of vesicularγ-aminobutyric acid transporter expression in the gerbil hippocampus[J].Neurosci Lett,2003,346(1-2):49 -52.
