眼镜蛇毒细胞毒素对人肝癌细胞增殖抑制活性及作用机制的研究
2011-12-08林礼务陈志奎薛恩生俞丽云
王 艳,林礼务,陈志奎,薛恩生,杨 菁,俞丽云
眼镜蛇毒是一类天然毒性物质,含有多种蛋白质、多肽、酶类等,具有广泛的生物学活性。其中眼镜蛇毒细胞毒素(cobra venom cytotoxin,CTX)是眼镜蛇毒的主要成分之一,是一类既具有心脏毒性,又具有细胞毒性尤其是对肿瘤细胞有毒性的组分,在抗肿瘤方面具有一定的应用前景。诱导肿瘤细胞凋亡是许多化疗药物发挥抗肿瘤作用的主要机制。我们采用CTX在体外作用于人肝癌细胞BEL-7404,从分子水平观察CTX对人肝癌细胞的凋亡作用以及对线粒体及细胞质细胞色素C的影响,探讨CTX的抗癌机制,从而为CTX治疗肝癌提供更充足的理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞株 人肝癌细胞系BEL-7404(由福建省肝胆外科研究所惠赠)。
1.1.2 主要试剂 CTX由本研究所从中华眼镜蛇毒粗毒(广州新源蛇毒公司)中分离纯化而得[1];BCA蛋白测定试剂盒(碧云天生物技术公司);胎牛血清(杭州四季青生物工程公司);RPMI 1640培养基、胰蛋白酶(Gibco公司);小鼠抗人Cytochrome C,β-actin单克隆抗体,兔抗人 caspase-3、-9多克隆抗体,辣根过氧化物酶标记的羊抗小鼠二抗、兔抗小鼠二抗(Santa Cruz公司产品);caspase-3、-9活性检测试剂盒(碧云天生物技术研究所产品)。
1.2 方法
1.2.1 细胞增殖试验与光镜观察 将BEL-7404细胞制备成单细胞悬液,以1×109·L-1浓度接种于96孔板(每孔100 μl),每孔加入用完全培养基配制成终浓度为0.5、1、2 和3 mg·L-1的眼镜蛇毒细胞毒素200 μl,对照组加入等量完全培养液,每个药物浓度设3个平行孔,药物作用12、24和48 h后,MTT法[2]检测细胞增殖活性,并计算细胞增殖抑制率(%)和半数抑制浓度(IC50)。并在显微镜下观察细胞形态改变。
1.2.2 肿瘤细胞凋亡检测 用末端脱氧核糖核酸转移酶介导的dUTP缺口末端标记法(TUNEL)标记凋亡细胞。收集肿瘤细胞,分3个组,分别为生理盐水组、CTX 1 mg·L-1组和 CTX 3 mg·L-1组,作用时间为24 h。结果判定:凋亡阳性细胞的细胞核出现棕黄色颗粒。400倍高倍显微镜下,随机观察5个视野,每个视野计数100个肿瘤细胞,计算出凋亡细胞的百分率。即凋亡指数(AI)/%=(TUNEL染色阳性细胞数/肿瘤细胞数)×100%。
1.2.3 透射电镜观察 收集分别经对照组及CTX 1 mg·L-1和 CTX 3 mg·L-1处理24 h 的 BEL-7404细胞各1×106个,3%戊二醛固定,2 500 r·min-1离心,去上清,细胞团经1%锇酸后固定、脱水、浸透、包埋、超薄切片、铀-铅复染后,透射电镜下观察。
1.2.4 caspase-3、-9 活性检测 收集分别经 0、1、2和3 mg·L-1的CTX处理24 h的BEL-7404细胞各1×106个,用试剂盒提供的裂解液悬浮,冰上孵育10 min,4 ℃、14 000 ×g离心1 min,收集上清,Bradford法进行蛋白定量,调整蛋白浓度为1×103mg·L-1,取检测缓冲液 80 μl加 caspase-3 或 caspase-9 10 μl,再加入 Ac-DEVD-ρNA(2 mol·L-1)10 μl后混匀,37℃遮光孵育1~2 h,发现颜色变化比较明显时即可测定A405。样品的A405扣除空白对照的A405,即为样品中caspase-3催化产生的ρNA的吸光度。通过标准曲线的对比就可以计算出样品中催化产生了多少量的ρNA。计算:活化倍数=试验组ρNA值/对照组ρNA值。
1.2.5 Western blot检测细胞色素 C 和 caspase-3、-9蛋白的表达 线粒体/细胞质蛋白提取:分别收集1和3 mg·L-1的CTX处理24 h的BEL-7404细胞,600×g离心5 min,弃上清,细胞沉淀用细胞质提取缓冲液重悬,Dounce匀浆器破碎细胞,700×g离心10 min,收集上清,10 000×g离心30 min,上清液为细胞质成分。沉淀为线粒体成分,用线粒体提取缓冲液重悬,涡旋混合器混合10 s。Bradford法对提取的蛋白进行定量,以40 μg蛋白上样量进行SDS-聚丙烯酰胺凝胶电泳,转膜,封闭,漂洗后一抗,二抗孵育,洗膜后加入显色剂显色。每个样本重复3次。
2 结果
2.1 眼镜蛇毒细胞毒素抗肿瘤细胞增殖作用 体外培养的人肝癌BEL-7404与眼镜蛇毒细胞毒素孵育后,部分细胞出现皱缩、变圆、脱落(Fig 1A),随着时间的延长和剂量的增大,坏死的细胞越来越多(Fig 1B),具有明显的剂量依赖效应和时间依赖效应。而对照组人肝癌BEL-7404却贴壁生长良好,仅个别细胞贴壁能力降低,漂浮起来(Fig 1C)。眼镜蛇毒细胞毒素对人肝癌BEL-7404细胞12、24和48 h 的 IC50分别为 2.56、1.94 和 1.35 mg·L-1,差异有统计学意义(P<0.05)。见Tab 1。
Tab 1 Cytotoxic effect of CTX on BEL-7404 in vitro ± s,%)
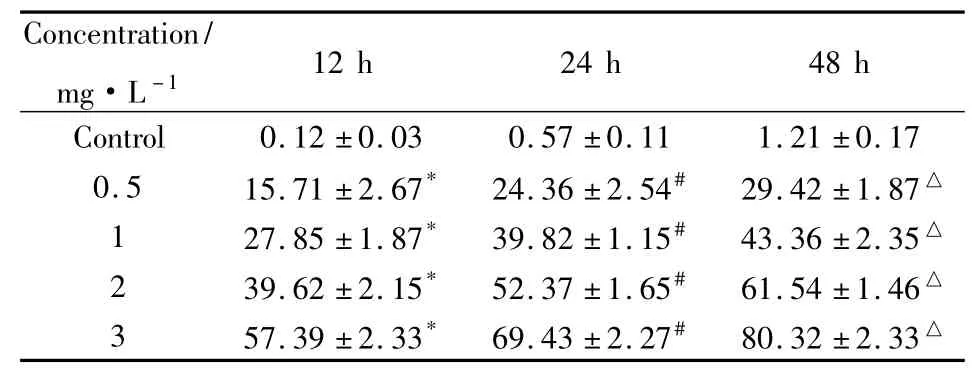
Tab 1 Cytotoxic effect of CTX on BEL-7404 in vitro ± s,%)
*P<0.05 vs control;#P<0.05 vs 12 h group;△P<0.05 vs 24 h group
Concentration/mg·L-112 h 24 h 48 h Control 0.12 ±0.03 0.57 ±0.11 1.21 ±0.17 0.5 15.71 ±2.67* 24.36 ±2.54# 29.42 ±1.87△1 27.85 ±1.87* 39.82 ±1.15# 43.36 ±2.35△2 39.62 ±2.15* 52.37 ±1.65# 61.54 ±1.46△3 57.39 ±2.33* 69.43 ±2.27# 80.32 ±2.33△
2.2 肿瘤细胞凋亡检测结果 生理盐水组TUNEL标记的阳性细胞数较少,AI值为5.3%,给药组TUNEL标记的阳性细胞数增多,CTX 1 mg·L-1组和CTX 3 mg·L-1组 AI值分别为 38.5%和77.8%。
2.3 透射电镜观察细胞凋亡形态学改变 透射电镜下观察对照组细胞细胞核形态规则,细胞膜完整,核仁清晰,染色质均匀分布于细胞核内,胞质内线粒体等细胞器清晰可见(Fig 2A)。给药组大部分肿瘤细胞出现典型的凋亡征象:如线粒体明显肿胀,部分溶解(Fig 2B),细胞膜皱缩、染色质固缩、核仁裂解为大小不均一的碎块(Fig 2C)。
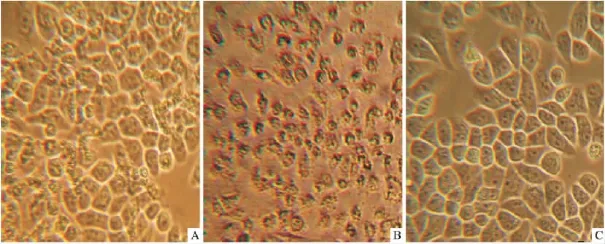
Fig 1 BEL-7404 proliferation inhibited by CTX in vitroA:BEL-7404 treated for 2 h;B:BEL-7404 treated for 48 h;C:control
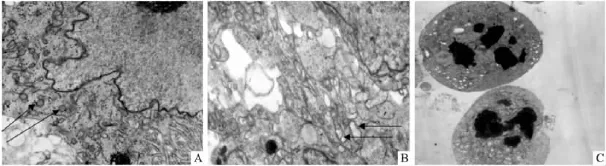
Fig 2 Apoptotic morphological changes of BEL-7404 treated by CTX
2.4 caspases酶活性的影响 给药组caspase-3,-9酶活性均有提高,且随着浓度的增加,活化的倍数随着提高,见Tab 2。
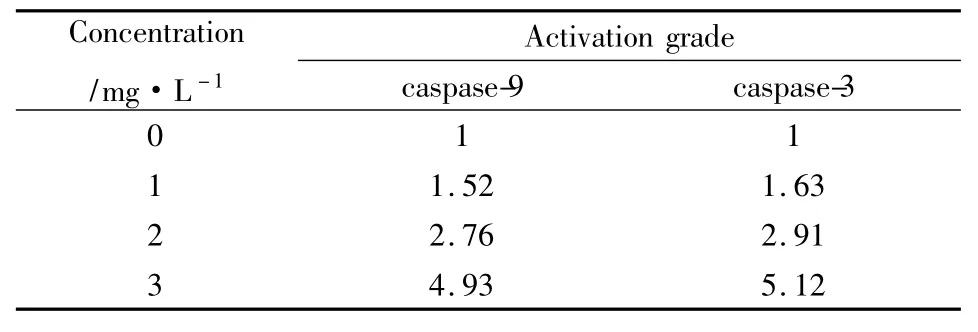
Tab 2 Enzyme activity of caspase-9,-3 increased by CTX in BEL-7404
2.5 Western blot检测结果
2.5.1 细胞色素C(Cytochrome C)分布变化 对照组线粒体内Cytochrome C表达较多,CTX组表达量较少,且3 mg·L-1剂量组与空白对照组相比更为明显。而细胞质内Cytochrome C表达则相反,对照组表达较少,CTX组表达量增加,且3 mg·L-1剂量组与空白对照组相比更为明显(Fig 3)。
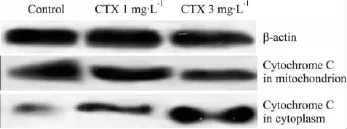
Fig 3 Expression of cytochrome C proteins in each group
2.5.2 caspase-3、-9蛋白的表达 对照组 caspase-3、-9蛋白仅少量表达,CTX组表达量增多,且3 mg·L-1剂量组与空白对照组相比更为明显(Fig 4)。
3 讨论
细胞凋亡是一种重要生物学过程,是由于内外环境变化或死亡信号触发,在相关基因调控下引起的细胞主动死亡过程。在细胞凋亡机制研究中,目前认为诱导细胞凋亡主要有两条途径:一条是死亡受体途径;另一条是线粒体凋亡途径[3]。线粒体在凋亡早期先于核或染色体的改变即出现结构和功能的变化,已研究证实线粒体膜通透性转运孔(MPTP)开放是细胞凋亡的重要环节[4-5]。在致凋亡因子的刺激下,细胞线粒体跨膜电位降低或丧失[6-7],线粒体释放细胞色素 C和凋亡诱导因子(AIF)至细胞质中[8-9],它们可与凋亡相关蛋白酶活化因子-1(Apaf-1)结合,在有脱氧三磷酸腺苷(dATP)存在的情况下,激活 Apaf-1[10],活化的Apaf-1可以结合caspase-9酶原而将其切割和活化。caspase-9处于caspase“瀑布式”激活的顶端,导致细胞凋亡过程的启动[11]。活化的caspase-9裂解后可激活caspase-3和下游众多的caspase蛋白酶级联反应。其中caspase-3被认为是级联反应中最关键的效应蛋白酶,是细胞凋亡蛋白酶级联反应的必经之路[12-13]。活化的caspase-3引起caspase级联反应,完成整个细胞凋亡和清除过程,包括DNA片段化、染色体固缩、细胞膜水泡样变、细胞皱缩并向内形成凋亡小体,最终引起染色体DNA及细胞的解体[14]。
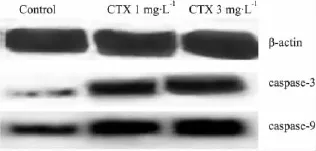
Fig 4 Expression of caspase proteins in each group
本研究中证实CTX具有较强的毒性作用,可诱导人肝癌细胞凋亡,且具有明显的剂量依赖效应和时间依赖效应。给药组线粒体明显肿胀,细胞色素C从线粒体释放到胞质增多,提示肿瘤细胞凋亡可能与线粒体参与的途径有关。给药组caspase-3、-9表达增加,酶活性明显增高均提示:caspase-3、-9参与了线粒体凋亡途径。我们认为CTX首先通过线粒体细胞色素C释放,进一步诱导效应性caspase-9、-3蛋白酶激活,最终诱导人肝癌细胞凋亡,这可能是其在体内产生抗肿瘤作用的机制之一。
[1] 陈志奎,林礼务,林 琦,等.眼镜蛇毒细胞毒素缓释微球制备及体外性质研究[J].中国生化药物杂志,2008,29(3):161-4.
[1] Chen Z K,Lin L W,Lin Q,et al.Preparation and characterization of poly(lactide-co-glycolide acid)microspheres containing cytotoxin from Naja Naja Atra venom[J].Chin J Biochem Pharmaceutics,2008,29(3):161 -4.
[2] 曹 波,雷志勇,陈虹新,等.新的微管抵制剂YB-13诱导HeLa细胞凋亡及其机制[J].中国药理学通报,2008,24(1):123-7.
[2] Cao B,Lei Z Y,Chen H X,et al.YB-13,a novel synthetic microtubule inhitor,induces apoptosis of HeLa cells and its mechanism[J].Chin Pharmacol Bull,2008,24(1):123 -7.
[3] Sinha I,Sinha-Hikim A P,Hannawa K K,et al.Mitochondrialdependent apoptosis in experimental rodent abdominal aortic aneurysms[J].Surgery,2005,138(4):806 -11.
[4] Dias N,Bailly C.Drugs targeting mitochondrial functions to control tumor cell growth[J].Biochem Pharmacol,2005,70(1):1-12.
[5] Lucken-Ardjomande S,Montessuit S,Martinou J C.Changes in the outer mitochondrial membranes during apoptosis[J].J Soc Biol,2005,199(3):207 -10.
[6] Ly J D,Grubb D R,Lawen A.The mitochondrial membrance potential(deltapsi(m))in apoptosis;an update[J].Apoptosis,2003,8(2):115-28.
[7] Armstrong J S.Mitochondrial membrance permeabilization:the sine qua non for cell death[J].Bioessays,2006,28(3):253 -60.
[8] Hong S J,Dawson T M,Dawson V L.Nuclear and mitochondrial conversations in cell death:PARP-1 and AIF signaling[J].Trends Pharmacol Sci,2004,25(5):259 -64.
[9] Yu W,Sanders B G,Kline K.RRR-alpha-tocopheryl succinateinduced apoptosis of human breast cancer cells involves Bax translocation to mitochondria[J].Cancer Res,2003,63(10):2483 -91.
[10]李 冰,褚现明,高美华,张学成.钝顶螺旋藻藻蓝蛋白诱导HeLa细胞凋亡的分子机制研究[J].中国药理学通报,2009,25(8):1045-50.
[10] Li B,Chu X M,Gao M H,Zhang X C.Study on the molecular mechanism of C-phycocyanin from Spirulina platensis induced apoptosis in HeLa cells[J].Chin Pharmacol Bull,2009,25(8):1045-50.
[11] Allan L A,Clarke P R.Apoptosis and autophagy:Regulation of caspase-9 by phosphorylation[J].FEBS J,2009,276(21):6063-73.
[12] Eldadah B A,Faden A I.Caspase pathways,neuronal apopotosis,and CNS injury[J].J Neurotrauma,2000,17(10):811 -29.
[13]费洪荣,肖 婷,陈 庚,等.告达庭对人胃癌细胞株SGC-7901细胞增殖和凋亡的调节作用[J].中国药理学通报,2010,26(10):1330-3.
[13] Fei H R,Xiao T,Chen G,et al.Effect of caudatin on cell proliferation and apoptosis in human gastric cancer cell line SGC-7901[J].Chin Pharmacol Bull,2010,26(10):1330 -3.
[14] Salvesen G S,Dixit V M.Caspases:intracellular signaling by proteolysis[J].Cell,1997,91(4):443 -6
