蜂毒素对人肝癌BEL-7402细胞增殖和VEGF、bFGF表达的影响
2011-11-29宋长城程彬彬凌昌全
宋长城,吕 祥,程彬彬,李 柏,凌昌全
血管新生与肿瘤的形成和转移关系密切[1]。在肿瘤血管生成过程中,肿瘤细胞与血管内皮细胞相互依赖生存[2]。血管内皮细胞产生的各种生长因子对肿瘤生长具有旁分泌作用。同时,肿瘤细胞又可分泌血管内皮细胞生存和增殖所需要的有丝分裂原和动力原。肝细胞癌 (hepatocarcinoma,HCC)是典型的富血管恶性肿瘤,血管新生化与其生长、浸润、转移、分期及预后有着密切联系。因此,阻断HCC血供的方法有望成为今后 HCC治疗的突破口[3]。蜂毒素 (Melittin,Mel)是从传统中药蜂毒中提取的一种小分子肽类物质。既往研究发现[4-5],它对多种肿瘤细胞的增殖具有较强的抑制作用,是一个十分具有应用前景的抗肿瘤天然药物。但有关Mel抑制肿瘤细胞合成和分泌促血管生成因子方面的研究鲜有报道。我们观察了Mel对人肝癌细胞株BEL-7402的增殖抑制作用,以及对其分泌促血管生长因子血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子(bFGF)的影响,现报道如下。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Mel(美国 Sigma公司,批号:104K4016);RPMI 1640培养基(美国Gibco公司);小牛血清 (杭州四季青公司);MTT(美国Sigma公司);兔抗人VEGF多克隆抗体和bFGF多克隆抗体(美国Santa Cruz公司);辣根过氧化物酶标记的羊抗鼠IgG(美国GenScript公司);SABC免疫组化试剂盒(武汉BOSTER公司);人VEGF和FGF-basic定量ELISA试剂盒(美国R&D systems公司);经典总RNA提取试剂盒、β-actin、VEGF和 bFGF引物(上海Sangon生物工程公司);Real-time PCR反应试剂盒(德国Roche公司)。
1.1.2 仪器 XDS-1B型倒置相差显微镜(Olympus,日本);Rotor-Gene RG-3000型荧光定量 PCR仪(Corbet Research,澳大利亚);Modle 500型酶联免疫检测仪 (Bio-Rad,美国)。
1.2 方法
1.2.1 细胞培养 人肝癌细胞株BEL-7402购自中国科学院上海细胞研究所。在37℃、5%CO2、饱和湿度条件下,于10% 小牛血清、100 U·L-1青霉素、100 mg·L-1链霉素的 RPMI 1640培养基中传代,实验用细胞均处于对数生长期。
1.2.2 MTT法检测药物体外抗肿瘤作用 取对数生长期BEL-7402细胞制成单细胞悬液,以每孔1×107·L-1接种于96孔培养板,培养24 h后换液,分别加入浓度为 0.5、1.0、2.0、4.0、8.0、16.0 mg·L-1Mel的培养基100 μl,同时设阴性对照组 (在含细胞的培养孔内加等量培养基)和空白对照组 (不接种细胞,仅加等量培养基)。每组设6个复孔。常规培养,分别在 24、48、72 h每孔加入 5 g·L-1MTT溶液 10 μl,孵育 4 h后吸去培养基,再加入150 μl DMSO于振荡器上振荡,待蓝色晶体完全溶解后,在酶标仪上测定A492nm值,并且计算增殖抑制率和半数抑制浓度(IC50)。
1.2.3 ELISA法检测细胞培养上清VEGF和bFGF含量 取对数生长期 BEL-7402细胞,以1×104·L-1接种于96孔板,细胞生长达饱和状态后更换为无血清培养基,同步培养12 h,分别加入含有终浓度为 2.0、4.0、8.0 mg·L-1Mel培养基,同时设立空白对照组,作用 24 h后,收集上清液,严格按照ELISA试剂盒说明书进行 VEGF和 bFGF含量检测。
1.2.4 免疫细胞化学检测VEGF和bFGF蛋白表达 生长良好的BEL-7402细胞经胰酶消化后接种于放有无菌盖玻片的6孔培养板培养过夜,待细胞生长达饱和状态后,分别加入含有终浓度为 2.0、4.0、8.0 mg·L-1Mel培养基,同时设空白对照组,作用24 h后取出盖玻片,PBS液冲洗,4% 多聚甲醛固定,按SABC免疫组化试剂盒方法进行。结果判定:以胞质呈棕黄染色为阳性细胞。结果采用IMS程序软件分析,每张爬片随机选取3个视野,通过预设采样程序得出阳性面积和平均光密度值,以阳性面积比与平均光密度值的乘积为免疫细胞化学阳性指数 (positive index,PI)。每组设立3个复孔。
1.2.5 实时荧光定量PCR法检测VEGF mRNA和bFGF mRNA的表达 分别收集经终浓度为 2.0、4.0、8.0 mg·L-1Mel作用 24 h后的 BEL-7402细胞,同时设立空白对照组。按照试剂盒说明提取细胞总 RNA,并逆转录成 cDNA,根据 Light Cycler DNA Master SYBR GreenⅠ说明书进行荧光定量PCR扩增。PCR引物序列见Tab 1。PCR扩增反应体系:模板 2 μl,上、下游引物各 1 μl,SybGreen PCR master mix 10 μl,dd H2O 6 μl,总反应体积为 20 μl。反应条件:94℃ 预变性 3 min,94℃ 变性 20 s,54℃退火20 s,72℃ 延伸25 s,共40个循环。最后72℃延伸10 min。在 65℃ ~95℃ 区间内进行溶解实验,并绘制溶解曲线。目标基因表达相对定量分析采用 2-△△CT法[6]。

Tab 1 The sequences of primers
2 结果
2.1 Mel对BEL-7402细胞的增殖抑制作用 Mel在0.5~16 mg·L-1浓度范围内对人肝癌细胞BEL-7402的增殖呈浓度-时间依赖性的抑制作用,见 Fig 1。Mel作用24、48和72 h后的 IC50分别为6.80、5.47 和 4.87 mg·L-1。
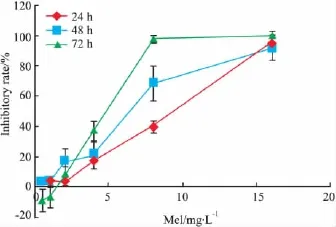
Fig 1 Inhibitory effects of Mel on the proliferation of BEL-7402 cells( ± s,n=6)
2.2 Mel对BEL-7402细胞分泌 VEGF和 bFGF的影响 与空白对照组比较,经Mel作用24 h后,BEL-7402细胞上清液中 VEGF及 bFGF含量明显降低 (P<0.05或P<0.01),并表现出浓度依赖性的特点,见 Tab 2。
Tab 2 Effects of Mel on the expression of VEGF and bFGF in BEL-7402 cells detected by ELISA±s,n=6)

Tab 2 Effects of Mel on the expression of VEGF and bFGF in BEL-7402 cells detected by ELISA±s,n=6)
*P<0.05,**P<0.01 vs control
Group Dose/mg·L-1 Level of protein expression/μg·L-1 VEGF bFGF Control 242.54±3.96 19.04±1.25 Mel 2.0 209.95±8.30** 13.79±1.24*4.0 181.89±13.30** 11.14±0.24**8.0 163.48±6.19** 10.18±1.97**
2.3 Mel对BEL-7402细胞VEGF和 bFGF蛋白表达的影响 Fig 2所示,空白对照组VEGF和 bFGF蛋白在BEL-7402细胞质中表达呈强阳性。经软件分析,其VEGF和bFGF蛋白阳性表达指数分别为1.3662±0.1358和1.2725±0.1793;而Mel各组VEGF和bFGF表达阳性细胞数目明显减少,染色变淡,与空白对照组比较差异有统计学意义(P<0.05或 P<0.01),且Mel对两种蛋白表达的下调作用呈浓度依赖性,见 Tab 3。
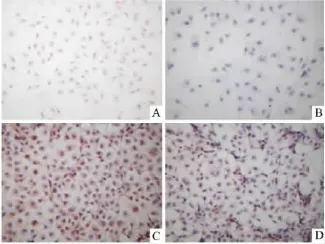
Fig 2 Effects of Mel on the expression of VEGF and bFGF in BEL-7402 cells(×100)A:VEGF control;B:VEGF 8.0 mg·L-1;C:bFGF control;D:bFGF 8.0 mg·L-1
Tab 3 Effects of Mel on the expression of VEGF and bFGF in BEL-7402 cells detected by immunocytochemical staining±s,n=3)
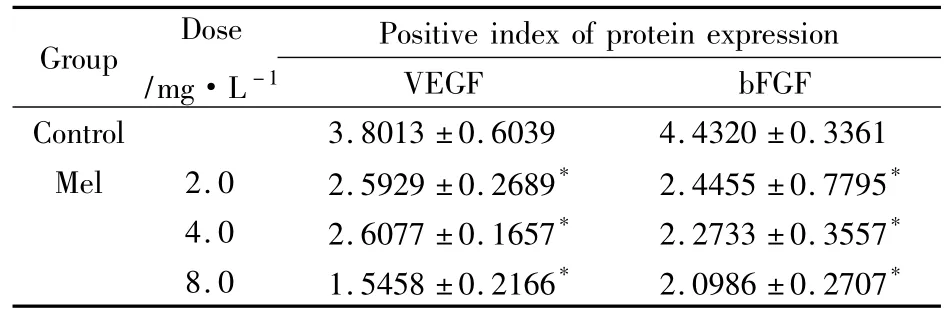
Tab 3 Effects of Mel on the expression of VEGF and bFGF in BEL-7402 cells detected by immunocytochemical staining±s,n=3)
*P<0.05,**P<0.01 vs control
Group Dose/mg·L-1 Positive index of protein expression VEGF bFGF Control 3.8013±0.6039 4.4320±0.3361 Mel 2.0 2.5929±0.2689* 2.4455±0.7795*4.0 2.6077±0.1657* 2.2733±0.3557*8.0 1.5458±0.2166* 2.0986±0.2707*
2.4 实时荧光定量 PCR检测BEL-7402细胞中VEGF mRNA和bFGF mRNA的表达 与空白对照组比较,Mel各浓度组VEGF mRNA和bFGF mRNA的表达明显降低 (P<0.01)。Mel低、中、高浓度组 VEGF mRNA的表达分别是空白对照组的0.66、0.52和0.22倍,而 bFGF mRNA的表达分别是空白对照组的0.51、0.36和0.34倍,见 Fig 3。
3 讨论
自1971年Folkman首次提出肿瘤的生长和转移具有血管依赖性之后,抗肿瘤血管生成得到广泛关注。肿瘤血管生成是指血管内皮细胞从现有的血管系统中分化、迁移而形成新的微血管的复杂生物学过程。有多种生长因子、胞外基质成分、蛋白水解酶和细胞黏附分子参与了该过程[7]。它是血管内皮细胞、肿瘤细胞以及肿瘤微环境相互作用的结果。血管内皮细胞产生的各种生长因子对肿瘤具有旁分泌作用,同时,肿瘤细胞又可分泌血管内皮细胞增殖所需要的有丝分裂原和动力原。因此,在肿瘤治疗中,有效抑制肿瘤细胞合成和分泌促血管生成因子,可拮抗肿瘤血管生成,阻断其有效血供,抑制肿瘤的生长和转移。
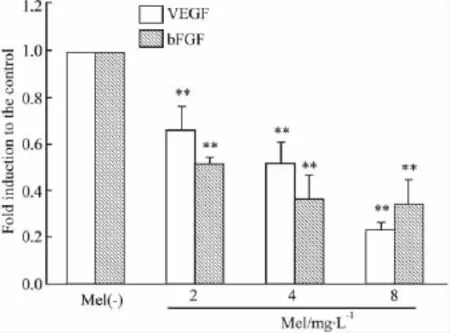
Fig 3 Effects of Mel on the mRNA of VEGF and bFGF in BEL-7402 cells(±s,n=3)**P<0.01 vs control
近年来,随着肿瘤细胞生物学和免疫学的发展,人们试图寻找抗肿瘤作用明显、毒副作用小的新型抗肿瘤药物。现有研究发现,一些从天然药物中提取的小分子物质具有抑制肿瘤生长、阻碍肿瘤血管生成的作用[8]。Mel是从传统中药蜂毒中提取、纯化的一种小分子肽类物质,它是蜂毒的主要组成成分和活性单位,约占蜂毒干重的50%,由26个氨基酸组成。我们实验室既往研究表明[9-10],Mel对骨肉瘤细胞株 U2OS、人肝癌细胞株 SMMC-7721、Hep-3B等肿瘤细胞的增殖具有较强的抑制作用,并可影响肿瘤细胞周期的正常移行,阻止 S期细胞进入G2/M期,进而引起细胞凋亡或坏死。本实验是在既往研究的基础上进一步探讨Mel对人肝癌细胞株BEL-7402增殖的影响。结果表明,浓度为 0.5~16.0 mg·L-1的Mel对BEL-7402细胞的增殖生长具有明显的抑制作用,并且存在浓度和时间依赖性。
肿瘤的血管生成是一个由多种细胞因子介导的多步骤级联反应过程,其血管生成程度取决于肿瘤细胞、毛细血管内皮细胞、周细胞之间复杂的相互作用[12]。血管内皮细胞通过自分泌方式,而肿瘤细胞通过旁分泌方式产生大量促血管生成因子。其中,VEGF和bFGF是最重要的两个血管生成调控因子,它们通过与血管内皮细胞表面特异性受体结合,促进血管内皮细胞增殖和迁移,加速新生血管的构建[11-12]。本实验通过 ELISA法和免疫细胞化学方法证实了VEGF和bFGF在BEL-7402细胞中呈高表达。经Mel处理后,BEL-7402细胞 VEGF和 bFGF的表达明显下调,并且呈浓度依赖性。而实时荧光定量PCR检测结果亦显示,Mel可降低BEL-7402细胞VEGF mRNA和bFGF mRNA的转录水平,下调作用随着Mel浓度的升高而增强。这提示,Mel可从基因和蛋白质水平影响肝癌细胞VEGF和bFGF的表达,抑制其旁分泌功能。
综上所述,我们研究发现,Mel可抑制人肝癌细胞株BEL-7402的增殖生长,并且下调促血管生成因子VEGF和 bFGF的表达。该结果提示,Mel不仅具有直接抑制肝癌细胞增殖的作用,而且可通过阻碍肝癌细胞合成和分泌促血管生成因子,干扰其与血管内皮细胞的相互作用,拮抗肿瘤血管生成,抑制肿瘤生长,但其具体分子机制尚待进一步研究。
[1]Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-6.
[2]McKenna S,Eatock M.The medical management of pancreatic cancer:a review[J].Oncologist,2003,8(2):149-60.
[3]Blagosklonny M V.Antiangiogenic therapy and tumor progression[J].Cancer Cell,2004,5(1):13-7.
[4]Chu S T,Cheng H H,Huang C J,et al.Phospholipase A2-independent Ca2+entry and subsequent apoptosis induced by melittin in human MG63 osteosarcoma cells[J].Life Sci,2007,80(4):364-9.
[5]吴宝明,李 俊,吕雄文,等.蜂毒素对SGC-7901细胞生长及G2/M期阻滞的影响[J].中国药理学通报,2010,26(2):222-5.
[5]Wu B M,Li J,Lü X W,et al.Effects of Melittin on the growth and G2/M phase arrest in SGC-7901 cells[J].Chin Pharmacol Bull,2010,26(2):133-7.
[6]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta CT)methods[J].Methods,2001,25:402-8.
[7]Yance D R Jr,Sagar S M.Targeting angiogenesis with integrative cancer therapies[J].Integr Cancer Ther,2006,5(1):9-29.
[8]Bai X,Cerimele F,Ushio-Fukai M,et al.Honokiol,a small molecular weight natural product,inhibits angiogenesis in vitro and tumor growth in vivo[J].J Biol Chem,2003,278(37):35501-7.
[9]陈永强,朱振安,戴克戎,等.Mel对骨肉瘤细胞系细胞增殖的影响[J].上海中医药大学学报,2003,17(1):55-7.
[9]Chen Y Q,Zhu Z A,Dai K R.Influence of bee venom on cell proliferation of osteosarcoma cells[J].Acta Univer Tradit Med Sin Pharmacol Shanghai,2003,17(1):55-7.
[10]凌昌全,黄雪强,刘 岭,等.蜂毒素体外抑瘤作用的实验研究[J].第二军医大学学报,2001,22(7):612-4.
[10]Ling C Q,Huang X Q,Liu L,et al.The anti-tumor effect of melittin in vitro[J].Acad J Sec Mil Med Univ,2001,22(7):612-4.
[11]Ferrara N.Role of vascular endothelial growth factor in physiologic and pathologic angiogenesis:therapeutic implications[J].Semin Oncol,2002,29(6 Suppl 16):10-4.
[12]Cronauer M V,Schulz W A,Seifert H H,et al.Fibroblast growth factors and their receptors in urological cancers:basic research and clinical implications[J].Eur Urol,2003,43(3):309-19
