杜氏盐藻寡糖基转移酶亚基stt3a酵母双杂交诱饵载体的构建及自激活和毒性检测*
2011-12-07侯永杰李庆华王建人薛乐勋
侯永杰,李 杰,李庆华,王建人,薛乐勋#
1)郑州大学生物工程系细胞生物学研究室郑州 450001 2)河南中医学院生理教研室郑州 450008
#通讯作者,男,1944年2月生,教授,博士研究生导师,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@zzu.edu.cn
杜氏盐藻寡糖基转移酶亚基stt3a酵母双杂交诱饵载体的构建及自激活和毒性检测*
侯永杰1),李 杰1),李庆华1),王建人2),薛乐勋1)#
1)郑州大学生物工程系细胞生物学研究室郑州 450001 2)河南中医学院生理教研室郑州 450008
#通讯作者,男,1944年2月生,教授,博士研究生导师,研究方向:肿瘤标志物与基因工程,E-mail:xuelx@zzu.edu.cn
杜氏盐藻;stt3a;酵母双杂交;鞭毛再生
目的:观察杜氏盐藻寡糖基转移酶亚基stt3a的酵母双杂交诱饵载体表达产物对酵母细胞有无毒害作用并检测其自激活作用。方法:应用PCR方法获得stt3a可溶端的基因片段,将基因片段按正确的方向插入到酵母表达质粒pGBKT7中,经限制性内酶切鉴定正确后,用PEG/LiAc法转化到酵母菌株Y187中,并通过表型筛选检测诱饵蛋白有无毒性和自激活作用。结果:成功获得了stt3a可溶端的基因片段,其表达的蛋白对酵母菌株Y187无毒害,报告基因-半乳糖苷酶活性没有被诱导。结论:酵母双杂交GAL4系统可以被用来研究杜氏盐藻中与stt3a相互作用的蛋白。
酵母双杂交系统是一个研究蛋白质间相互作用的技术平台,由于是在活细胞内进行,因此能够在某种程度上反映蛋白质在正常生理条件下的活性状态,这是体外任何实验无法模拟的。stt3a基因是寡糖基转移酶的催化亚基,可以有效促使新生肽的糖基化修饰[1-2],它在已知的寡糖基转移酶亚基中是最保守的[3]。最近的研究[4]发现拟南芥的stt3a作为寡糖基转移酶的亚基在高渗透压的应激或高盐反应中发挥作用。杜氏盐藻是一种高度耐盐的单细胞真核绿藻,能在0.5~5.0 mol/L NaCl条件下生存。作者拟通过构建盐藻 stt3a酵母双杂交诱饵载体pGBKT7-stt3a,转化酵母菌株,检测其对酵母菌株有无毒性作用并进行自激活检测,为进一步研究杜氏盐藻的耐盐机制和stt3a作为一种跨膜蛋白直接或间接参与杜氏盐藻鞭毛再生过程中所需相关蛋白的糖基化修饰[5],提供更多的理论依据。
1 材料与方法
1.1 材料、载体与菌株 杜氏盐藻藻株为UTEXLB-1644,购自美国得克萨斯州大学,载体pMD19-T、表达载体pGBKT7、AH109和Y187酵母菌株均购自大连宝生物工程公司,DH5α为郑州大学生物工程系细胞生物学研究室保存。
1.2 主要试剂和仪器 限制性内切酶、LA Taq DNA聚合酶、T4 DNA连接酶均购自TaKaRa公司;酵母培养基购自上海睿星基因技术有限公司;LiAc溶液购自Clontech公司;X-α-Gal和3-AT均购自Sigma公司;凝胶回收试剂盒和质粒DNA小提试剂盒购自杭州维特洁生物公司;PCR仪(Biometra公司),电泳仪(北京六一实验仪器厂),凝胶成像仪(Synoptics公司),2-16P型离心机(Heraeus公司)。1.3 stt3a基因的PCR扩增 扩增基因stt3a可溶端的特异性引物:上游引物序列5’-CCGGAAT TCATGTCCTCGCCGTCCATCGTG-3’,下游引物序列5’-CGCGGATCCATGTCATGCCTTGGCCTTGGC-3’。100 μL PCR反应体系中LA Taq酶0.5 μL,上、下游引物(100 μmol/L)各1 μL,dNTP(10 nmol/L)8 μL,10×LA Buffer 10 μL,模板 cDNA 1 μL,加ddH2O至100 μL。反应程序:95℃预变性3 min;94℃变性30 s,60℃退火30 s,72℃延伸50 s,30个循环;72℃延伸10 min,4℃终止反应。PCR反应结束后,10 g/L的琼脂糖凝胶电泳检测扩增结果。
1.4 PCR产物克隆和鉴定 PCR产物胶回收后与克隆载体pMDT-19相连,转化到大肠杆菌DH5α中,LB平板进行蓝白斑筛选。挑取白斑摇菌,提取质粒进行酶切鉴定,正确的阳性克隆为pMDT-19-stt3a,然后序列分析其正确性。
1.5 构建载体及鉴定诱饵载体 用EcoRⅠ和BamHⅠ双酶切 pMDT-19-stt3a和表达载体 pGBKT7,胶回收后的stt3a和表达载体pGBKT7片段,将载体片段和stt3a连接后转化到大肠杆菌DH5α。经限制性内切酶分析,将含正确片段的克隆命名为pGBKT7-stt3a,然后鉴定序列的正确性。
1.6 pGBKT7-stt3a的转化
1.6.1 制备酵母感受态细胞 挑取单克隆酵母菌Y187,接种于5 mL YPDA液体培养基中,30℃以230~250 r/min振荡培养16~20 h,至A(600 nm)= 0.15~0.30后接种于50 mL YPDA液体培养基中,30℃以250 r/min振荡培养至A(600 nm)=0.4~0.5 (约3 h)。室温下将含有酵母的液体培养基以2 700 r/min离心5 min。弃上清,加50 mL去离子水重悬沉淀。离心弃上清,用3 mL 1×TE/LiAc溶液重悬,分装于1.5 mL的微量离心管中,12 000 r/min离心30 s,再用600 μL 1×TE/LiAc重悬,所得的悬浮液即为酵母感受态细胞。
1.6.2 转化及鉴定 在1.5 mL微量离心管中,加入50 μL酵母感受态细胞,已构建好的诱饵载体0.5 μL(同时设置阳性、阴性对照),500 μL PEG/Li-Ac溶液和鲱鱼精DNA 5 μL,涡旋均匀。在30℃水浴中培养30 min,加入20 μL二甲基亚砜(DMSO)混匀,42℃水浴20 min,每5 min混匀1次。2 700 r/ min离心5 min,弃上清,用1 mL YPDA液体培养基重悬沉淀,30℃水浴振荡培养90 s,离心弃上清,用9 g/ L的NaCl轻轻重悬,铺于SD/-Trp平板。于30℃培养3~5 d,直至带有诱饵载体的酵母长出克隆。
1.7 诱饵蛋白自激活检测 空载体质粒pGBKT7-BD和重组质粒pGBKT7-stt3a分别转到酵母AH109和Y187中,再将转有质粒的酵母细胞铺在不同营养缺陷型的培养基培养平板 SD/-Ade/-Trp/X-α-Gal、SD/-His/-Trp/X-α-Gal和SD/-Trp/X-α-Gal上,30℃培养3~6 d,观察酵母生长状况。
1.8 诱饵蛋白的毒性检测 将空质粒pGBKT7-BD和重组质粒pGBKT7-stt3a分别转化酵母Y187细胞,30℃于SD/-Trp培养板培养。克隆长出后挑取直径2~3 mm的单克隆菌落至含抗生素Kan+的液体培养基SD/-Trp中,30℃摇荡培养,测定A(600 nm)为0.15左右时,取10 μL用9 g/L的NaCl稀释至相同的浓度后,再各取5 μL至新培养基中摇荡培养,每隔2 h取样测定其A(600 nm)的值,重复测定2次取平均值绘制酵母细胞的生长曲线。
2 结果
2.1 重组pGBKT7-stt3a质粒的酶切鉴定 杜氏盐藻 stt3a基因扩增结果见图1。连接到 pMDT-19stt3a双酶切后(图2),将酶切回收后的stt3a插入到表达载体 pGBKT7上,然后转化到大肠杆菌DH5α中,送测序后发现无碱基突变和移码突变,用EcoRⅠ和BamHⅠ双酶切鉴定pGBKT7-stt3a重组质粒,并对阳性克隆进行测序,酶切鉴定结果(图3)与实际相符,载体构建成功。

2.2 诱饵载体pGBKT7-stt3a的转化 转化pGBKT7-stt3a的酵母细胞Y187的 PCR鉴定结果见图4。

图4 重组菌落pGBKT7-stt3a的PCR鉴定
2.3 诱饵载体的自激活作用检测结果 见表1。
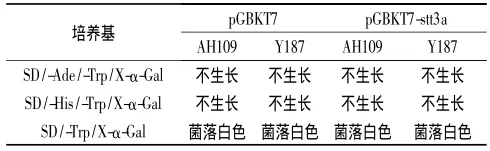
表1 诱饵蛋白的自激活检测结果
2.4 诱饵蛋白的毒性检测 空质粒酵母pGBKT7细胞和诱饵重组质粒酵母细胞pGBKT7-stt3a的生长曲线从图5上看基本一致。

图5 酵母菌的生长曲线
3 讨论
细胞内的蛋白质是通过寡糖基转移酶这一门户分泌到其发挥功能的部位,它是由一接纳体Asn-XSer/Thr(X是除脯氨酸以外的任何氨基酸)来决定其特异性。stt3作为寡糖基转移酶的催化亚基,它有一个Ncyt-Clum拓扑结构,含有DK与WWDYG两个保守的基序[6],含有11个跨膜螺旋[7]。在植物中stt3a作为寡糖基转移酶的亚基,能通过含有stt3a的寡糖基转移酶复合物介导特殊蛋白质的糖基化,这些蛋白质是盐耐受性所必需的[8-9]。杜氏盐藻的耐盐机制到目前还没有完全弄清楚,初步的研究[2]表明,杜氏盐藻的耐盐机制除受到有关离子和丙三醇调节外,还受到一些糖基化的蛋白质调节。在高盐条件下,杜氏盐藻的运动性明显降低,随着盐浓度的升高,stt3a与mRNA表达水平呈现正相关。因此,用stt3a作为诱饵钓取与之相关的基因,能更有说服力地阐述stt3a及与其相互作用的基因参与盐藻的耐盐机制,也可能会进一步地阐述清楚盐藻耐盐的分子机制和调控途径。
stt3a还直接或间接地参与了盐藻鞭毛的再生[5]。因此,运用酵母双杂交的方法筛选与stt3a相互作用的蛋白可能有利于阐述stt3a基因作为跨膜蛋白对调节鞭毛再生和适应高盐浓度的分子机制。酵母双杂交系统是由Fields等[10]提出建立的一种新的直接在真核活细胞内检测蛋白相互作用的新方法,灵敏度高。该实验是在酵母双杂交Gal4系统的基础上成功构建了融合有stt3a基因片段的重组表达质粒pGBKT7-stt3a,将重组质粒转入酵母细胞中,通过SD/-Trp培养筛选出阳性菌落,并通过毒性实验证实了该外源基因对酵母细胞生长没有影响。由于假阳性存在是酵母双杂交的最大缺点,主要原因是诱饵蛋白对报告基因的激活。为了排除诱饵载体单独激活报告基因而造成假阳性结果,检测了诱饵载体对酵母双杂交系统报告基因的激活情况,结果表明stt3a诱饵载体转化酵母菌株Y187不能激活系统的报告基因His和lac Z,因此可以用于酵母双杂交方法钓取与之相互作用的分子。这些为研究杜氏盐藻参与耐盐机制的分子通路和参与鞭毛再生的机制提供了重要基础。
[1]Frank J,Kaulfürst-Soboll H,Rips S,et al.Comparative analyses of Arabidopsis complex glycan1 mutants and genetic interaction with staurosporin and temperature sensitive3a[J].Plant Physiol,2008,148(3):1354
[2]Schaewen A,Frank F,Koiwa H.Role of complex N-glycans in plant stress tolerance[J].Plant Signal Behav,2008,3 (10):871
[3]Chapman A,Li E,Kornfeld S.The biosynthesis of the major lipid-linked oligosaccharide of Chinese hamster ovary cells occurs by the ordered addition of mannose residues[J].J Biol Chem,1979,254(20):10243
[4]Koiwa H,Li F,McCully MG,et al.The STT3a subunit isoform of the Arabidopsis oligosaccharyltransferase controls adaptive responses to salt/osmotic stress[J].Plant Cell,2003,15(10):2273
[5]王翠,李杰,柳丽平,等.杜氏盐藻寡糖基转移酶亚基STT3a功能结构域的克隆与表达分析[J].生物工程学报,2010,26(6):760
[6]Igura M,Maita N,Kamishikiryo J,et al.Structure-guided identification of a new catalytic motif of oligosaccharyltransferase[J].EMBO J,2008,27(1):234
[7]Kim H,von Heijne G,Nilsson I.Membrane topology of the STT3 subunit of the oligosaccharyl transferase complex[J].J Biol Chem,2005,280(21):20261
[8]Yan Q,Lennarz WJ.Studies on the function of oligosaccharyltransferase subunits,Stt3p is directly involved in the glycosylation process[J].J Biol Chem,2002,277(49): 47692
[9]Li J,Lu YM,Xue LX,et al.A structurally novel salt-regulated promoter of duplicated carbonic anhydrase gene 1 from Dunaliella salina[J].Mol Biol Rep,2010,37(2): 1143
[10]Fields S,Song O.A novel genetic system to detect proteinprotein interactions[J].Nature,1989,340(6230):245
Construction of yeast two-hybrid bait plasmid for stt3a of oligosaccharyltransferase from Dunaliella salina and detection of self-activation and toxicity of stt3a
HOU Yongjie1),LI Jie1),LI Qinghua1),WANG Jianren2),XUE Lexun1)1)Laboratory for Cell Biology,Department of Biology,Zhengzhou University,Zhengzhou 450001 2)Department of Physiology,Henan College of Traditional Chinese Medicine,Zhengzhou 450008
Dunaliella salina;stt3a gene;yeast two-hybrid;flagella regeneration
Aim:To observe whether expression products of oligosaccharyltransferase subunit stt3a bait plasmid affect the growth of yeast cells and its self-activation.Methods:The cDNA fragments of stt3a were obtained by PCR and then inserted into the plasmid pGBKT7 to construct a recombinant bait plasmid pGBKT7-stt3a.Subsequently,the bait plasmid was transformed into the yeast strain Y187 by PEG/LiAc method.Results:The cDNA fragments of stt3a were amplified successfully.All expression productions were not toxic to Y187 cells and activity of the reporter gene β-galactosidase was not induced.Conclusion:Yeast two-hybrid GAL4 system can be utilized to study proteins interacted on stt3a in Dunaliella salina.
Q782
*科技部国际科技合作基金资助项目 2007DFA01240;国家自然科学基金资助项目 30700014
(2011-05-03收稿 责任编辑李沛寰)