巴旦木蛋白水解物的制备及其抗氧化活性*
2011-11-30孙月娥王卫东郑义
孙月娥,王卫东,郑义
1(徐州工程学院食品学院,江苏 徐州,221111)
2(江苏省食品生物加工工程技术研究中心,江苏徐州,221111)
巴旦木蛋白水解物的制备及其抗氧化活性*
孙月娥1,2,王卫东1,郑义1
1(徐州工程学院食品学院,江苏 徐州,221111)
2(江苏省食品生物加工工程技术研究中心,江苏徐州,221111)
以巴旦木蛋白为底物,采用正交试验优化碱性蛋白酶水解巴旦木蛋白的条件,研究巴旦木蛋白肽的还原能力、对羟自由基、超氧阴离子自由基以及二苯代苦味酰基自由基的清除能力。结果表明:最优酶解工艺参数为底物浓度20%、酶浓度4%、pH值9.5、酶解温度60℃,在此条件下巴旦木蛋白的水解度为36.6%。巴旦木蛋白肽的还原能力随肽浓度的增大而增大,对OH·、O2-·以及DPPH·均具有良好的清除能力,清除效果随着巴旦木蛋白肽浓度的增大而增强,两者之间存在着量效关系,但当肽达到一定浓度时,其抗氧化效果基本不受浓度影响。
碱性蛋白酶,巴旦木肽,抗氧化活性
巴旦木又名巴旦杏,是蔷薇科李亚科桃属乔木,也是新疆维吾尔人民最珍视的干果,素有“圣果”之称。据测定,巴旦木仁内含有蛋白质20% ~35%、糖3% ~10%、脂肪50% ~65%、粗纤维2.5% ~3.5%,此外,还含有丰富的维生素 A1、B1、B2和 C、E、A 以及大量的微量元素[1]。食品蛋白质经蛋白酶水解后不仅有助于生物体对蛋白质的消化吸收[2-3],而且水解产生的多肽还具有促进营养吸收、提高免疫力、调节神经、降血压、抗氧化、抗菌、抗肿瘤等生理活性,有些多肽已作为天然抗氧化剂或保健食品而受到广泛关注[4-5]。近年来,有关蛋白质水解物抗氧化活性的研究逐渐增多,已有研究表明,抗氧化生物活性肽具有清除体内自由基的功能,也是一种潜在的可以利用的外源性抗氧化物质[6]。本研究以巴旦木蛋白为原料,探讨碱性蛋白酶的水解条件,以及巴旦木蛋白肽的抗氧化活性、还原能力、抑制脂质氧化的作用。
1 材料与方法
1.1 材料与仪器
巴旦木,新疆库尔勒地区;碱性蛋白酶,上海索莱宝生物科技有限公司;其他试剂均为分析纯。
PC-1000数显式电热恒温水浴锅,上海跃进医疗器械厂;T756紫外可见分光光度计,上海成光仪器有限公司;LGJ-18A冷冻干燥机,常州普天仪器制造有限公司;FA-2104N电子分析天平,上海精密科学仪器有限公司;80-1/2台式离心机,常州国华电器有限公司。
1.2 实验方法
1.2.1 巴旦木主要化学成分的测定
水分含量:真空干燥法[7];灰分:干法灰化法[7];总脂肪:索氏抽提法[8];蛋白质:微量凯氏定氮法,转换系数为 6.25[8];还原糖:直接滴定法[8];总糖:苯酚-硫酸法[8];膳食纤维:酶-重量法[9]。
1.2.2 巴旦木蛋白肽的制备工艺
巴旦木→脱脂巴旦木粕→碱提酸沉→离心→沉淀物冷冻干燥→巴旦木蛋白→酶解→灭酶(沸水浴,15 min)→离心(12 000 r/min,30 min)→上清液→浓缩→冷冻干燥→巴旦木蛋白肽
1.2.3 水解度(DH)的测定方法
在中性及碱性条件下采用 pH-stat法[10-11],DH/%=[B×Nb×(1/α)×(1/Mp)×(1/Htot)]×100
式中:B,碱液体积,mL;Nb,碱液的当量浓度,mol/L;α,α-氨基的解离度;Mp,底物中蛋白质含量,g;Htot,底物蛋白质中的肽键总数,mmoL/g(试验采用巴旦木蛋白为原料,取 Htot=7.58[12])。
1.2.4 巴旦木蛋白肽抗氧化功能评价
还原能力测定[13],羟自由基(OH·)清除能力的测定[13],超氧阴离子自由基(O2-·)清除能力的测定[14],对二苯代苦味酰基自由基的(DPPH· )清除能力的测定[15-16]。
2 结果与分析
2.1 巴旦木的主要化学成分
由表1可见,与大部分坚果类食物类似,巴旦木含有较多的脂肪和蛋白质。刘金荣等[17]对巴旦木的化学成分分析显示,脂肪和蛋白质含量分别为58.02%和20.81,与本实验测定结果基本一致。所以除了直接食用外,也可从巴旦木中提取脂肪和蛋白质。

表1 巴旦木的主要成分 %
2.2 碱性蛋白酶水解巴旦木蛋白的工艺参数确立
2.2.1 pH值对碱性蛋白酶水解效果的影响
取巴旦木蛋白粉1 g,在底物浓度10%,酶浓度4%,pH 值分别为 7.0、7.5、8.0、8.5、9.0,温度 50℃下水解2 h,考察pH值对碱性蛋白酶水解效果的影响(图1)。
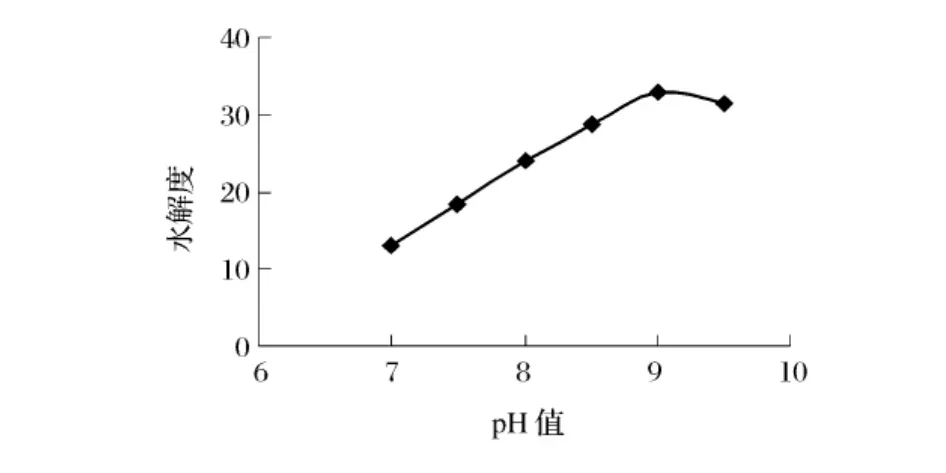
图1 pH值对水解效果的影响
由图1可见,在pH值7~9内,水解程度随着pH值的增加而增大,当pH值为9.0时,碱性蛋白酶的水解作用最强,而后随着pH值进一步增大,水解度呈下降趋势,故确定碱性蛋白酶水解巴旦木蛋白的最佳pH值为9.0。
2.2.2 温度对碱性蛋白酶水解效果的影响
取巴旦木蛋白粉1 g,在底物浓度10%,酶浓度4%,pH 9.0 条件下,分别在35℃、40、45、50、55、60℃下水解2 h,考察温度对碱性蛋白酶水解效果的影响(图2)。
从图2可以看出,温度对碱性蛋白酶水解巴旦木蛋白的效果产生影响。在35℃时,水解程度最低,而在55℃时碱性蛋白酶的水解作用最强,故后续试验中采用温度为55℃进行水解。
2.2.3 底物浓度对碱性蛋白酶水解效果的影响
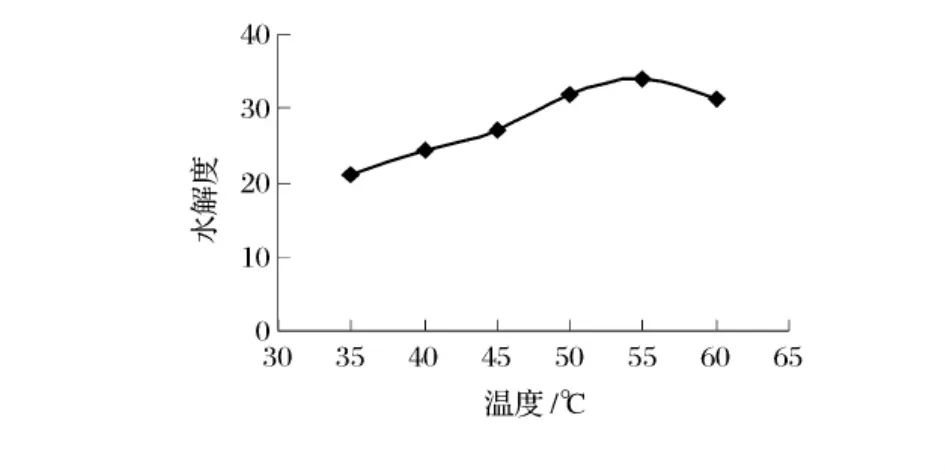
图2 温度对水解效果的影响
取巴旦木蛋白粉1 g,分别在底物浓度3%、5%、10%、15%、20%,酶浓度4%、pH 9.0条件下水解2 h,考察底物浓度对碱性蛋白酶水解效果的影响(图3)。
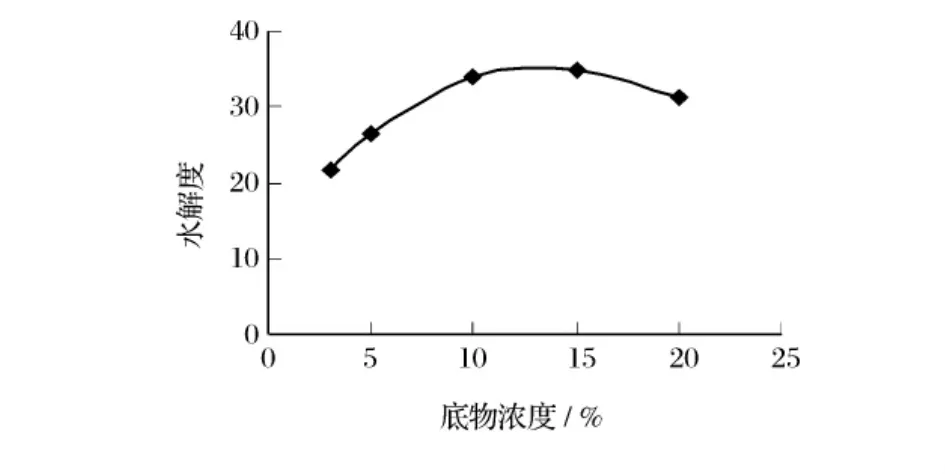
图3 底物浓度对水解效果的影响
从图3可以看出,在试验范围内,随着巴旦木蛋白浓度的增加水解度不断增加。但巴旦木蛋白浓度大于20%时水解度开始下降,故确定15%的巴旦木蛋白水解时的最佳底物浓度。
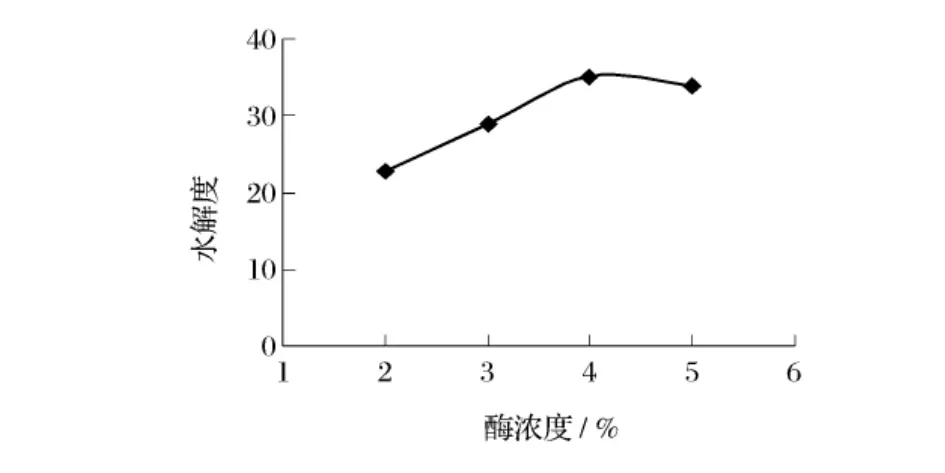
图4 酶浓度对水解效果的影响
2.2.4 酶浓度对碱性蛋白酶水解效果的影响
取巴旦木蛋白粉1 g,分别在酶浓度2%、3%、4%、5%,底物浓度15%、pH值9.0、温度55℃条件下水解2 h,考察酶浓度对碱性蛋白酶水解效果的影响。
由图4可见,随着酶浓度增加,碱性蛋白酶水解巴旦木蛋白的水解度也随之增大,当酶浓度4%时水解度达到最大值,故确定巴旦木蛋白水解的最佳酶浓度为4%。
2.2.5 正交试验确定最佳工艺参数
在前期单因素试验基础上分别以pH值、酶解温度、酶浓度、底物浓度为因素,以巴旦木蛋白水解度为指标,采用L9(34)正交表优化巴旦木蛋白的酶解工艺参数,正交试验的因素水平表及试验结果分别见表2和表3。
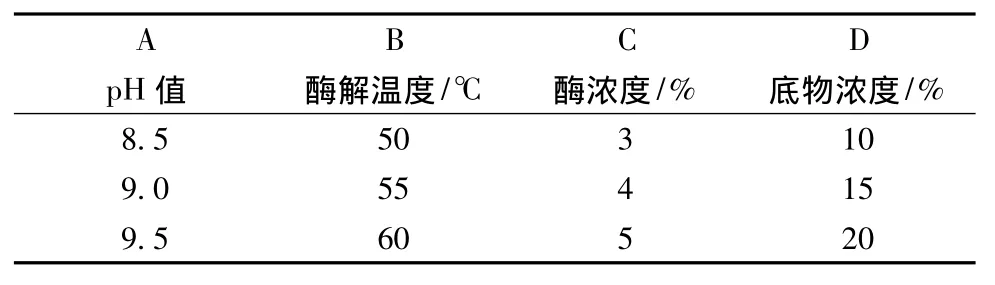
表2 正交试验设计
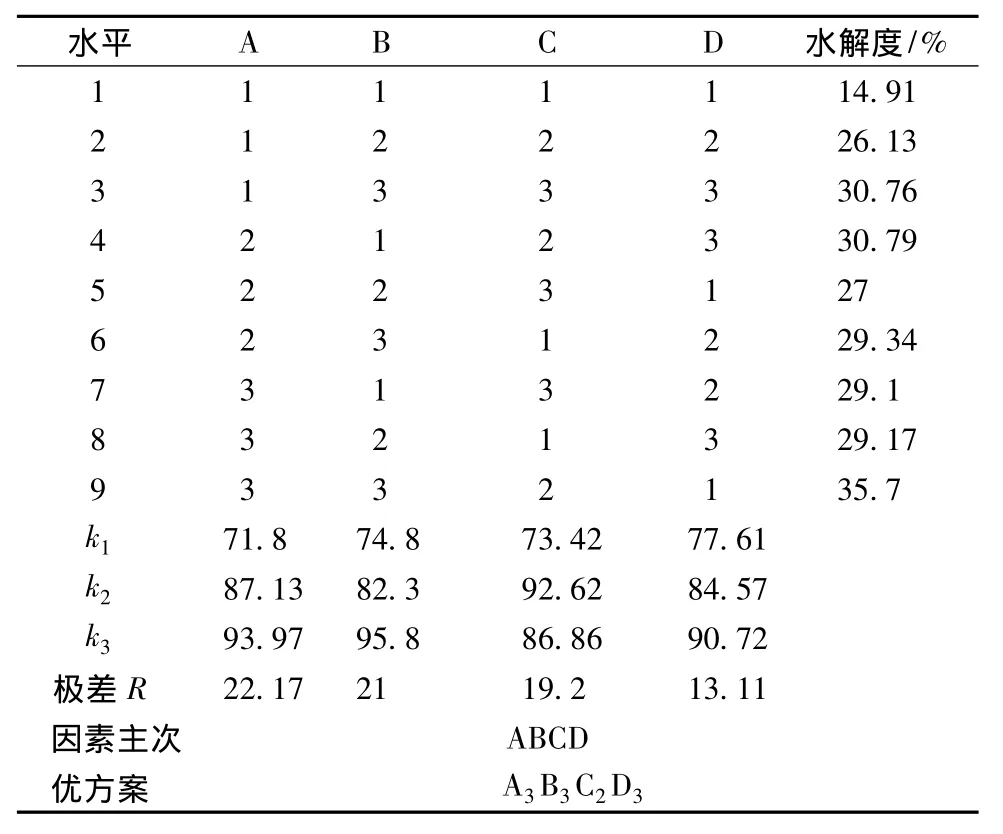
表3 巴旦木蛋白酶解正交试验结果
由表3可见,影响巴旦木蛋白酶解的因素主次顺序为A>B>C>D,即pH值影响最大,其次为酶解温度、酶浓度,底物浓度的影响最小。巴旦木蛋白酶解的最佳条件为A3B3C3D2,即酶解温度60℃、pH 9.5、酶浓度4%、底物浓度20%,在酶解最佳条件下做验证试验,测得巴旦木蛋白的水解度36.6%。
2.3 巴旦木蛋白肽的抗氧化活性
2.3.1 还原能力的比较
国外学者研究报道,抗氧化剂的抗氧化活性与其还原能力相关,吸光度值越大则样品的还原能力越强[18]。以VC为参照,对不同浓度下巴旦木蛋白肽的还原能力进行研究。由图5可见,在浓度0.5 mg/mL之前,Vc的还原能力随着浓度的增加而增大,此后,其还原能力有缓慢下降趋势;而巴旦木蛋白肽的还原能力一直随着浓度的增加而增大。
2.3.2 对羟自由基(OH·)清除能力
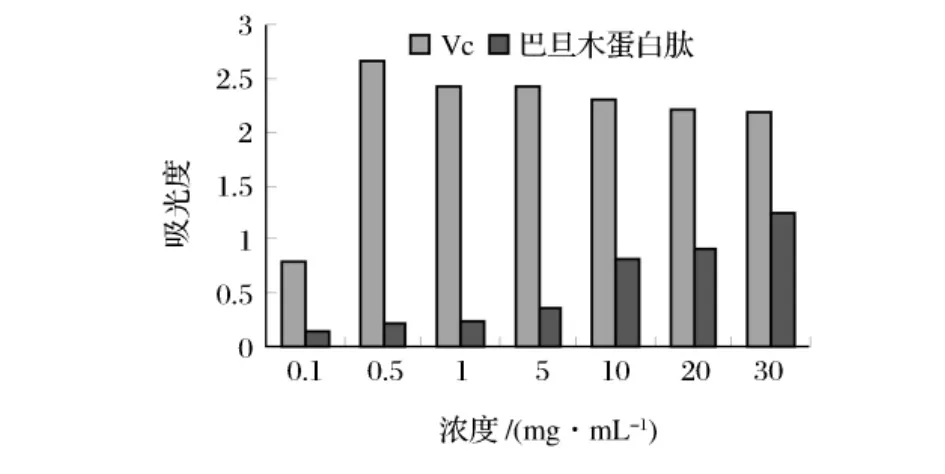
图5 巴旦木蛋白肽的还原能力
羟自由基(OH·)是氧的三电子还原产物,是最活泼的自由基,也是已知的最强氧化剂,比高锰酸钾、重铬酸钾的氧化性还强。其反应性极强,寿命很短,几乎可以与所有细胞成分发生反应,对机体危害极大,但其作用半径小,仅能与邻近的分子发生反应。
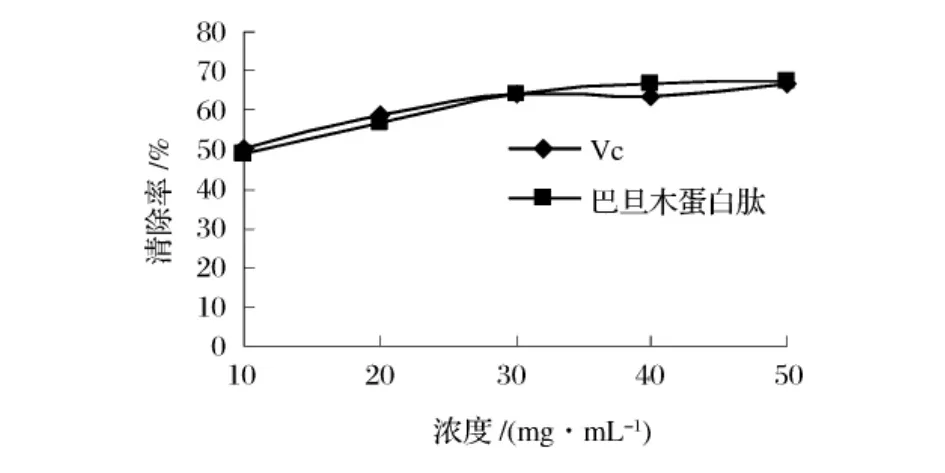
图6 巴旦木蛋白肽对羟自由基的清除能力
图6中比较了巴旦木蛋白肽和Vc在浓度10~50 mg/mL对羟自由基(OH·)的清除能力,由图6可见,随着浓度的增大,巴旦木蛋白肽和Vc对羟自由基(OH·)清除能力均增大。在浓度相同时,二者对羟自由基(OH·)清除能力无显著性差异(P>0.05)。一般认为,抗氧化肽的抗氧化活性与多肽的相对分子质量、氨基酸序列、氨基酸侧链基团、金属盐络合有关。巴旦木肽具有很高的羟自由基(OH·)清除能力,可能与其特殊的结构有关,需要对其氨基酸组成及空间结构进行测试分析。
2.3.3 对超氧阴离子自由基(O2-·)的清除能力
图7中比较了巴旦木蛋白肽和Vc在浓度10~50 mg/mL对超氧阴离子自由基的清除能力。Vc对超氧阴离子自由基的清除率随浓度的增大而增大,当浓度达到10 mg/mL,Vc对超氧阴离子自由基的清除率基本一致,达到了99%。随着浓度的增大,巴旦木蛋白肽对超氧阴离子自由基的清除能力逐步增大,在浓度为50 mg/mL时,巴旦木蛋白肽对超氧阴离子自由基的清除率达到了61.90%。
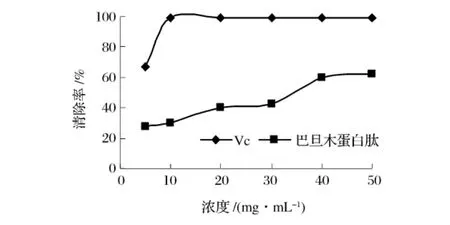
图7 巴旦木蛋白肽对超氧阴离子的清除作用
2.3.4 对二苯代苦味酰基自由基的(DPPH·)的清除能力
DPPH·是一种很稳定的以氮为中心的自由基,若受试物能清除它,则提示受试物具有降低羟自由基、烷自由基或者过氧自由基的有效浓度和打断脂质过氧化链反应的作用。在浓度10~50 mg/mL比较了巴旦木蛋白肽和Vc对二苯代苦味酰基自由基(DPPH·)的清除能力,由图8可见,Vc对DPPH·自由基的清除率基随浓度增大达到一定值趋于稳定,其清除率在84.33%左右。巴旦木蛋白肽对DPPH·自由基的清除率先是随浓度升高而增大,在20 mg/mL时达到最大,为65.73%。此后,随着浓度的升高,其对DPPH·自由基的清除率基本保持不变。
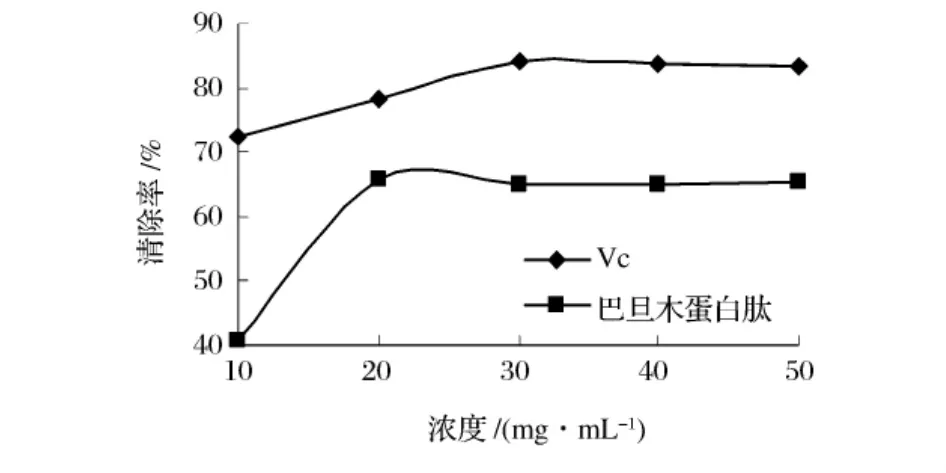
图8 巴旦木蛋白质肽对DPPH·的清除作用
3 结论
Alcalase蛋白酶水解巴旦木蛋白的最佳酶解条件为:底物浓度20%、酶浓度4%、pH值9.5、酶解温度60℃,在此条件下进行水解试验,巴旦木蛋白的水解度为36.6%。巴旦木蛋白肽的还原能力随肽浓度的增大而增大,对OH·、O2-·以及DPPH·均具有良好的清除能力,其清除效果随着巴旦木蛋白肽浓度的增大而增强,两者之间存在着量效关系,但当肽达到一定浓度时,其抗氧化效果基本不受浓度影响。
[1] 朱琼林.新疆巴丹杏[M].新疆:新疆人民出版社,1984.
[2] Sakanaka S,Tachibana Y,Ishihara N,et al.Antioxidant properties of casein calcium peptides and their effects on lipid oxidation in beef homogenates[J].Journal of agricultural and food chemistry,2005,53(2):464 -468.
[3] 张君惠,张晖,王兴国,等.抗氧化肽的研究进展[J].中国粮油学报,2008,23(6):227 -233.
[4] Korhonen H,Leppala A P,Rantamki P,et al.Impact of processing on bioactive proteins and peptides[J].Trends in food science & Technology,1998,9(8/9):307 -319.
[5] Li Y H,Jiang B,Zhang T,et al.Antioxidant and free radical scavenging activities of chickpea protein hydrolysate(CPH)[J].Food Chemistry,2008,106:444 -450.
[6] 吴建中.大豆蛋白的酶法水解及产物抗氧化活性的研究[D].广州:华南理工大学,2003.
[7] 大连轻工学院等编.食品分析[M].北京:中国轻工业出版社,2001.
[8] 宁正祥主编.食品成分分析手册[M].北京:中国轻工业出版社,1998.
[9] Lou Z,Wang H,Wang D,et al.Preparation of inulin and phenols-rich dietary fiber powder from burdock root[J].Carbohydrate Polymers,2009,78(4):666 -670.
[10] 王建化,熊柳,孙高飞,等.花生抗氧化活性肽制取工艺的研究[J].中国油脂,2008,33(6):15 -18.
[11] Harwalkar V R,Mcmahon D J.Symposium:biological and food functional characteristics of milk protein hydrolysis products[J].Journal of Dairy Science,1993,76(1):300-310.
[12] 张晖,毛锦生,张建萍.小麦麸皮蛋白质的提取与应用[J].无锡轻工大学学报,1998(1):44 -48.
[13] Wang M,Hettiarachchy N S,Qi M,et al.Preparation and functional properties of rice bran protein isolate[J].Journal of agricultural and food chemistry,1999,47(2):411-416.
[14] Hanmoungjai P,Pyle D L,Niranjan K.Enzymatic process for extracting oil and protein from rice bran[J].Journal of the American Oil Chemists'Society,2001,78(8):817 -821.
[15] He Y,Shahidi F.Antioxidant activity of green tea and its catechins in a fish meat model system[J].Journal of Agricultural and Food Chemistry,1997,45(11):4 262 -4 266.
[16] 朱艳华,谭军.玉米多肽抗氧化作用研究[J].中国粮油学报,2008,23(1):36 -43.
[17] 刘金荣,但建明,江发寿.等.巴旦杏仁的营养成分与理化常数测定[J].营养学报,2002,24(2):202 -203.
[18] Duh P D.Antioxidant activity of burdock(Arctium lappa Linne):its scavenging effect on free-radical and active oxygen[J].Journal of the American Oil Chemists'Society,1998,75(4):455 -461.
Study on Preparation and Antioxidant Activity of Hydrolysate from Badanmu Protein
Sun Yue-e1,2,Wang Wei-dong1,Zheng Yi1
1(College of Food Engineering,Xuzhou Institute of Technology,Xuzhou 221111,China)2(Jiangsu Engineering Research Center for Food Biology Processing,Xuzhou 221111,China)
With the badanmu protein as the substrate,the orthogonal test was taken to study the enzymatic hydrolysis condition of alcalase enzyme on badanmu proteins.The reducing power and the scavenging activity to hydroxyl,superoxide radical,and DPPH· free radicals were also investigated.The optimum hydrolysis parameters were as follows:substrate concentration 20%,enzyme concentration 4%,pH value 9.5,temperature 60℃.In this condition of hydrolysis,its hydrolysis degree for badanmu protein is 36.6% .The reductive ability of badanmu protein peptide increased with peptide concentration increasing.The protein peptide also had good OH·,O2-·,and DPPH·scavenging activity,which increased with the concentration of peptides until its peak.The antioxidation activity of badanmu peptides were almost fixed when its concentration exceeded a certain level.
alcalase enzyme,badanmu peptides,antioxidation activity
博士,讲师(E-mail:sunyuee416@yahoo.com.cn)。
*苏北科技发展计划项目(BN2010005);徐州工程学院培育项目(XKY2009216)
2011-06-08,改回日期:2011-09-01
