苜蓿实夜蛾几丁质脱乙酰基酶基因cDNA序列的克隆与序列分析
2011-11-30吴丽梅
李 玲, 樊 东, 吴丽梅, 姚 磊
(东北农业大学农学院,哈尔滨 150030)
几丁质(chitin)又称甲壳素、甲壳质等,是由N-乙酰-D-葡萄糖胺(GlcNAc)单体通过β-1,4糖苷键连接而成的直链高分子化合物。在自然界中,几丁质存在于真菌及藻类的细胞壁、无脊椎动物的外骨骼及表皮中,几丁质是自然界中最丰富的天然有机化合物之一,其数量仅次于纤维素[1-2]。研究证明,几丁质是昆虫表皮和围食膜的重要组成成分,昆虫生长、发育的各个时期都需要一定量的几丁质[3]。几丁质代谢随昆虫不同生长发育阶段而变化,对昆虫的正常生长发育是至关重要的。而高等植物和高等动物体内则不含几丁质,因此,通过破坏几丁质结构或几丁质代谢的平衡来防治害虫,具有极大的发展潜力[4]。
几丁质脱乙酰基酶(chitin deacetylase,EC3.5.1.41),简称CDA。CDA 来源广泛,如真菌、酵母和昆虫等都发现CDA的存在,是几丁质降解酶系成员之一,能够催化几丁质中β-1,4糖苷键连接的N-乙酰基葡糖胺的乙酰胺基的水解[5]。CDA最初是从真菌毛霉(Mucor rouxii)分离纯化的一种乙酰基转移酶[6]。真菌的几丁质脱乙酰基酶主要参与真菌细胞壁的形成[7],且与真菌自溶过程中的细胞壁裂解有关[8];CDA还参与植物和病原微生物的相互作用[1]。昆虫中对 CDA研究落后于真菌和细菌且CDA在昆虫中的功能还不十分明确,目前人们已克隆了粉纹夜蛾、棉铃虫等几种昆虫的CDA基因并对其活性和功能进行了初步研究[9-10]。
苜蓿实夜蛾[Heliothis viriplaca(Hüfnagel)],属鳞翅目夜蛾科害虫,近年间歇性暴发成灾,已成为主要的农业害虫之一。苜蓿实夜蛾以幼虫直接为害大豆、亚麻、苜蓿、玉米、棉花、花生等多种农作物和牧草。幼虫取食植物叶片或幼嫩组织,严重时造成植株光秆,大龄幼虫还可蛀荚蛀果,造成减产和产品品质下降。从分子水平研究其生长发育等生物学过程对于该虫的防治具有重要意义。作者采用RT-PCR和cDNA末端快速扩增技术,以苜蓿实夜蛾为材料,克隆几丁质脱乙酰基酶基因的cDNA序列并对其编码氨基酸序列进行分析,为从分子水平上研究几丁质脱乙酰基酶的功能、几丁质的代谢机制及生物防治新方法奠定基础。
1 材料和方法
1.1 昆虫材料、菌株、质粒与试剂
利用黑光灯在田间诱集苜蓿实夜蛾成虫,室内饲以5%蜂蜜水使其产卵并用新鲜大豆叶做饲料喂养到5龄幼虫备用;RNA提取试剂盒TRIzol·Reagent为Invitrogen公司产品、反转录酶M-MLV Reverse Transcriptase、克隆载体pGEM-T easy Vector、低熔点琼脂糖购自Promega公司;DNA胶回收试剂盒购自TaKaRa公司;Taq plus DNA聚合酶为上海生工生物工程公司产品,受体菌JM 109由本实验室保存,其余试剂为进口或国产分析纯。
1.2 昆虫总RNA的提取
苜蓿实夜蛾总 RNA的提取参照RNA提取试剂盒说明,提取的总RNA放入-86℃冰箱中备用。
1.3 利用RT-PCR技术克隆基因cDNA序列片段
比较棉铃虫(H.armigera)(GenBank登录号EU325568)、小地老虎(Agrotis ipsilon)(GenBank登录号为FJ899541)2种昆虫几丁质脱乙酰基酶基因的cDNA序列,根据相同序列设计1对引物:HvCDA:5′-TAC ACA ATG TAC TTC AGA ATG CC-3′和 AntiHvCDA-5′-ACG CACGTC TGC AGG TTG ATG GT-3′。 以 Oligo(dt)3site adapter primer:5′-GAC TCG AGT CGA CAT CGA(T)17-3′为 cDNA 合成引物,利用反转录酶M-MLV Reverse Transcriptase合成第1链cDNA,具体参照M-MLV反转录酶使用说明。以合成的cDNA为模板,以HvCDA和AntiH-vCDA为引物扩增几丁质脱乙酰基酶cDNA序列的特异片段。PCR反应条件:94℃预变性3 min;94℃,30 s;58℃,1 min;72℃,2 min,30个循环;72℃延伸10 min。PCR产物回收,与 pGEM-T easy vector连接、转化、筛选、鉴定。连接正确的重组子由上海生工生物工程公司进行序列测定。克隆得到的cDNA的部分序列,用以设计5′和 3′RACE引物,克隆cDNA的全长序列。
1.4 利用RACE技术克隆cDNA全长序列
根据得到的cDNA片段设计克隆基因3′端的上游引 物 HvCDA 1-5′-CGA ACT AGA CCG TCG TGA GGA-3′。 利 用 HvCDA 、HvCDA1 和 3 site adapter primer:5′-GAC TCG AGT CGA CAT CGA-3′通过巢式PCR扩增基因的3′端,方法同上。
根据得到的cDNA片段设计2个克隆基因5′RACE的下游引物:Hv inner:5′-TGG CAA CGG TGA GGC ATT CTG AAG TAC ATA GTG T-3′;Hvinner outer:5′-GCA GCG TGG AAG TAG AGA CCT AA-3′,具体方法按照宝生物 5′RACE试剂盒说明进行。
1.5 序列分析
利用CLONE软件对获得的cDNA序列进行翻译,推导得到氨基酸序列。利用ExPASy网站(http:∥ca.expasy.org/tools/)的Compute pI/Mw蛋白分析软件推导氨基酸序列的分子量、等电点;SignalP 3.0 Server进行信号肽的预测;采用NCBI中conserved domain软件预测氨基酸序列中的功能区;利用DNAMAN和BOXSHADE3.21软件进行多重序列比对和系统进化树分析,氨基酸序列来自于NCBI中的通过blast(http:∥www.ncbi.nlm.nih.gov/blast)软件搜索得到的与克隆基因氨基酸序列一致性较高的序列以及正式发表的CDA文章中的序列,一致性百分数计算利用blastp获得。
2 结果与分析
2.1 苜蓿实夜蛾几丁质脱乙酰基酶基因cDNA序列的获得
利用RT-PCR和RACE技术扩增出苜蓿实夜蛾几丁质脱乙酰基酶基因cDNA全长序列,得到的cDNA序列及其推导的氨基酸序列在GenBank上用Blast软件搜索,找到一致性较高的序列均为昆虫几丁质脱乙酰基酶cDNA或氨基酸序列,该cDNA序列已经登录GenBank并获得登录号GU188855。
该基因的cDNA序列全长1 984个碱基,含有7个碱基和 351个碱基的 5′和3′非编码区,包括一个1 626个碱基的开放读码框,编码541个氨基酸组成的多肽,分子量61.86 ku,多肽的等电点为4.75。该基因的cDNA序列及其推导的氨基酸序列见图1。

图1 苜蓿实夜蛾几丁质脱乙酰基酶cDNA序列(GenBank登录号GU188855)和推导的氨基酸序列
2.2 苜蓿实夜蛾几丁质脱乙酰基酶氨基酸序列分析
利用ExPASy网站的蛋白结构域分析软件Scan-Prosite结合Radhika Dixit[3]对几丁质脱乙酰基酶结构域的分析,发现作者克隆的cDNA序列推导的氨基酸序列具有几丁质脱乙酰基酶所具有的3个明显结构区:几丁质结合区(chitin binding Peritrophin-A domain)(47~103),催化区(catalytic domain)(199~355),低密度脂蛋白受体区(low-density lipoprotein receptor class A domain)(LDLa)(124~158)。
SignalP 3.0 Server进行信号肽分析时发现在氨基酸的 23和 24位之间存在一个信号肽切割位点。
利用NetNGlyc 1.0 Server进行N位糖基化位点分析时发现,在氨基酸序列中存在3个N位糖基化位点,分别为 246 NYSA、276 NATV和298 NITD,证明该蛋白序列属于一种糖蛋白,在昆虫体内需要经过糖基化作用才能有效发挥酶活性。
2.3 昆虫几丁质脱乙酰基酶氨基酸序列一致性和系统进化分析
把克隆的苜蓿实夜蛾几丁质脱乙酰基酶的氨基酸序列用NCBI中的Blast软件进行搜索得到多个高一致性氨基酸序列,同时搜索已发表的CDA氨基酸序列3个,一致性结果如表1所示。氨基酸序列的一致性比较表明:苜蓿实夜蛾几丁质脱乙酰基酶的氨基酸序列与棉铃虫CDA(GQ411189)一致性达到98%,与埃及伊蚊CDA(XM_001656773)、赤拟谷盗CDA(NM_001102476)、冈比亚按蚊CDA(XM_320597)、黑腹果蝇CDA(NM_168811)、意大利蜜蜂CDA(XM_391915)的一致性也都达到84%以上,而与另外3种昆虫粉纹夜蛾CDA(AY966402)、蓓带夜蛾CDA(EU660852)和棉铃虫CDA(GQ411190GQ411191EF600051)氨基酸序列间的一致性只有36%~38%,一致性较低。系统进化分析树表明(图3),本文所列举的12个CDA属于两类不同的CDA类群,它们之间差异较大,特别是在N端150个氨基酸内存在较大差异(图2)。

表1 不同昆虫来源CDA基本特征及与苜蓿实夜蛾CDA序列的一致性
3 讨论
2005年首个能够编码类似CDA的cDNA从粉纹夜蛾(Trichop lusia ni)的中肠中被克隆出来[10]。该CDA与中肠围食膜紧密结合,虽然没有几丁质结合区,但具有很强的几丁质结合活性。但该研究没有证明出这个CDA具有几丁质脱乙酰基酶的活性。2006年有2个能编码具有典型CDA功能域的CDA从黑腹果蝇(Drosophila melanogaster)中克隆出来[11-12]。2008年至今从棉铃虫(Helicoverpa armigera)中克隆得到4个CDA基因,分别属于2个不同的 CDA类型,但没有进行活性和功能的研究[13]。2009年在对赤拟谷盗(Tribolium castaneum)中编码具有CDA功能区蛋白的分析表明在该虫体内存在多种CDA,并利用RNA干扰技术对各个CDA的功能进行了研究,结果表明注射TcCDA3到TcCDA9的dsRNAs后,昆虫没有可观测到的表型变化,而注射 TcCDA1或 TcCDA2的dsRNAs后能影响昆虫的蜕皮和羽化过程,昆虫不能够脱去旧表皮,成虫期表现出明显的形态变化[9]。另外一种夜蛾科昆虫蓓带夜蛾(Mamestra conf igurata)的研究结果表明,该虫中与粉纹夜蛾一致的CDA基因在大肠杆菌表达系统中表达出了酶活性[14]。


图2 苜蓿实夜蛾与其他昆虫几丁质脱乙酰基酶氨基酸序列比对分析
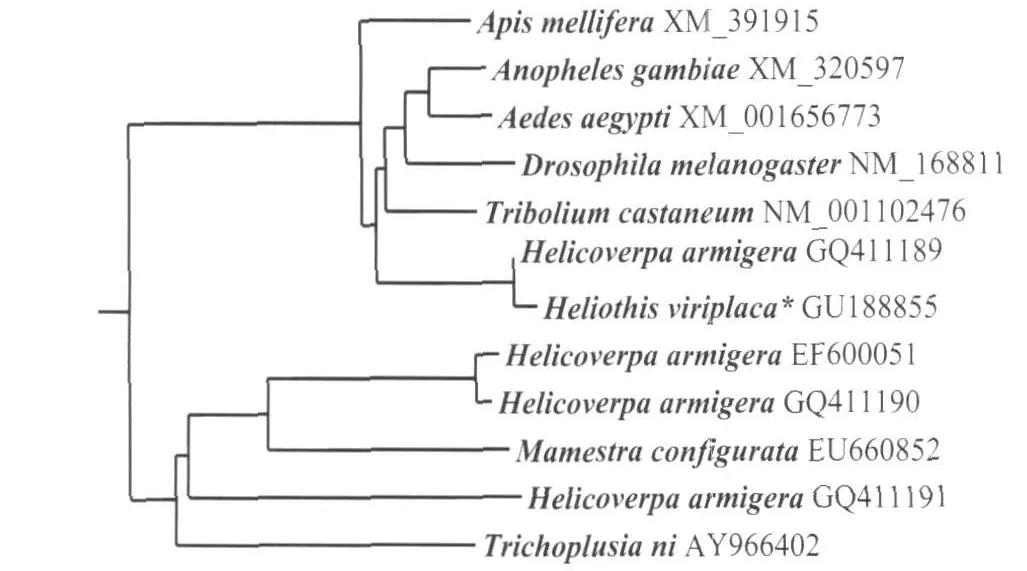
图3 苜蓿实夜蛾与其他昆虫几丁质脱乙酰基酶氨基酸序列系统进化分析
本研究中列举的CDA氨基酸序列分析表明,苜蓿夜蛾CDA的氨基酸序列与其他昆虫之间的一致性存在较大差异,CDA的氨基酸序列比对结果可以明显分为2类,一类氨基酸一致性在80%以上,另一类氨基酸序列一致性不到40%,比对结果表明同一昆虫体内可能存在多类CDA。昆虫CDA在系统进化树上的相互关系不能完全符合形态分类关系也表明在昆虫体内可能存在多种CDA,在棉铃虫中已经克隆出 4个 CDA基因,分别属于2个不同的CDA类群,初步证明了我们的推断。CDA 2个类群除了氨基酸序列差异较大以外,在结构域上也存在较大差异,与苜蓿实夜蛾CDA氨基酸一致性在80%以上的类群均存在典型的3个功能域,几丁质结合区、催化区、低密度脂蛋白受体区;而与之一致性不足40%的类群只有一个结构域,没有几丁质结合区和低密度脂蛋白受体区。本文中只克隆了苜蓿实夜蛾CDA的cDNA序列一条,为全面了解CDA基因的种类和功能,苜蓿实夜蛾体内其他类型CDA还需进一步的试验证实。
如果CDA具有酶活性,那么在它催化下可使几丁质产生壳聚糖,而壳聚糖对围食膜可能具有4种重要功能:壳聚糖的存在可以调节几丁质的柔韧性和硬度[11,13];由于壳聚糖具有抗氧化剂的特性使其具有氧化还原调控作用,因此使围食膜成为抗氧化物质[15-16];壳聚糖具有抗菌功能[17];壳聚糖的存在利于其他蛋白与几丁质的结合[13]。因此无论研究哪一类CDA,都必须对其活性进行测定,本研究后续工作将着重对克隆的基因进行表达和活性测定,明确该基因的功能,为进一步实践应用创造条件。
[1] Tsigos I,Bouriotis V.Purification and characterization of chitin deacetylasefrom Colletotrichum lind emuthianum[J].JBiol Chem,1995,270:26286-26291.
[2] Kramer K J,Muthuk rishnan S.Insect chitinases:molecular biology and potential use as biopesticides[J].Insect Biochem Mol Biol,1997,27:887-900.
[3] K ramer K J,Koga D.Insect chitin:phy sical state,synthesis,degradation and metabolic regulation[J].Insect Biochem Mol Biol,1986,16:851-877.
[4] K ramer K J,Corpuz L,Choi H K,et al.Sequence of a cDNA and exp ression of thegene encoding epidermal and gut chitinases of Manduca sexta[J].Insect Biochem Mol Biol,1993,23:691-701.
[5] Radhika D,Yasuyuki A,Charles A,et al.Domain organization and phy logenetic analysis of proteins from the chitin deacetylase genefamily of Tribolium castaneum and three other species of insects[J].Insect Biochem Mol Biol,2008,38:440-451.
[6] Araki Y,Ito E.A pathway of chitosan formation in Mucor rouxii:enzymatic deacetylation of chitin[J].Eur J Biochem,1975,55:71-78.
[7] Davis L L,Bartnicki-Garcia S.Chitosan synthesis by the tandem action of chitin synthetaseand chitin deacetylasefrom Mucor rouxii[J].Biochemistry,1984,23:1065-1073.
[8] Alfonso C,Nuero O M,Santamaria F,et al.Purification of a heat-stable chitin deacetylasefrom Aspergillusnid ulans and its role in cell wall degradation[J].Cur r Microbiol,1995,30:49-54.
[9] Yasuyuki A,Rad hika D,Khurshida B,et al.Analy sis of functions of thechitin deacety lasegene family in Tribolium castaneum[J].Insect Biochem Mol Biol,2009,39:355-365.
[10]Guo W,Li G,Pang Y,et al.A novel chitin-binding protein identified from theperitrophic membrane of the cabbage looper,Tr ichoplusia ni[J].Insect Biochem Mol Biol,2005,35:1224-1234.
[11]Luschnig S,Bätz T,A rmbruster K,et al.Serpentine and vermiform encodematrix proteins with chitin-binding and deacetylation domains that limit tracheal tube length in Drosophila[J].Curr Biol,2006,16:186-194.
[12]Wang S,Jayaram A S,Hemphala J,et al.Septate-junctiondependent luminal deposition of chitin deacetylases restricts tube elongation in the Drosophila trachea[J].Curr Biol,2006,16:180-185.
[13]Peter M C,Anh T C,Eric R H,et al.Proteomic analysis of the peritrophic matrix from the gut of the caterpillar,Helicoverp a armigera[J].Insect Biochem M ol Biol,2008,38:950-958.
[14]Toprak U,Baldwin D,Erlandson M,et al.A chitin deacetylase and putative insect intestinal lipases are comp onents of the Mamestra conf igur ata(Lepidoptera:Noctuidae)peritrophic matrix[J].Insect Mol Biol,2008,17:573-585.
[15]Summers C B,Felton G W.Peritrophic envelope as a functional antioxidant[J].Arch Insect Biochem Physiol,1996,32:131-142.
[16]Barbehenn R V,Stannard J.Antioxidant defense of the midgut epithelium by the peritrophic envelope in caterpillars[J].J Insect Physiol,2004,50:783-790.
[17]Park P J,Je J Y,Kim S K.Free radical scavenging activities of differently deacetylated chitosans using an ESRspectrometer[J].Carbohydr Polym,2004,55:17-22.
