野生茄叶片土壤添加物和浸提物调控茄子黄萎病抗性的机制初探
2011-06-12李云鹏周宝利李之璞尹玉玲
李云鹏, 周宝利, 李之璞, 尹玉玲
(1.黑龙江大学农业资源与环境学院,哈尔滨 150080; 2.沈阳农业大学园艺学院,沈阳 110161;3.沈阳市农业科学院,沈阳 110034)
随着蔬菜专业化生产和设施栽培的发展,茄子连作栽培越来越普遍,致使茄子黄萎病逐年加重,一般发病后产量损失20%~30%,严重时损失达60%以上,有的地块近于绝收[1]。目前,生产上利用野生抗病茄作为砧木进行嫁接,起到了较好的防治效果,同时砧木野生茄的抗病性也得到了验证[2-3]。但嫁接技术耗费人力财力,且对技术、环境、植株都有严格的要求,在一定程度上限制了其应用。近年来化感作用成为人们研究的热点,植物主要通过其地上部的挥发、雨水淋洗、根系分泌、植株残体的腐解以及花粉直感等途径向环境中释放化感物质,从而对周围生物产生直接或间接的、有害或有利的影响[4]。利用化感作用原理,从植物中提取、分离有生物活性的化感物质或合成相应的化合物前体,它们可以是土壤微生态调节剂、有害化感物质的降解剂或土壤消毒剂,可以起到控制作物病害的作用;通过向土壤中施入以植物残体为主的添加物,使其在土壤中挥发、分解或被土壤水溶析出化感物质可抑制病原微生物,实现防病功效。目前,国内外学者将此法作为作物病害生物防治的一种环境友好方法,进行了许多有益研究[5-12]。本课题组前期研究表明,野生抗病茄托鲁巴姆(Solanum torvum)叶片腐解物[13]和浸提物[14],对茄子黄萎病菌具有较强的抑制作用,防病效果明显。本文在此基础上,初步研究了托鲁巴姆叶片土壤添加物和浸提物控制茄子黄萎病抗性的生理机制,以期为充分利用野生茄子资源抗黄萎病等土传病害,克服连作障碍,提供理论依据。
1 材料与方法
1.1 供试材料
野生茄叶片材料:种植野生茄托鲁巴姆(Solanum torvum),当试材接近成熟期时采集叶片,清洗干净,于干燥箱内60℃烘干,粉碎过40目筛(孔径0.37 mm)备用。
盆栽试验所用试材:感病品种‘西安绿茄'(Solanum melongena L.)。
供试菌种:茄子黄萎病菌(Verticillium dahliae),于茄子连作病圃中发病植株上分离得到,按照柯赫氏法则鉴定后用于试验。
药剂:50%五氯硝基苯可湿性粉剂,防治对象为茄子黄萎病、褐纹病等。
1.2 盆栽防病试验
土壤添加物防病试验:取粉碎叶片24 g,与2 kg茄子连作土(其中加入了占总量1/4的腐熟过筛马粪)混合均匀,装入花盆,浇 500 mL清水,用塑料布覆盖严密,日晒14 d后揭去塑料布再晾晒7 d,得到含有叶片腐解物的土壤混合物,然后定植茄子植株。以先接种病原菌再定植茄株的为治疗处理,以定植5 d后再接种病原菌的为预防处理。同时设药剂处理(每盆以1.5 g/L的50%五氯硝基苯可湿性粉剂0.5 L灌根)和不加任何添加物的对照(CK)。
浸提物防病试验:称取粉碎后的叶片材料,按1∶5(W/V)加入 80%乙醇,超声波振荡 60 min,3 500 r/min离心20 min,取上清液于MAXI dry lyo型冻干机上冷冻浓缩至干,再以50%乙醇定容至1 g/mL,为浸提物母液,于4℃冰箱保存备用。预防处理为定植后以浸提物母液的100倍稀释液0.5 L灌根,5 d后将植株取出接种茄子黄萎病菌,治疗处理为先接种病原菌悬浮液,然后以浸提液灌根,浸提液的用量同预防处理。同时设药剂处理(每盆以1.5 g/L的50%五氯硝基苯可湿性粉剂0.5 L灌根)和清水灌根的对照(CK)。
土壤添加物和浸提物试验均为每处理6盆,每盆定植1株。采取蘸根法接种,黄萎病菌孢子悬浮液浓度为1×107cfu/mL。按照黄萎病的分级标准[15],于对照严重发病时调查发病情况,计算病情指数和防效。

1.3 盆栽生长状况及抗性相关生理指标测定
以近10年未种植过茄科植物的非连作土壤(其中加入了占总量1/4的腐熟过筛马粪)为基质(前茬为甜瓜),于茄子幼苗3片真叶展开时进行温室盆栽定植。土壤添加物的处理方法、浸提物的施用方法均同防病试验(1.2),不同之处是浸提物处理定植时灌根1次,之后每5 d灌根1次,共处理5次。各处理均设接菌和不接菌2种处理方式,接菌处理为定植5 d后再接菌,即采取预防处理方法接菌。设清水灌根为对照(CK)。每个处理种植8盆,3次重复,田间随机区组排列。
取样方法:于浸提液最后一次处理后的第10天取样测定。未接菌区选取生长一致的健壮植株取样,接菌区选取发病相对一致能代表本区普遍水平的植株取样,每小区取样3株,取样时尽量不伤害根系。
生长指标的测定:分别测定植株的株高、茎粗、根长、叶面积(用便携式叶面积仪MODEL L1-3000测定)、地上部分干重和根干重。
植株生理指标的测定:根系活力、细胞膜透性、丙二醛(MDA)含量、脯氨酸含量和可溶性糖含量分别采用T TC法、外渗电导法、硫代巴比妥酸(TBA)比色法、茚三酮显色法和蒽酮法测定[16]。小区内3株植株混合取样,每个小区样品作为1次重复,共3次重复。
1.4 数据统计分析
采用Microsoft Excel软件进行数据处理,用DPS统计软件以 Duncan新复极差法进行显著性分析。
2 结果与分析
2.1 土壤添加物和浸提物的防病效果
土壤添加物治疗和预防处理的病情指数均与药剂处理无显著差异,但显著低于对照(见表1);浸提物治疗和预防处理的病情指数均极显著低于对照和药剂(见表2)。其中,土壤添加物预防处理的防治效果为50.00%,浸提物治疗和预防处理的防治效果分别为66.15%和65.68%,均达50.00%以上。

表1 土壤添加物的防病效果1)
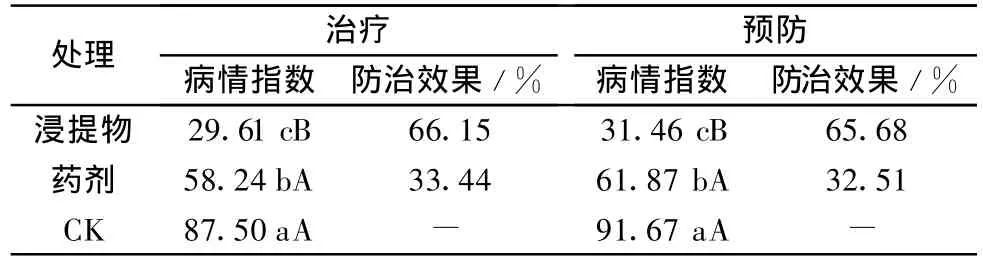
表2 浸提物的防病效果1)
2.2 土壤添加物和浸提物对茄子植株生长的影响
野生茄叶片土壤添加物和浸提物对茄子植株生长状况具有一定的影响,多数指标优于对照。从各处理的未接菌植株与接菌植株方差分析结果可见,接菌(感病)后多数生长指标显著降低。土壤添加物处理的未接菌植株,除根冠比与对照差异不显著外,其他各生长指标均显著高于对照,土壤添加物处理的接菌植株,株高、根长、地上部分干重和叶面积均显著高于对照,根干重和根冠比与对照差异不显著,而茎粗显著低于对照。浸提物处理的未接菌植株,除株高显著高于对照外,其他各生长指标均与对照差异不显著,浸提物处理的接菌植株,株高和叶面积显著高于对照,茎粗显著低于对照,其他各生长指标均与对照无显著差异。总体看,经土壤添加物处理的植株,生长状况明显优于相应对照,经浸提物处理的植株,多数生长指标也略高于对照;但土壤添加物和浸提物的接菌植株茎粗均较对照降低(表3)。
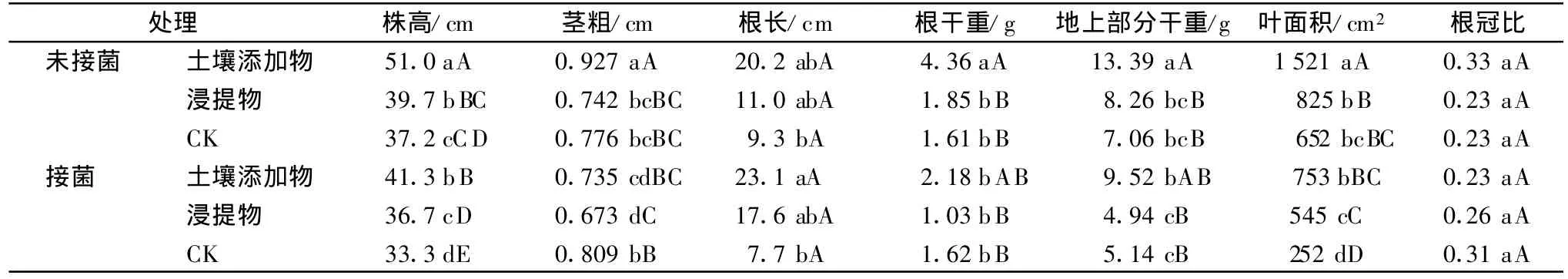
表3 各处理对茄子植株生长状况的影响1)
2.3 土壤添加物和浸提物对茄子植株抗性相关生理指标的影响
2.3.1 土壤添加物和浸提物对茄子根系活力的影响
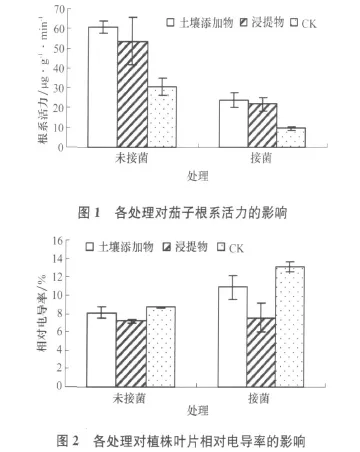
土壤添加物和浸提物处理均能提高未接菌和接菌植株的根系活力。土壤添加物和浸提物处理的未接菌植株根系活力分别较对照提高96.18%和73.77%,接菌植株分别较对照提高 149.83%和127.29%。方差分析表明,土壤添加物和浸提物处理的未接菌和接菌植株根系活力均显著高于相应的对照。各处理未接菌植株的根系活力均显著高于接菌植株。可见,接菌(感病)后植株根系活力显著下降,但土壤添加物和浸提物处理能够缓解根系活力下降的幅度(图1)。
2.3.2 土壤添加物和浸提物对茄子叶片细胞膜透性的影响
植物组织在受到逆境伤害时,膜结构会遭破坏,使膜透性大大增加,细胞内的物质(尤其是电解质)大量外渗,从而引起组织浸泡液的电导率增大。本试验表明(图2),各处理的未接菌植株叶片电导率均低于接菌植株,但只有对照差异显著。土壤添加物和浸提物处理对植株叶片电导率均有降低的作用,未接菌植株分别较对照降低6.67%和17.10%,但均与对照差异不显著,接菌植株分别较对照降低16.89%和42.25%,其中浸提物处理的接菌植株显著低于对照。可见,在接菌(感病)情况下,土壤添加物和浸提物处理可减轻病原菌侵染造成的逆境对膜质的伤害程度。
2.3.3 土壤添加物和浸提物对茄子植株丙二醛含量的影响
植物在逆境条件下,往往发生膜脂过氧化作用,其产物丙二醛(MDA)会严重损伤生物膜,通常利用它作为脂质过氧化的指标。本试验表明(图3),土壤添加物处理的未接菌植株叶片MDA含量与接菌植株差异不显著,而浸提物处理及对照的接菌植株叶片MDA含量均显著高于未接菌植株。土壤添加物和浸提物处理的未接菌植株叶片MDA含量与对照差异不显著,而接菌植株显著低于对照。
土壤添加物处理的未接菌植株根系的MDA含量与接菌植株相差不大,浸提物处理和对照的接菌植株MDA含量显著高于未接菌植株。土壤添加物和浸提物处理的未接菌植株根系的MDA含量均与对照差异不显著;土壤添加物处理的接菌植株根系MDA含量显著低于对照,而浸提物处理与对照差异不显著。
可见,土壤添加物和浸提物处理具有降低接菌(感病)植株叶片及根系MDA含量的作用。
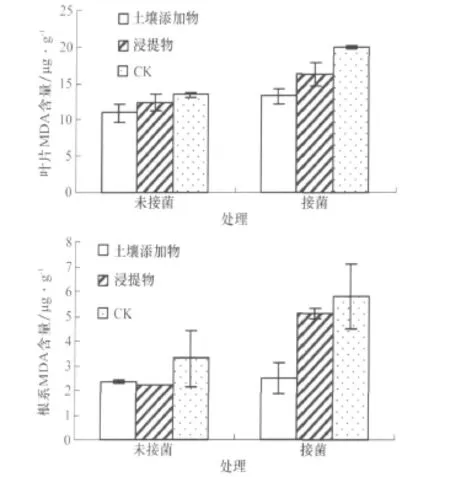
图3 各处理对茄子叶片和根系MDA含量的影响
2.3.4 土壤添加物和浸提物对茄子植株脯氨酸含量的影响
各处理接菌植株叶片和根系脯氨酸含量均显著高于未接菌植株,土壤添加物、浸提物和对照的接菌植株较未接菌植株叶片脯氨酸含量分别增加60.24%、109.44%和 228.61%,根系分别增加39.51%、62.76%和633.63%。土壤添加物和浸提物处理的未接菌植株叶片和根系脯氨酸含量均与对照相差不大,而接菌植株均显著低于对照(图4)。可见,土壤添加物和浸提物能够降低接菌(感病)条件下植株叶片和根系脯氨酸含量上升的幅度。
2.3.5 土壤添加物和浸提物对茄子植株可溶性糖含量的影响
土壤添加物和浸提物处理的接菌植株叶片可溶性糖含量较未接菌植株升高,而对照则降低。土壤添加物处理的未接菌植株叶片可溶性糖含量显著低于对照,浸提物与对照差异不显著;土壤添加物和浸提物处理的接菌植株叶片可溶性糖含量均显著高于对照(图5)。
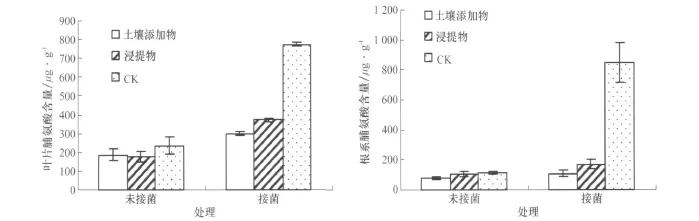
图4 各处理对茄子叶片和根系脯氨酸含量的影响
土壤添加物和浸提物处理的接菌植株根系中可溶性糖含量较未接菌植株降低,这与叶片中可溶性糖含量的变化不同。土壤添加物和浸提物处理的未接菌和接菌植株根系中可溶性糖含量均显著高于相应的对照。对照接菌植株根系中可溶性糖含量较未接菌植株极显著下降,而土壤添加物和浸提物处理则能够保持相对较高的水平(图5)。
可见,土壤添加物和浸提物处理能够通过提高植株叶片和根系中可溶性糖含量水平而抵御病菌侵染造成的逆境。
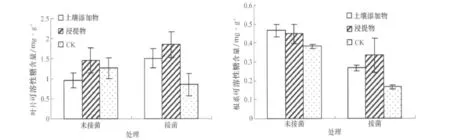
图5 各处理对茄子叶片和根系中可溶性糖含量的影响
3 结论与讨论
本研究表明野生茄托鲁巴姆叶片土壤添加物和浸提物对茄子黄萎病的预防和治疗效果显著。土壤添加物和浸提物有促进植株生长、提高植株根系活力的作用,经土壤添加物和浸提物处理的接菌(感病)植株叶片相对电导率增幅明显低于对照,叶片和根系的MDA和脯氨酸含量显著低于对照,可溶性糖含量显著高于对照。
本课题组前期研究[17]发现,野生茄托鲁巴姆叶片土壤腐解混合物和浸提物在浓度为0.5~40 g/L范围内,对茄子黄萎病菌菌丝生长均表现出随浓度增大,化感抑制作用增强的趋势,且浓度为 10~40 g/L范围内,抑制率变化不大。本研究考虑到试材的用量问题,故选择了浓度为12 g/L对应的混合比率。
在进行盆栽试验时,为防止土壤发生板结和增加肥力,在所用土壤中加入了占总量1/4的腐熟马粪。因此认为,野生茄叶片土壤添加物对土壤有机质和营养的影响应该可以忽略不计,处理对植株的影响主要是化感作用的结果。为了更好地研究土壤添加物和浸提物对连作条件下茄子黄萎病的防效,防病试验用的是茄子连作病土,土壤中存在茄子黄萎病菌且土壤微生物种群结构处于失衡状态[18-19]。为比较处理对接菌(感病)和不接菌(健康)植株的影响,以探讨处理调控茄子黄萎病抗性的可能机制,生长状况及抗性相关生理指标测定所用盆栽土壤为近10年未种植过茄科植物的非连作土壤,土壤中不含黄萎病菌,土壤微生物种群结构较合理[19]。
有关土壤添加剂的相关研究均表明,良好的土壤添加剂不仅能增加土壤的养分含量,改善土壤理化性状,促进植物生长发育,提高产量和品质,对土传根部病害也有较好的控制作用[5-7,9-10]。植物的根系是吸收水肥的重要器官,又是物质同化、转化和合成的器官,因此根系的生长发育状况直接影响植物个体的生命活动。张磊等[20]研究认为,根系活性升高能提高茄子植株抗逆性。本试验研究了野生茄托鲁巴姆叶片土壤添加物和浸提物对植株的生长状况的影响,土壤添加物和浸提物在降低茄子黄萎病病情指数的同时,还能够改善植株生长发育状况(其中,植株叶面积增加最明显),根系活力增强。
细胞膜的选择透性是其最重要的功能之一,各种逆境伤害都会造成质膜选择透性的改变或丧失,其在一定程度上反映了细胞的受损程度,并与植物的抗逆性密切相关[21]。丙二醛(MDA)作为膜脂过氧化作用的最终产物,其含量是膜脂过氧化程度的一个重要标志,而膜脂过氧化的加剧引起质膜透性增大,致使电解质大量外渗,因此植物组织浸泡液的电导率和MDA含量常作为细胞膜伤害程度的指标。嫁接茄子苗期黄萎病抗性与相对电导率和MDA含量显著降低有关[22]。本研究表明,土壤添加物和浸提物处理的植株叶片相对电导率增幅明显低于对照,相对电导率值也显著低于对照;土壤添加物和浸提物能够降低接菌(感病)条件下叶片和根系MDA含量。可见,土壤添加物和浸提物能够减轻植株体因病原菌侵染而造成的膜脂过氧化作用强度,降低膜伤害程度,从而提高植株抗病性。
脯氨酸在植物体内具有束水能力,对维持酶的正常活性及细胞膜透性、稳定蛋白质特性具有重要作用。本研究中,土壤添加物和浸提物处理的感病植株叶片和根系脯氨酸含量均低于对照,这与嫁接茄抗病研究中脯氨酸含量的变化一致[14]。这种变化的原因可能是土壤添加物和浸提物处理的植株抗病性提高,感病程度较低,致使以积累脯氨酸来缓解病原菌侵害的作用减弱。可溶性糖在植物体内大量存在,高糖有利于茄科植物抗黄萎病[3]。在接菌逆境下,土壤添加物和浸提物处理的病株叶片和根系可溶性糖含量均显著高于对照,且在未接菌条件下根系可溶性糖含量也明显高于对照,这亦与嫁接茄抗病研究中可溶性糖含量的变化一致[3]。可见,土壤添加物和浸提物可提高接菌(感病)植株可溶性糖含量,从而增强植株的抗病性。
综上所述,认为野生茄叶片土壤添加物和浸提物能够提高植株抗膜脂过氧化的能力,保持细胞膜的稳定性,调节植株体内抗病相关生理活性物质含量,从而提高茄子植株的黄萎病抗性,取得良好的防病效果。因此认为,利用野生茄叶片土壤添加物和浸提物来调控茄子土传病害黄萎病抗性是可行的。本试验为利用野生抗病茄托鲁巴姆防治茄子黄萎病提供了理论依据。土壤添加物和浸提物对环境无毒、无污染,能够维护健康、和谐、安全的栽培生态环境,符合可持续发展的原则,因此具有较大的应用潜力。本文仅报道了野生茄叶片土壤添加物和浸提物对茄子植株部分抗性生理指标的影响,其他抗性调控机制尚待进一步探讨。
[1]李怀芳,刘凤权,郭小密.园艺植物病理学[M].北京:中国农业大学出版社,2001.
[2]高梅秀,李树和,刘玉芹,等.不同砧木对茄子抗病性、生理活性及产量的影响[J].园艺学报,2001,28(5):463-465.
[3]周宝利,林桂荣,高艳新,等.嫁接茄抗黄萎病特性与苯丙烷类代谢的关系[J].沈阳农业大学学报,2000,31(1):57-60.
[4]孔垂华,胡飞.植物化感(相生相克)作用及其应用[M].北京:中国农业出版社,2001.
[5]郝永娟,王万立,刘耕春,等.土壤添加剂防治作物土传病害研究概述[J].天津农业科学,2000,6(2):52-54.
[6]曲再红,杜相革.土壤添加物、土壤微生物和番茄苗期生长相互关系的研究[J].中国农学通报,2004,20(4):84-86.
[7]甄文超,曹克强,代丽,等.利用药用植物源土壤添加物控制草莓再植病害的研究[J].中国农业科学,2005,28(4):730-735.
[8]杨玉萍,李艾莲.植物源杀菌剂研究进展[J].中国农业科技导报,2006,8(1):49-53.
[9]Pavlou G C,Vakalounakis D J.Biological control of root and stem rot of greenhouse cucumber,caused by Fusarium oxysporum f.sp.radicis-cucumerinum,by lettuce soil amendment[J].Crop Protection,2005,24:135-140.
[10]Tegegne G,Pretorius J C,Swart W J.Antifungal properties of Agapanthus africanus L.ex tracts against plant pathogens[J].Crop Protection,2008,27:1052-1060.
[11]张慧,徐大高,潘汝谦,等.一些植物提取物的抗菌活性筛选[J].植物病理学报,2008,38(4):441-444.
[12]张淑红,周宝利,张磊,等.土壤添加蛇床子(Cnidium monn ieri)和苦参(Sophora f lavescens)对茄子黄萎病及根际微生物的化感影响[J].生态学报,2008,28(10):5194-5199.
[13]李云鹏,周宝利,李之璞,等.野生抗病茄植株腐解物对茄子黄萎病的调控研究[J].植物保护,2007,33(3):50-52.
[14]李之璞,周宝利,李云鹏.利用野生茄提取物控制栽培茄子黄萎病的研究[J].辽宁农业科学,2007(2):34-35.
[15]周宝利,高艳新,林桂荣,等.嫁接茄子抗病性与电导率、脯氨酸含量及苯丙氨酸解氨酶活性的关系[J].园艺学报,1998,25(3):300-302.
[16]郝建军,刘延吉.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,2001.
[17]李云鹏.野生茄对茄子黄萎病菌的化感作用及利用研究[D].沈阳:沈阳农业大学园艺学院,2007.
[18]尹玉玲,周宝利,李云鹏,等.嫁接对茄子连作土壤生物活性及种子萌发和幼苗生长的影响[J].生态学杂志,2009,28(4):638-642.
[19]王茹华,周宝利,张启发,等.嫁接对茄子根际微生物种群数量的影响[J].园艺学报,2005,32(1):124-126.
[20]张磊,周宝利,张淑红,等.三种植物提取物对茄黄萎病菌生长和与茄幼苗抗逆性有关生理指标的影响[J].植物生理学通讯,2006,42(5):989-990.
[21]陈捷.植物病理生理学[M].沈阳:辽宁科学技术出版社,1994.
[22]郑阳霞,李能芳,钟宇.嫁接茄子苗期黄萎病抗性生理指标的研究[J].上海交通大学学报(农业科学),2005,23(1):89-91.
