高温处理对脱脂豆粕中大豆分离蛋白结构的影响
2011-11-28黄友如陈义勇朱东兴王叹玉
黄友如 陈义勇 朱东兴 赵 阳 王叹玉
高温处理对脱脂豆粕中大豆分离蛋白结构的影响
黄友如 陈义勇 朱东兴 赵 阳 王叹玉
(常熟理工学院生物与食品工程学院,常熟 215500)
以不同温度处理的脱脂豆粕为原料,制备大豆分离蛋白,通过紫外光谱、荧光光谱、电泳及浊度测定等方法探讨了高温处理对脱脂豆粕中大豆分离蛋白结构的影响,结果表明:热处理可促使蛋白多肽链局部展开,色氨酸等残基暴露并部分氧化,产生一些新荧光物质;凝胶电泳分析显示,热处理样品的高分子区域条带渐趋显著,各亚基条带呈现扩散趋势,蛋白质相对分子质量分布范围变宽;浊度分析表明,随着样品热处理温度升高,大豆分离蛋白的混浊度增加。
高温处理 脱脂豆粕 大豆分离蛋白 结构
工业化生产的低温脱脂豆粕中含有许多残留脂质,在高温贮藏过程中,残留脂质尤其是多不饱和脂质的氧化将产生脂质自由基及其降解产物,这些衍生自由基及其降解产物可与豆粕中的蛋白质发生反应,改变蛋白质的结构,进而影响以此为原料制备的大豆蛋白的品质[1]。因此,对脱脂豆粕进行高温处理,研究不同温度条件下残留脂质的氧化情况及其对蛋白质结构的影响,对延长大豆蛋白食品的货架期、保证产品的品质与营养价值意义深远。
本研究主要以低温脱脂大豆粕为原料,分别采用室温(30℃)、40、50、60℃4种不同的温度对已粉碎的脱脂豆粕进行18 h的温度处理,再以“碱提酸沉”工艺制备大豆分离蛋白,采用电泳及光谱分析方法如混浊度、紫外吸收光谱、280 nm激发的大豆分离蛋白内源性荧光光谱、激发光谱和发射光谱,SDSPAGE和原态PAGE等,分析高温处理对脱脂豆粕中蛋白质的结构影响。
1 材料与方法
1.1 试验材料、试剂和仪器
低温脱脂豆粕由东海粮油工业(张家港)有限公司提供,其他试剂均为分析纯。UV2450型紫外可见分光光度计、RF-5301PC型荧光分光光度计:日本岛津公司。
1.2 低温脱脂豆粕的高温处理
称取低温脱脂豆粕1 000 g,粉碎后100%过60目标准筛,将其分成4等份,一份置于室温(30℃)下做对照,另3份置于烘箱中,分别采用40、50、60℃3种不同温度处理18 h(处理厚度为2 mm),取出冷却后,分别放入密封袋中密封保存。
1.3 脂肪氧合酶活力的测定
脂肪氧合酶活力的测定参照黄友如等[2]的方法。
1.4 大豆分离蛋白的制备
将高温处理后的脱脂豆粕粉按料液比1∶10的比例与水混合,温度 30℃,低速搅拌(30~35 r/min),用1.0 mol/L NaOH 溶液调至 pH 7.5,继续搅拌30 min。悬浮液离心15 min(2 000 r/min),回收上清液,沉淀(豆渣)弃去。上清液边搅拌边加入1.0 mol/L HCl溶液(30 ~35 r/min),调至pH 4.5,继续搅拌 10 min后,悬浮液离心 15 min(2 000 r/min),弃去上清液(大豆乳清),取沉淀水洗,水洗后的蛋白沉淀分散于去离子水中并用1.0 mol/L NaOH调至pH 7.0。所得蛋白溶液冷冻干燥后粉碎并过80目标准筛。
1.5 大豆分离蛋白的紫外吸收光谱
将大豆分离蛋白溶于0.01 mol/L pH 7.0的磷酸盐缓冲液中,配制成2.0 mg/mL的蛋白质溶液,3 000 r/min离心10 min,以0.01 mol/L pH 7.0 的磷酸盐缓冲液作参比,作紫外 -可见扫描,速度10 nm/s,范围200~800 nm之间。
1.6 280 nm激发的大豆分离蛋白内源性荧光光谱
将大豆分离蛋白溶于0.01 mol/L pH 7.0的磷酸盐缓冲液中,配制成1.0 mg/mL的蛋白质溶液,3 000 r/min离心10 min,以pH 7.0的磷酸盐缓冲液作参比,进行荧光测定,激发波长280 nm,发射光谱扫描范围在300~800 nm之间。
1.7 大豆分离蛋白的激发光谱和发射光谱测定[3]
将大豆分离蛋白溶于0.01mol/L pH 7.0的磷酸盐缓冲液中,配制成2.0 mg/mL的蛋白质溶液,3 000 r/min离心10 min,以pH 7.0的磷酸盐缓冲液作参比进行荧光测定,发射光谱:激发波长固定在355 nm,扫描范围300~800 nm;激发光谱:发射波长固定在440 nm,扫描范围220~800 nm。
1.8 大豆分离蛋白的SDS聚丙烯酰胺凝胶电泳(SDS - PAGE)[4]
分离胶12.75%;浓缩胶4%;电极缓冲液含0.05 mol/L Tris,0.384 mol/L 甘 氨 酸,0.1% SDS(pH 8.3);电泳样品用样品溶解液(内含2%SDS,5%β - 巯基乙醇,10% 甘油,0.02% 溴酚蓝,0.01 mol/L pH 8.0 Tris-HCl缓冲液)配制成蛋白浓度为1 mg/mL。电泳采用0.75 mm凝胶板;上样量为10 μL;开始电泳时电流为10 mA,待样品进入分离胶后改为20 mA;考玛斯亮蓝染色。
1.9 大豆分离蛋白PAGE原态电泳
分离胶 5%;浓缩胶 4%;电极缓冲液含0.05 mol/L Tris,0.384 mol/L 甘氨酸,pH 8.3;电泳样品用样品溶解液(内含10%甘油,0.02%溴酚蓝,0.01 mol/L pH 8.0 Tris-HCl缓冲液)配制成蛋白浓度为1 mg/mL。电泳采用0.75 mm凝胶板;上样量为10μL;样品直接溶于样品溶解液中,在1 500×g下离心10 min后样品溶解液不经过加热处理,直接电泳进样;开始电泳时电流为10 mA,待样品进入分离胶后改为20 mA;考玛斯亮蓝染色。
2.0 大豆分离蛋白溶液混浊度的测定[5]
将大豆分离蛋白溶于0.01 mol/L pH 7.0的磷酸盐缓冲液中,室温下用磁力搅拌器搅拌60 min,分别配制成 20、40、60、80、100 mg/mL 的溶液,使用分光光度计在600 nm下测定其吸光度。
2 结果与分析
2.1 不同温度处理下脱脂豆粕中脂肪氧合酶活力
表1为不同温度处理下脱脂豆粕中脂肪氧合酶的活力。与室温(30℃)条件下贮藏的脱脂豆粕相比较,经40、50、60℃处理后的脱脂豆粕,其脂肪氧合酶活力随热处理温度上升均有所降低,但各样品的脂肪氧合酶活力在P≥0.05水平上并没有明显差异,说明在此温度范围内,粉末状脱脂豆粕(含水量为10.32%)中脂肪氧合酶的热稳定性较好,在其后的分离蛋白制备过程中,脂肪氧合酶对大豆分离蛋白结构的贡献相同。
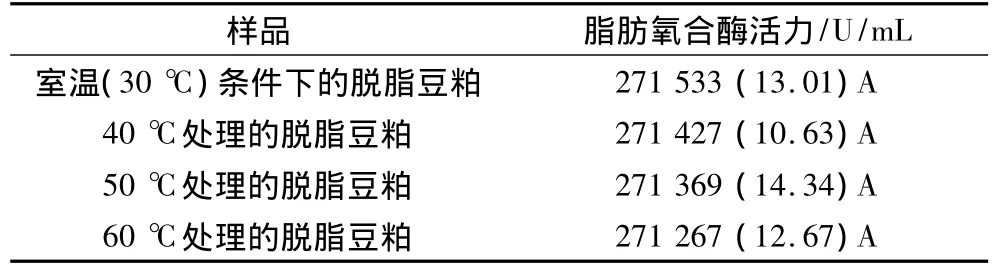
表1 不同温度处理下脱脂豆粕中脂肪氧合酶的活力
2.2 大豆分离蛋白的紫外吸收光谱
紫外光谱可用来研究蛋白侧链的变化(如酪氨酸残基的裸露程度),探讨热处理对大豆蛋白三级结构的影响[6]。图1为改性大豆分离蛋白的紫外可见光谱。经过40、50、60℃处理后的样品在280 nm附近的吸收峰强度增加,峰型变窄,说明具有紫外吸收的芳香族氨基酸残基如酪氨酸残基等因热处理而暴露在蛋白质分子的表面,发色基团所处的环境由非极性向极性变化。与对照样品a相比,样品 b,c,d的峰位没有位移,峰型无明显区别,但在280 nm附近的吸收峰都逐渐增强。我们知道,一般疏水性残基大都埋藏于蛋白质分子内部[6],其紫外吸收增加表明经不同温度处理后的大豆蛋白构象的变化趋势基本相同,热处理促使蛋白多肽链局部展开。

图1 大豆分离蛋白的紫外可见光谱
2.3 大豆分离蛋白内源性荧光光谱
图2为大豆蛋白样品的内源性荧光光谱,激发波长为280 nm。对照样品以及分别经过40、50、60℃处理后样品的荧光峰位(λmax)分别位于333、338、334、336 nm,相对荧光强度分别为 718、873、913和847。可见样品的荧光峰位(λmax)和强度随热处理温度的不同而不同。
在280 nm激发的大豆蛋白样品荧光发射光谱主要是由色氨酸和酪氨酸残基所发射的[2,5],又名内源性荧光光谱。和其他含色氨酸和酪氨酸残基的球蛋白一样,由于其分子中从酪氨酸残基到色氨酸残基之间发生了能量转移,从而导致了酪氨酸残基的荧光熄灭和色氨酸残基的荧光增加。因此大豆球蛋白的荧光峰实际上是色氨酸残基的荧光峰,其峰位在325 ~350 nm 波长之间[7]。

图2 大豆分离蛋白的内源性荧光光谱(280 nm激发)
热处理后样品荧光强度和λmax的改变反映了色氨酸残基被氧化的程度和所处微环境的变化[7-8]。与对照样品相比,经过40、50、60℃处理后样品的λmax向长波方向发生了不同程度的位移(红移),表明色氨酸残基暴露于蛋白质分子表面,说明蛋白质的疏水区域发生了局部的改变,生色基团如色氨酸残基所处环境由非极性向极性转化,这可能是由于豆粕的高温处理导致蛋白质分子部分解折叠造成的;而荧光强度增加,说明虽然高温处理,但此时的色氨酸残基基本没有被氧化,或被氧化的程度较低,为蛋白质解折叠暴露的色氨酸残基所补充。值得注意的是,荧光峰位(λmax)和强度的这种变化并非线性走向。λmax改变最明显的是经过40℃处理的样品,而荧光强度改变最明显的却是经过50℃处理的样品。这似乎也说明样品经40、50℃处理时,色氨酸等疏水性氨基酸残基虽然暴露但极少被氧化,而当处理温度达60℃时,暴露的色氨酸等疏水性氨基酸残基开始发生了氧化,致使位于蛋白质分子表面的色氨酸残基减少,其荧光强度降低。Hidalgo等[8]在研究β-乳球蛋白与亚油酸13-氢过氧化物的相互作用时也发现,氧化β-乳球蛋白的λmax向短波方向移动且荧光强度降低的现象。这里脱脂豆粕经高温处理后,蛋白样品内源性荧光光谱的变化可能与色氨酸残基的暴露与氧化有关。蛋白质解折叠暴露在表面的色氨酸残基可加速其氧化的进程 。
2.4 大豆分离蛋白激发光谱和发射光谱分析比较
图3为经过热处理的4种大豆分离蛋白的激发光谱,4种样品的激发光谱均有两个峰,分别位于240 nm和280 nm附近,其中在240 nm附近的峰强度较小,峰位也基本没有偏移,但峰强度随处理温度升高增加较大;与240 nm附近的峰强度相比,各样品在280 nm处的峰强度最大,但峰强度随处理温度升高增加的幅度较小,峰位也有所偏移。

图3 大豆分离蛋白的激发光谱(440 nm发射)
激发光谱280 nm附近的峰主要归属于蛋白质中芳族基团的吸收,4种样品的激发光谱在280 nm附近峰强度随处理温度升高而增强,说明脱脂豆粕在高温处理过程中大豆蛋白的芳族氨基酸残基发生了氧化,其氧化产物可能和豆粕中的其他组分发生反应,生成某些新的荧光物质,且这些含有新荧光物质的相互作用产物,在其后的分离蛋白提取过程中,多不溶于水溶液而留存于分离蛋白中。正是这些新荧光化合物光谱叠加造成了激发光谱的变化。黄友如等[3,10]研究认为,形成新荧光物质原因有两个:一是自由基(脂肪氧合酶催化脱脂豆粕中的残留脂质如亚油酸过氧化产生的脂质过氧化自由基,·OH等)介导的C—C或C—N交联(如二酪氨酸交联);二是非自由基引发的反应机制,即脱脂豆粕贮藏期间残留脂质的自氧化和/或蛋白浸提过程中脂肪氧合酶催化脱脂豆粕中的残留脂质氧化降解产生的次生产物如醛类化合物与蛋白质赖氨酸等残基的侧链基团反应形成。前面脂肪氧合酶的活力分析也表明,不同温度处理的脱脂豆粕中脂肪氧合酶的活力在P≥0.05水平上并没有明显差异,说明在此处理温度范围内,脂肪氧合酶的热稳定性较好,在其后的分离蛋白制备过程中,脂肪氧合酶对大豆分离蛋白结构的影响一致。因此,本试验中产生的新荧光化合物可能源于脱脂豆粕贮藏期间热处理造成的残留脂质自氧化降解产生的次生产物与蛋白质赖氨酸等残基的侧链基团反应形成。

图4 大豆分离蛋白的发射光谱(355 nm激发)
图4为大豆分离蛋白的发射光谱(355 nm激发),可以看出,经过不同温度处理后的4种样品在440 nm附近均有最大的发射波长,从40℃到60℃的热处理,处理温度越高,样品在440 nm附近发射光谱的峰强度越强。
Liang[1]在研究高温(60℃)贮藏期间的大豆蛋白与大豆油相互作用时发现,发生氧化的大豆蛋白样品的荧光光谱也出现上述类似的变化,其荧光光谱最大激发波长在355 nm,最大发射波长在440 nm。与对照样品相比,经过40、50、60℃处理后的样品,伴随着色氨酸残基的氧化,内源性荧光强度先增加而后又降低(图2),而激发光谱280 nm附近峰强度和发射光谱440 nm附近峰强度增强,说明在脱脂豆粕的高温处理期间产生了一些新的荧光物质,且这些新产生的荧光物质部分具有水不溶性的特点,在随后的“碱提酸沉”工艺制备大豆分离蛋白过程中滞留于蛋白体系中。大豆蛋白激发光谱和发射光谱的这种变化应是这些新形成的荧光化合物光谱叠加造成的。
2.5 大豆分离蛋白凝胶电泳
为了确定脱脂豆粕经高温处理后,大豆蛋白质的各亚基是否发生了变化,我们进行了SDS-PAGE电泳分析,结果见图5。可以看出,对照样品呈现为典型的大豆蛋白电泳图谱[2]。相比之下,脱脂豆粕经40、50、60℃处理后的蛋白电泳图谱有了明显的变化。7S蛋白的α,α'和 β3个特征性亚基条带着色变深且有融合的现象。11S蛋白酸性亚基A的电泳行为也有类似的变化,但11S蛋白的碱性亚基B条带变宽了。此外,在高温处理后样品电泳图谱的高分子区域有明显可见的着色区域。这些事实表明,在脱脂豆粕的高温处理过程中,除了发生蛋白质的部分氨基酸残基的氧化外,脱脂豆粕中的残留脂质也可能发生了氧化,处理样品的扩散条带可能是属于一种共价类型的脂-蛋白[10]。至于有大豆蛋白亚基之间共价交联的产生,也是可能发生的。处理样品电泳图谱中7S区域的变化很有可能是由于在某些蛋白亚基之间形成了共价交联,如A-B,β-B或β-A等,结果造成该区域电泳条带的重叠,着色强度增加。且这种共价交联不属于—S—S—,应是—C—C—或—C—N—之类,因为电泳样品溶解液中含有β-巯基乙醇,该试剂可打开电泳样品中的—S—S—。值得注意的是上述反应是随机的,因而蛋白质各亚基之间以及蛋白质各亚基和脂质之间的交联也是随机的,结果造成电泳条带的扩散,相对分子质量分布范围变宽。的确,上述分析仅是理论推导,图5反映的样品亚基含量增加信息,其确切归属有待进一步证实,相关的研究正在进行中。
脱脂豆粕经高温处理后蛋白质的交联情况在原态电泳图谱中得到充分的体现。图6为没有添加巯基乙醇和SDS的样品原态电泳图谱。从6可以看出,各样品的原态电泳图谱主要呈现A,B,C,D和E 5条区带。相比之下,随着处理温度的升高,A,B,D3条区带着色渐趋明显,C带变化不大,而E带(低分子区域)渐宽但着色渐趋模糊。这些结果表明脱脂豆粕经高温处理后,蛋白质分子不仅有共价的交联,也有断裂现象的产生。交联会导致蛋白质颗粒粒度变大,溶液浊度增加,而断裂则会使其溶解度增加。

2.6 大豆分离蛋白的混浊度分析
图7为不同浓度下大豆分离蛋白的混浊度,可见每一样品的混浊度随蛋白质浓度的增加而升高,在同一蛋白质浓度下,热处理温度升高,大豆分离蛋白的混浊度增加。处理后样品溶液混浊度增加可能是蛋白质分子共价交联引起蛋白质颗粒粒径增加所致。
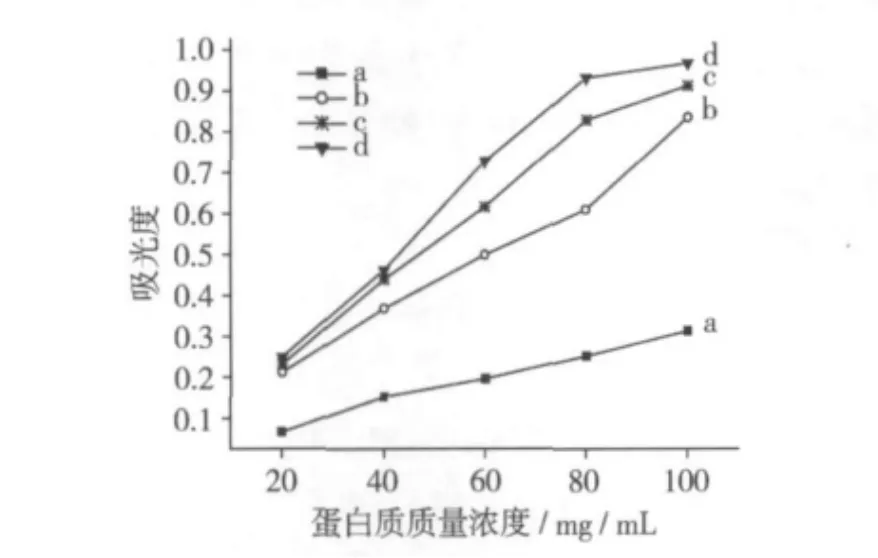
图7 大豆分离蛋白的混浊度
3 讨论与结论
脱脂豆粕贮藏期间因残留脂质氧化导致大豆蛋白结构、功能及营养价值的变化现象已引起人们的关注,但相关研究较少[1-3,5,11-13]。本试验以低温脱脂大豆粕为原料,采用不同温度(40~60℃)处理,以“碱提酸沉”工艺制备大豆分离蛋白,应用紫外光谱、荧光光谱、电泳及浊度测定等方法对经不同温度处理后制备的大豆分离蛋白的结构进行了分析与表征。初步的结果表明,脱脂豆粕的高温处理可促使蛋白多肽链局部展开,原来位于蛋白质内部的疏水性氨基酸残基如色氨酸、酪氨酸、苯丙氨酸等较多地裸露在蛋白质分子的表面,从而造成蛋白样品的紫外与荧光特征峰强度增强。伴随着蛋白质多肽链的局部展开,暴露的疏水性氨基酸残基部分发生了氧化,产生某些新荧光物质,且这些新产生的荧光物质部分具有水不溶性的特点,使得大豆蛋白的激发光谱280 nm附近和发射光谱440 nm附近的峰强度增强。其外,原料脱脂豆粕的干热处理亦可造成残留脂质的氧化,蛋白质各亚基和脂质之间可能发生交联,蛋白质各亚基之间不仅有共价的交联,也有断裂现象的产生,从而造成蛋白凝胶电泳图谱的高分子区域条带随热处理温度的升高而渐趋明显,电泳条带亦呈现扩散趋势,相对分子质量分布范围变宽。黄友如等[3,10]在脂肪氧合酶催化亚油酸氧化与大豆蛋白相互作用的研究中也发现类似的现象,并将其解释为自由基介导的C—C或C—N交联或非自由基引发的反应机制。但本试验的结果证明,不同温度处理的脱脂豆粕中脂肪氧合酶的活力在P≥0.05水平上并无明显差异,说明在此处理温度(40~60℃)范围内,脂肪氧合酶的热稳定性较好,在其后的分离蛋白制备过程中,脂肪氧合酶诱导的自由基反应机制对大豆分离蛋白结构的贡献相同。因此,本试验中大豆分离蛋白结构的变化当归因于脱脂豆粕贮藏期间不同温度处理造成的残留脂质自氧化。至于产生的新荧光化合物,因其成分复杂,纯化与定量研究有一定的难度,目前尚停留在定性阶段,其确切归属尚待进一步证实。
[1]Liang J H.Fluorescence due to interactions of oxidizing soybean oil and soy proteins.Food Chemistry[J],1999,66:103 -108
[2]黄友如,华欲飞,裘爱泳.脂质氧化诱导的大豆蛋白质聚集机理的研究[J].中国粮油学报,2006,21(1):80 -87
[3]黄友如,华欲飞,卢祥云,等.脂肪氧合酶催化亚油酸氧化与大豆蛋白相互作用的荧光光谱分析[J].食品科学,2008,29(5):134 -139
[4]郭尧军.蛋白质电泳实验技术[M].北京:科学出版社,1999:123-160
[5]Huang Y R,Hua Y F,Qiu A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International,2006,39(2):240 - 249
[6]Yamagishi T,Yamauchi F,Shibasaki K.State of aromatic acid residues in soybean 11S globulin heated in the presence of N - Ethylmaleimide by derivative spectrophotometry[J].Agricultural and Biological Chemistry,1981,45(2),459 -467
[7]Kalapathy U,Hettiarachchy N S,Rhee K C.Effect of drying methods on molecular properties and functionalities of disulfide bond - cleaved soy proteins[J].Journal of the American Oil Chemists'Society,1997,74(3):195 -199
[8]Hidalgo F J,Kinsella JE.Changes induced in β -lactoglobulin Bfollowing interactions with linoleic acid 13-hydroperoxide[J].Journal of Agricultural and Food Chemistry,1989,37:860-866
[9]Papiz M Z,Sawyer L,Eliopoulos E E,et al.The structure of β-lactoglobulin and its similarity to plasma retinal-binding protein[J].Nature,1986,324:383
[10]黄友如.脂肪氧合酶催化亚油酸诱导大豆蛋白聚集机理[D].无锡:江南大学,2006
[11]Huang Y R,Yu D,Hua Y F,et al.Detection of free radical transfer in lipoxygenase I-B-catalyzed linoleic acid-soybean proteins interaction by electron spin resonance spectroscopy(ESR)[J].Journal of Agricultural and Food Chemistry,2006,54(24):9216 -9220
[12]Wu W,Zhang C M,Kong X Z,et al.Oxidative modification of soy protein by peroxyl radicals[J].Food Chemistry,2009,116(1):295 -301
[13]Wu W,Wu X J,Hua Y F.Structural modification of soy protein by the lipid peroxidation product acrolein[J].LWT -Food Science and Tech-nology,2010,43(1):133 -140.
Influence of High Temperature on Structure of Soy Protein Isolates Prepared with Defatted Soy Flour
Huang Youru Chen Yiyong Zhu Dongxing Zhao Yang Wang Tanyu
(School of Biological Science and Food Engineering,Changshu Institute of Tech-nology,Changshu 215500)
Defatted soy flour was treated with different high temperatures and soy protein isolates were prepared with the treated flour.The protein structure of the samples were studied by UV - vis spectra,fluorescence spectroscopy,polyacrylamide gel electrophoresis and turbidity.The results showed that polypeptide chains of the protein were partially unfolded after the dry heating,tryptophan residues of the proteins were exposed and oxidized along with unfolded polypeptide chains,and some new fluorescent compounds were produced during the dry heating.Polyacrylamide gel electrophoresis revealed that the bands of the heated samples in high molecular area became more and more notable,each subunit band appeared diffused and its molecular weight distribution were broadened.Turbidity analysis showed that the turbidity of the samples increased along the heating temperature.
high temperature treatment,defatted soy flour,soy protein isolates,structure
TS201.2+1
A
1003-0174(2011)10-0051-06
江苏省高校自然科学研究项目(10KJB550001),苏州市科技计划项目(SYND201003)
2010-12-07
黄友如,男,1966年出生,博士,副教授,食品科学与工程
