负载型KMnO4的制备及其在低蒎酮酸合成中的应用*
2011-11-26孙小玲
孙小玲, 王 蕊,2
(1. 上海应用技术学院 化学与环境工程学院,上海 200235; 2. 上海海洋大学 食品学院,上海 201306)
有机合成中利用高锰酸钾(KMnO4)作为氧化剂具有成本低廉,反应时间短等特点,是一种较为成熟的合成方法[1]。但KMnO4作氧化剂最大的问题是产生大量的细小颗粒或凝胶状的二氧化锰(MnO2)固体,使分离变得相当困难。解决的方法之一是将KMnO4固载化[2]。常见的载体为比表面积大、多孔的固载支撑体,如硅胶、氧化铝、树脂聚合物等[3~8]。改用负载型KMnO4作为氧化剂,反应后的MnO2可进行回收利用,使工业生产更加环保,成为一类环境友好型的氧化剂,更加接近绿色化学的目标[9]。此外,还可以提高反应选择性、缓和氧化剂的氧化性,实现温和条件下的反应。
低蒎酮酸(2,化学名:3-乙酰基-2,2-二甲基环丁烷甲酸)是一种重要的有机合成中间体,主要用于合成氨基酸[10,11],四元环昆虫信息素[12,13]等。2一般由马鞭草烯酮(化学名:4,6,6-三甲基双环[3.1.1]-3-庚烯-2-酮)氧化开环制备,常用的氧化剂为三氯化钌/高碘酸钠[12,14]和臭氧[15],虽然产率很高,但反应时间较长,并且三氯化钌价格也比较昂贵;尤其是臭氧氧化的反应条件比较苛刻,反应温度为-40 ℃。
本文分别以硅酸铝、分子筛、石墨、硅藻土、硅胶、中性氧化铝、二氧化锰为载体,制备了七种负载型KMnO4(1a~1g),其结构经XRD表征。以1为氧化剂,马鞭草烯酮的碳碳双键完成氧化断裂反应,合成了一种重要的杀虫剂中间体2,其结构经1H NMR和IR确证。合成2的较适宜反应条件为:马鞭草烯酮13.3 mmol,1e10.32 g(40 mmol,以KMnO4计算),91%AcOH 50 mL,于室温反应2 h,转化率100%,选择性81.03%。
1 实验部分
1.1 仪器与试剂
Varian Mercury-300 300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Magana-IR500型傅立叶红外光谱仪(KBr压片);PA Nalytical X’pert Pro MRD型转靶X-射线多晶衍射仪(Cu Kα射线,λ=0.154 18, 40 kV, 30 mA, 5°~80°, 4°·min-1); GC 9790-Ⅱ型气相色谱仪(OV-17色谱柱,升温速度12 ℃·min-1: 80 ℃~120 ℃,保留1 min; 120 ℃~150 ℃,保留1 min; 150 ℃~200 ℃,保留5 min。气化室温度 200 ℃,离子室温度250 ℃); Agilent 5975C气相-质联用仪(GC-MS)。
马鞭草烯酮,98%, Aldrich;其余所用试剂均为分析纯。
1.2 1的制备(以1e为例)
在反应瓶中加入粉末KMnO415.8 g(100 mmol)的水(250 mL)溶液,搅拌下慢慢加入硅胶20 g,加毕,搅拌下浸渍2 h。减压旋蒸至干,真空干燥得紫色粉末KMnO4/硅胶(1e)。
用类似方法制得紫色粉末1a~1d和1f。
在研钵中加入粉末KMnO415.8 g(100 mmol)和MnO215.8 g,充分研磨,混合均匀制得深紫色或黑色粉末KMnO4/MnO2(1g)。
1中KMnO4与载体的用量见表1。

表 1 1中KMnO4与载体的用量*
*采用浸渍法制备1时,以KMnO4在水(250 mL)中的溶解量确定KMnO4和载体的用量,载体的助溶能力不同,所以用量差异较大
1.3 1氧化马鞭草烯酮合成2
在三口烧瓶中加入马鞭草烯酮2.0 g(13.3 mmol)的乙酸[50 mL,φ(AcOH)=10 ∶1]溶液,搅拌下分批加入1e10.32 g(40 mmol,以KMnO4计算)(30 min内),反应1.5 h。加入碳酸钠溶液10 g,搅拌至不再有气泡产生,抽滤,滤液用乙酸乙酯(3×15 mL)萃取,水层用盐酸调至pH 1~2,用二氯甲烷(3×15 mL)萃取,合并有机层,用无水硫酸镁干燥,旋蒸至恒重得黄色固体2,纯度大于90%(GC);1H NMRδ: 0.95(s, 3H), 1.43(s, 3H), 1.89(dt, 1H), 2.05(s, 3H), 2.61(m, 1H), 2.75(dd, 1H), 2.81(dd, 1H), 7.2(bs, 1H); IR : 3 218, 2 962, 1 715, 1 690 cm-1; MSm/z: 171(M+1), 152{[M-18]+},128{[M-43]+}, 109{[M-18-15-28]+}, 83{[[M-98]+}, 43。表征数据与文献[13]值吻合。
2 结果与讨论
2.1 1的表征
图1,图2和图3分别为1c,1e和1f的XRD谱图。由图1可见,由于石墨的峰强度较大,因此1c只能看到强度很大,峰很尖的石墨峰。1d与1c类似。
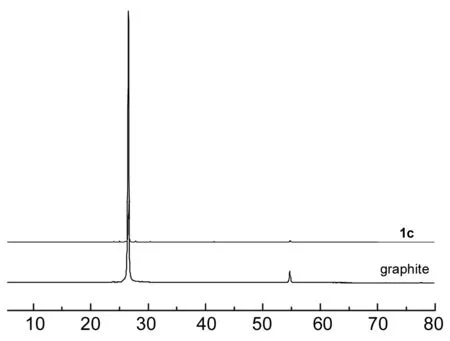
2θ/(°)

2θ/(°)
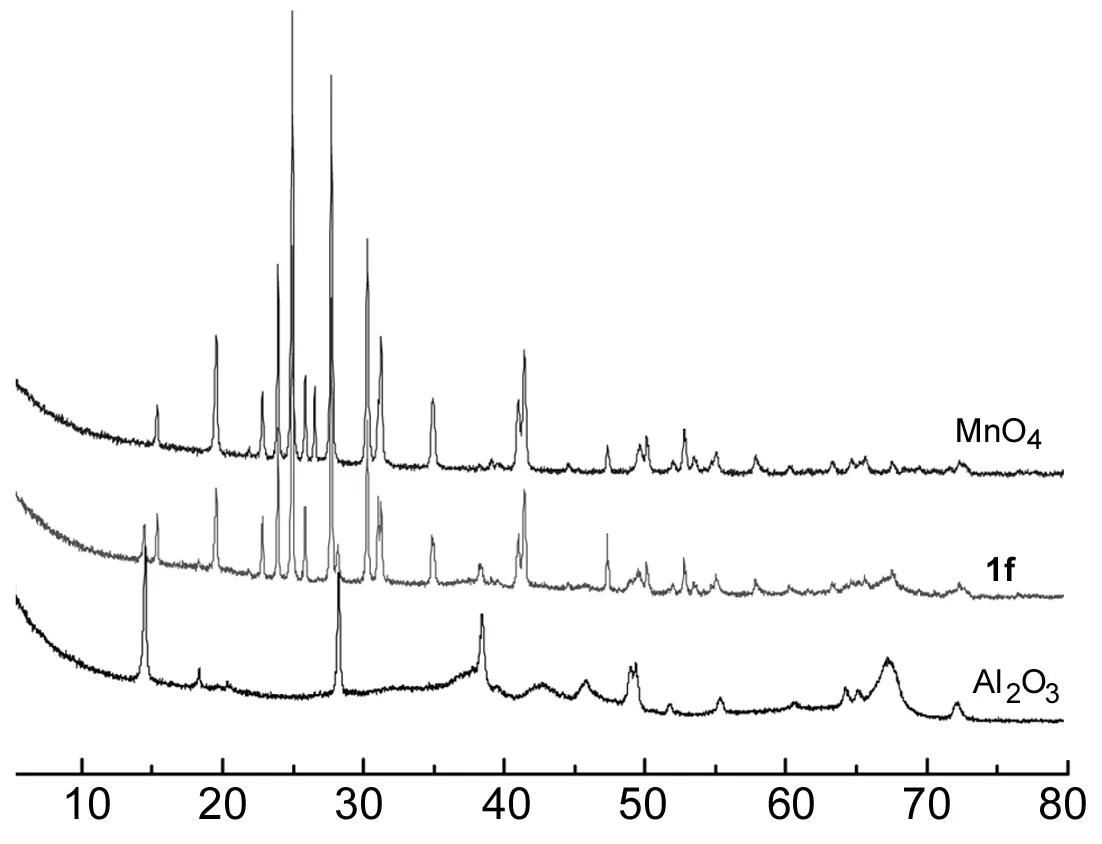
2θ/(°)
1e的载体硅胶为非晶态结构,因此在图2中只能观察到1e与KMnO4相同的衍射峰,硅胶的存在抑制了其峰强度。1a与1e类似。
从图3可以看出,1f兼具KMnO4和Al2O3衍射特征和晶形结构,峰位置没有改变,但峰强度有所不同。可能是KMnO4与Al2O3相互作用,抑制了彼此的晶形结构,导致峰强度减弱。1b和1g与1f类似。
2.2 合成2的反应条件选择
反应条件同1.3,考察了以1作氧化剂,反应条件对合成2的影响。
(1) 氧化剂
实验发现,以1c~1e为氧化剂时,后处理分离极为容易。氧化剂对合成2的影响见表2。由表2可见,1b的氧化效果较差,这是由于分子筛颗粒较大,KMnO4负载不均匀所致;以1g为氧化剂的优势在于可重复使用MnO2,节约成本,但产率不高;以1e为氧化剂,转化率100%,且选择性最高。因此应选1e为氧化剂。
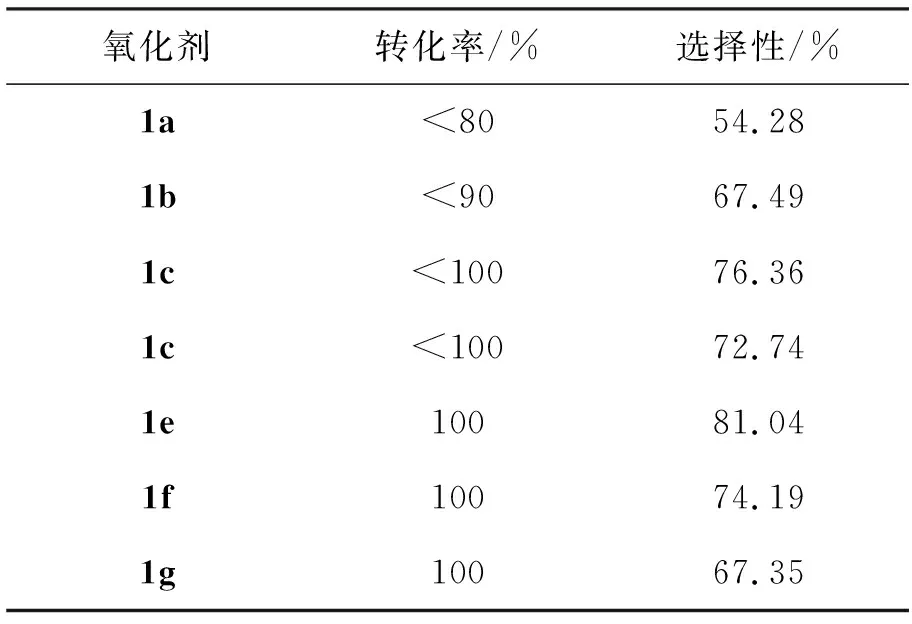
表 2 氧化剂对合成2的影响*
*反应时间2 h,氧化剂40 mmol(以KMnO4计算),其余反应条件同1.3

表 3 反应时间对合成2的影响*
*1e为氧化剂,其余反应条件同1.3; 反应时间从开始加1e时起算
(2) 反应时间
以1e为氧化剂,其余反应条件同1.3,考察反应时间对合成2的影响,结果见表3。从表3可以看出,当反应进行1.5 h时,转化率已经在95%以上;反应进行2 h时,选择性最高;再延长反应时间,选择性并未相应提高。实验发现,反应1.5 h时,滤液呈紫色;反应2 h或以上,滤液为淡黄色清液。综合考虑选择反应时间为2 h。
(3)φ(AcOH)[V(AcOH) ∶V(H2O)]
以1e为氧化剂,反应时间2 h,其余反应条件同1.3,考察φ(AcOH)对合成2的影响,结果见表4。从表4可以看出,当φ(AcOH)为10 ∶1时,选择性达到81.04%;再增加φ(AcOH),水量过少无法促进反应正向进行,导致选择性下降。因此应该选择φ(AcOH)为10 ∶1。
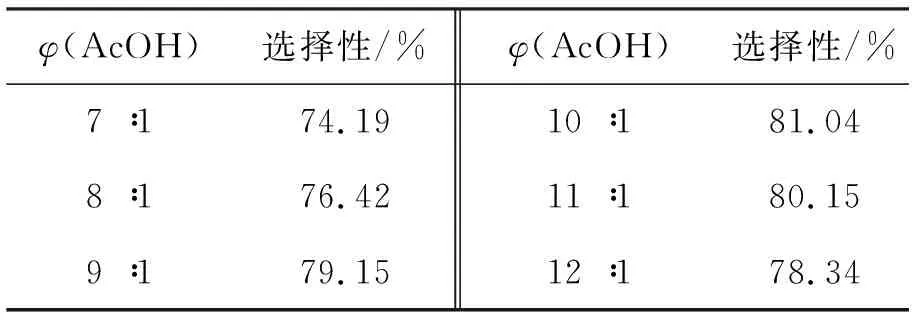
表 4 φ(AcOH)对合成2的影响*
*φ(AcOH)=V(AcOH) ∶V(H2O); 以1e为氧化剂,反应时间2 h,其余反应条件同1.3
综上所述,合成2的较适宜反应条件为:马鞭草烯酮 13.3 mmol,1e10.32 g(40 mmol,以KMnO4计算), AcOH 50 mL[φ(AcOH)=10 ∶1],于室温反应2 h,转化率100%,选择性81.04%。
致谢:本研究在样品测试方面得到上海应用技术学院化学与环境工程学院郭强胜老师的热情帮助,特此感谢!
[1] S Ahmad, M Peiman, N Soheila,etal. The use of potassium permanganate supported on manganese dioxide[J].Tetrahedron,2004,60:11415-11420.
[2] 刘宝生,王洪艳,纪红兵. 分子氧存在下镁铝水滑石负载高锰酸钾活化醇类液相氧化反应研究[J].高校化学工程学报,2008,22(4):604-610.
[3] L Ji-Dong, W Guo-Qiang, L Li,etal. Oxidation of alcohols catalyzed by a new potassium permanganate adsorbed on graphite reagent[J].Synthesis and Reactivity in Inorganic,Metal-Organic,and Nano-Metal Chemistry,2005,35(4):1553-3174.
[4] M B Iraj, A Z Mohammad, A A Mohammad. Novel and chemoselective dehydrogenation of 2-substituted imidazolines with potassium permanganate supported on silica-gel[J].Tetrahedron Letters,2004,45:8687-8690.
[5] L Ji-Dong, W Miao, Z Li-Yun,etal. Efficient oxidation of alcohols with potassium permanganate adsorbed on aluminum silicate reagent[J].Monatshefte für Chemie,2004,135:31-34.
[6] L Ji-Dong, W Miao, Z Li-Yun,etal. Solvent free oxidation of alcohols catalyzed by KMnO4adsorbed on kieselguhr[J].Catalysis Communications,2003,4:647-649.
[7] J Tercio, B Ferreira, W O Cruz,etal. Carbon-carbon double bond cleavage using solid-supported potassium permanaganate on silica-gel[J].J Organic Chemistry,1987,52(16):3698-3699.
[8] C William, M J Blankinship, T Brady,etal. Selective deoximation using alumina supported potassium permanganate[J].Tetrahedron Letters,2001,42:4775-4777.
[9] D Sukalyan, S Sabita, K M Bijay. Oxidation by permanganate:Synthetic and mechanistic aspects[J].Tetrahedron,2009,65:707-739.
[10] G P Aguado, A G Moglioni. Enantiodivergent synthesis of cyclobutyl-(Z)-α,β-dehydro-α-amino acid cerivatives from (-)-cis-pinononic acid[J].Tetrahedron:Asymmetry,2003,14(2):217-223.
[11] D R Pablo, G M Albertina, Y M Graciela,etal. Stereoselective synthesis of chiral precursors to cyclobutane carbocyclic nucleosides and oligopeptides[J].Tetrahedron:Asymmetry,2003,14:193-195.
[12] Z Aijun. Chiral synthesis of maconelliol:A novel cyclobutanoid terpene alcohol from pink hibiscus mealybug,maconellicoccus hirsutus[J].Tetrahedron Letters,2004,45:9401-9403.
[13] C P Linda, X Francis. Synthesis of the female sex pheromone of the citrus mealybug,planococcus citri[J].Journal of Agricultural and Food Chemistry,2004,52:2896-2899.
[14] J Aguilera, A G Moglioni. Stereodivergent synthesis of the first bis(cyclobutane)γ-dipeptides and mixedγ-oligomers[J].Tetrahedron:Asymmetry,2008,19(3):302-308.
[15] O S Kukovinets, T I Zvereva, V G Kasradze. Novel synthesis of planococcus citri pheromone[J].Chemistry of Natural Compounds,2006,42(2):216-218.
