过氧化尿素法快速合成具有光引发活性的ATRP引发剂*
2011-11-26程传杰黄海青付长清乔永洛
郑 义, 程传杰, 黄海青, 申 亮,, 付长清, 乔永洛
(1. 江西科技师范学院 a. 化学化工学院; b. 江西省有机功能分子重点实验室,江西 南昌 330013)
原子转移自由基聚合(ATRP)可用于制备多种拓扑结构的共聚物和均聚物[1~3]。ATRP引发剂主要有α-卤代丙酸酯类、苄卤类和磺酰卤类。光固化过程中必须使用光引发剂,而二苯甲酮类光引发剂因价廉易得而被广泛使用[4,5]。为了克服传统小分子光引发剂的缺点,近年来人们开始研究反应性或大分子光引发剂[6]。本课题组[7]曾利用氢溴酸(HBr)/H2O2体系,分别选择性合成了4-溴甲基二苯甲酮(2)与4-二溴甲基二苯甲酮(3),该方法的不足之处在于反应速度相对较慢,需要10 h才能完成反应。
本文以过氧化尿素(UHP)和HBr为溴化试剂,分别对4-甲基二苯甲酮(1)和 4,4′-二甲基二苯甲酮(4)进行选择性溴化,方便快速地合成了两种反应性二苯甲酮类光引发剂——2和4,4′-二(溴甲基)二苯甲酮(5, Scheme 1),产率分别为91%和46%,其结构经NMR, IR和元素分析确认。3和5既可作为ATRP引发剂,也可作为光固化过程的光引发剂;其苄溴基团还可以与很多亲核试剂反应生成相应的二苯甲酮衍生物。

Scheme1
与文献[7]方法比较,该法极大地缩短了反应时间。
1 实验部分
1.1 仪器与试剂
Bruker AV 400 MHz型核磁共振仪(CDCl3作溶剂,TMS为内标);Bruker V70型傅立叶变换红外光谱仪(KBr压片);FLASH EA1112型元素分析仪。
HBr, ≥40%;其余所用试剂均为分析纯。
1.2 2和5的合成(以2为例)
在反应瓶中加入1 1.25 g(6.4 mmol)和UHP 1.2 g(12.8 mmol)的二氯甲烷(30 mL)溶液,搅拌下加热至回流,用200 W白炽灯照射,滴加HBr 1.4 mL(6.9 mmol)(约20 min),回流反应40 min。冷却,加水,静置分层,有机层用无水硫酸钠干燥,蒸干溶剂后用无水乙醇重结晶得2。
以4[r=n(4) ∶n(HBr) ∶n(UHP)=1.0 ∶2.2 ∶2.0]代替1,用类似方法合成5(总反应时间50 min)。
2: 白色晶体,产率91%, m.p.109 ℃~110 ℃(112.2 ℃~112.8 ℃[8]);1H NMRδ: 7.80~7.77(m, 4H), 7.60~7.58(m, 1H), 7.51~7.47(m, 4H), 4.53(s, 2H);13C NMRδ: 196.0, 142.1, 137.5, 137.4, 132.6, 130.6, 130.0, 129.0, 128.4, 32.3; IRν: 3 040, 1 668, 1 610, 1 463, 1 419, 852, 599 cm-1; Anal.calcd for C14H11OBr: C 61.11, H 4.03; found C 61.15, H 3.99。
5: 白色晶体,产率46%, m.p.120 ℃~122 ℃;1H NMRδ: 7.78(d,J=7.20 Hz, 4H), 7.51(d,J=7.24 Hz, 4H), 4.54(s, 4H);13C NMRδ: 195.5, 142.7, 137.6, 130.9, 129.4, 32.6; IRν: 3 051, 1 670, 1 602, 1 587, 1 410, 850, 609 cm-1; Anal.calcd for C15H12OBr2: C 48.95, H 3.29; found C 48.91, H 3.32。
2 结果与讨论
2.1 2的合成
HBr/UHP为氧化还原体系,HBr可被UHP氧化成零价溴(包括 Br·和Br2),其中Br·可直接与苄基反应生成苄溴类化合物,光照可使Br2不断分解成为 Br·,从而使反应进行完全。
在HBr/H2O2体系[7]合成2的基础上,进行HBr/UHP的溴化实验,以优化反应条件,结果见表1。由表1可见,当r=1.0 ∶1.1 ∶2.0时,反应10 h, 原料完全转化,但会生成二溴取代产物3(产率约10%),这说明部分2发生了进一步溴化。减少反应时间至5 h, 结果有所改善,但仍有8%的3。当反应时间为1 h时,2纯度达95%,总收率98%。继续缩短反应时间至30 min,则有7%的1未反应。当r=1.00 ∶1.05 ∶2.00,即减少HBr用量,反应 1.5 h,2纯度仅88%。
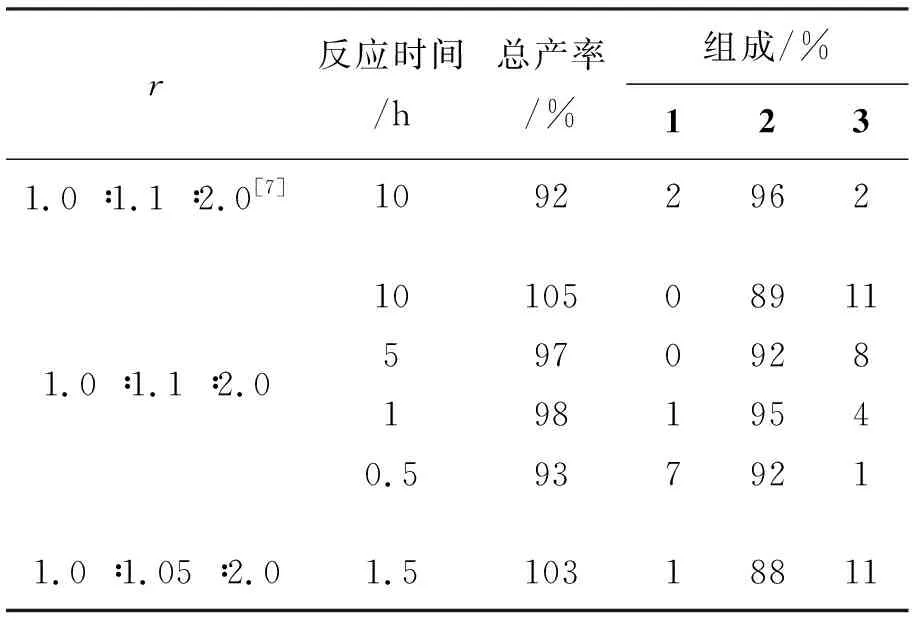
表 1 反应条件对合成2的影响*
*r=n(1) ∶n(HBr) ∶n(UHP); 在CH2Cl2中回流反应;总产率=粗产物质量/2理论产量×100%; 组成由1H NMR测定; 文献[7]方法:r′=n(1) ∶n(HBr) ∶n(H2O2)
由此可见,较佳的反应条件为r=1.0 ∶1.1 ∶2.0,回流反应1 h。
与HBr/H2O2体系[7]相比,HBr/UHP溴化体系的反应速度提高了10倍。在HBr/H2O2反应体系中,HBr与H2O2主要都分布在水相,而1则主要在有机相,因而反应速度较慢;而在HBr/UHP溴化体系中,UHP可溶于有机相,更接近均相反应,故反应速度大大提高。
2.2 5的合成
基于HBr/UHP溴化体系合成2的成功经验,尝试了5的合成。由于底物4具有两个苄基位置,因此要选择性地合成5会面临较高的难度。但实验结果表明,利用HBr/UHP溴化体系,只需将r调整为1.0 ∶2.2 ∶2.0,其余反应条件与合成2类似,就可以成功地合成5,产率46%。
[1] Tsarevsky N V, Matyjaszewski K. “Green” atom transfer radical polymerization:From process design to preparation of well-defined environmentally friendly polymeric materials[J].Chem Rev,2007,107(6):2270-2299.
[2] Cheng C J, Shu J B, Gong S S,etal. Synthesis and use of a surface-active initiator in emulsion polymerization under AGET and ARGET ATRP conditions[J].New J Chem,2010,34(1):163-170.
[3] 邹友思,邱志平,庄荣传,等. 甲基丙烯酸丁酯和苯乙烯的原子转移自由基共聚[J].合成化学,1998,6(1):1-3.
[4] 凌华招,谢川. 阳离子型UV光引发剂——三芳基硫鎓盐的合成[J].合成化学,2006,14(2):170-171.
[5] 熊伟,刘金水,文应军. 二苯甲酮/胺: 紫外光固化涂料中的新型引发剂[J].合成化学,1999,7(2):202-206.
[6] Xiao P, Zhang H Q, Dai M Z,etal. Synthesis and characterization of 4,4′-diacryloyloxybenzophenone[J].Prog Org Coat,2009,64(4):510-514.
[7] 邱艳秀,程传杰,黄海青,等. 具有光引发活性 ATRP 引发剂的选择性合成[J].合成化学,2011,19(1):59-61.
[8] 李双华,臧阳陵,刘光鹏,等. 水性光引发剂(4-苯酰基)苯甲基铵-N-十二烷基-N,N-二甲溴化物的合成[J].精细化工中间体,2008,38(2):58-61.
