L-缬氨酸衍生的磺酰胺类配体的合成及其在二乙基锌对苯甲醛的不对称加成中的应用*
2011-11-26黄华银边广岭孙小强
黄华银, 姜 艳, 边广岭, 宗 华, 宋 玲 , 孙小强
(1. 常州大学 化学化工学院,江苏 常州 213164; 2. 中国科学院 福建物质结构研究所,福建 福州 350002)
具有光学活性的手性醇是合成许多天然产物和手性药物的重要中间体[1,2]。手性催化乙基锌试剂对醛的不对称加成反应是合成手性醇的重要方法之一,该方法的关键是设计和合成具有高效催化活性的手性配体和手性催化剂[3]。近几十年来,人们设计并合成了各种各样的手性配体(如手性二醇类[4,5]、磺酰胺类[6,7]、氨基醇类[8,9]、噁唑啉类[10]等)来催化该类反应,均取得了较好的效果,但是大多数都要使用价格昂贵的手性化合物作为手性源。如何利用廉价易得的手性源来设计合成高效的手性催化剂仍然是研究的重要课题。
氨基酸是天然的手性源,廉价易得,可以衍生出许多种手性配体,近年来逐渐被重视。L-缬氨酸是众多手性氨基酸中比较典型的一种,它来源广泛,价格便宜,而且具有非常好的立体空间结构,近年来引起了广泛的关注和研究。2003年,Christopher T Seto小组[11]研究了L-缬氨酸衍生的酰胺类手性配体用于催化乙基锌对醛的不对称加成,获得了比较好的收率(91%)和中等ee值(41%); 2007年,Kazuaki Ishihara小组[12]研究了缬氨酸衍生的膦酰胺类配体催化醛酮的不对称加成反应,取得了很好的催化效果(收率97%, 95%ee)。但是,至今尚未有人研究缬氨酸衍生的磺酰胺类配体催化醛酮的不对称加成反应。
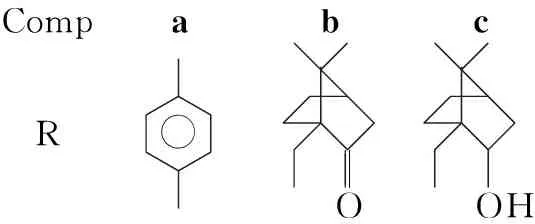
本文以L-缬氨酸为原料,合成了三个新的L-缬氨酸衍生的磺酰胺类手性配体(1a~1c, Scheme 1),其结构经NMR和MS表征。以二乙基锌对苯甲醛的不对称加成(Scheme 2)为探针反应,考察了1的催化性能。研究结果表明,1均具有较好的催化活性和手性诱导能力,尤其是1b催化加成反应的最高收率99%, (S)-1-苯基丙醇的最佳ee值72%。
Scheme1
Scheme2
1 实验部分
1.1 仪器与试剂
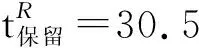
(S)-3-甲基-1-(1-吡咯基)丁基-2-胺(2)按文献[12]方法合成;1.5 mol·L-1二乙基锌的甲苯溶液、樟脑磺酰氯、对甲基苯磺酰氯和硼氢化钠,百灵威化学试剂有限公司;层析用硅胶和薄层层析板,青岛海洋化工厂;其余试剂均为市售分析纯,使用前经常规干燥处理。
1.2 合成
(1)1a和1b的合成

(2)1c的合成

1.3 1催化乙基锌对苯甲醛的不对称加成反应
氮气保护,在干燥的Schlenck试管中加入1a93.3 mg(0.30 mmol),于0 ℃加入二乙基锌2 mmol,搅拌30 min;缓慢滴加苯甲醛(1 mmol)的甲苯溶液1 mL,滴毕,反应24 h。加入饱和氯化铵10 mL,用乙酸乙酯(3×10 mL)萃取,合并萃取液,用饱和食盐水洗涤,无水硫酸钠干燥,减压蒸除溶剂, 快速柱层析(洗脱剂:A=1 ∶10)分离得1-苯基丙醇112 mg,产率81.7%, (S)-1-苯基丙醇65.1%ee(HPLC)。
2 结果与讨论
2.1 1的合成
合成1a和1b时,为了防止反应温度升高,有效地抑制副反应,需要在冰浴冷却下缓慢滴加3。由于该反应需要在无水条件下进行,因此使用的溶剂以及其他试剂需经严格的干燥处理。
合成1c时,若采用AlLiH4还原,由于其反应活性太高,会产生大量的副产物;而使用NaBH4还原,无副反应,原料几乎完全转化生成目标产物,产率高。
2.2 1的催化性能
以二乙基锌对苯甲醛的不对称加成为探针反应,考察了1a~1c的催化性能,结果见表1。从表1可以看出,1都表现出了比较好的催化效果:1-苯基丙醇产率81.7%~99.0%, (S)-1-苯基丙醇的对映选择性63.7%ee~65.9%ee。尤其是1b,1-苯基丙醇的产率高达99%, (S)-1-苯基丙醇的对映选择性65.9%ee;1a与1c的催化效果差别不大。我们推断,(S)-1-苯基丙醇的对映选择性主要受氨基酸手性中心的控制,而与磺酰胺基团所连的R基无太大关系。
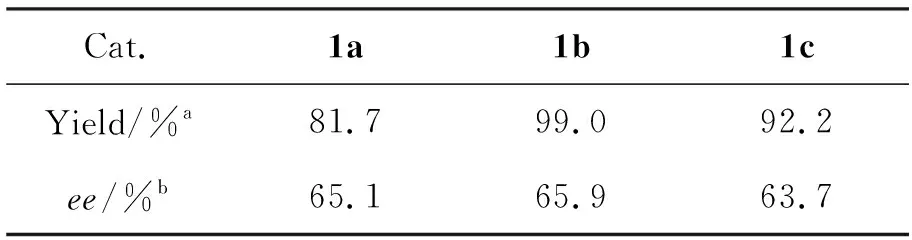
表 1 1催化二乙基锌对苯甲醛不对称加成反应*
*反应条件同1.3;a分离产率;b与文献[12]值比较,由HPLC测定(S)-1-苯基丙醇的对映选择性
2.3 1c催化二乙基锌对苯甲醛的不对称加成的反应条件
以1c为催化剂,考察了反应温度、反应时间、催化剂用量等对二乙基锌对苯甲醛的不对称加成反应的影响,结果见表2。从表2可以看出,当其他条件相同,反应温度从0 ℃降低到-10 ℃,产率有所下降(从99%降至68%),ee值略有上升(最高为72%);反应温度从0 ℃升至室温时,产率也有所下降(从99%降至74.6%),但ee值相对稳定(57.4%~72.0%);催化剂用量为5 mol%~15 mol%时,随着催化剂用量的增加,产率和ee值稍微有所上升,但是并不是非常明显;该反应随着反应时间的增加,产率略有所上升,变化很小。
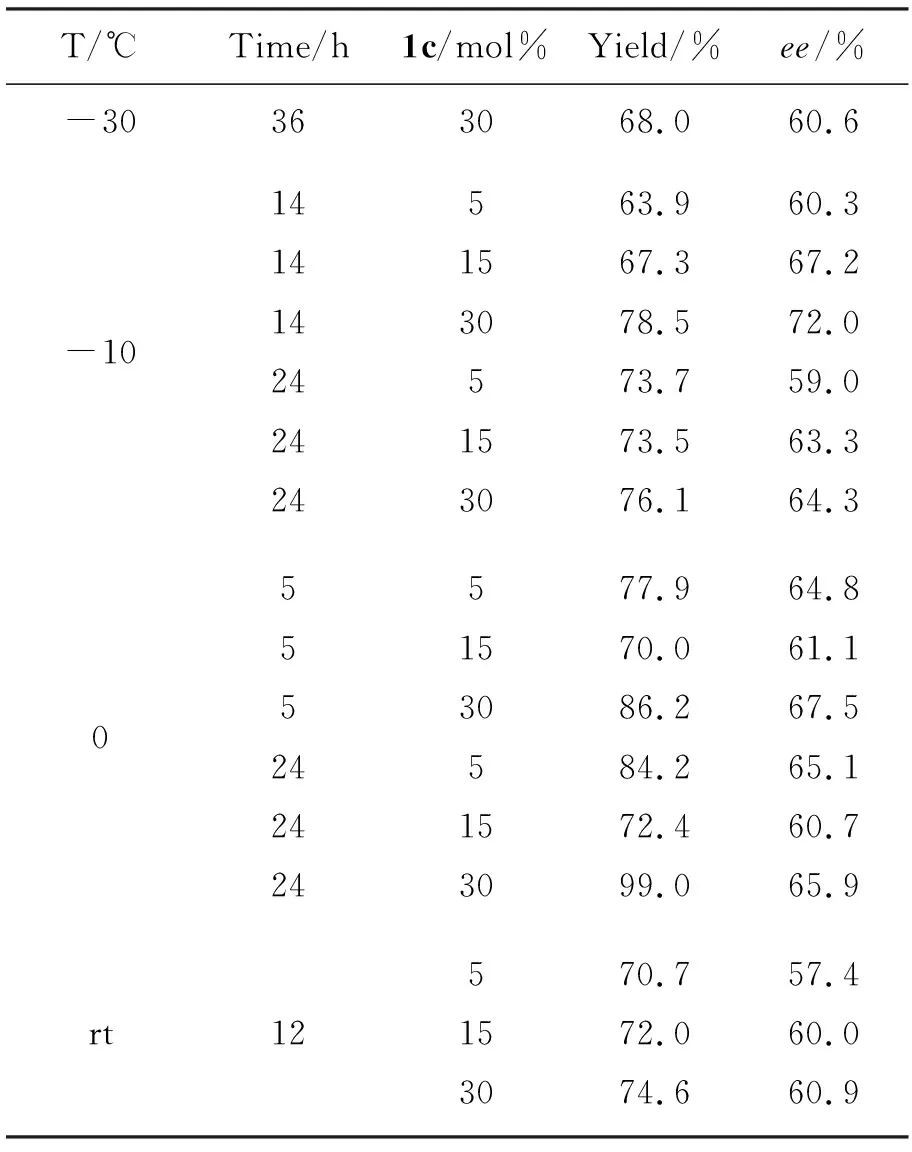
表 2 1c催化二乙基锌对苯甲醛不对称加成反应*
*同表1
[1] Fuji K. Asymmetric creation of quaternary carbon centers[J].Chem Rev,1993,93:2037-2060.
[2] Corey E J, Guzman P A. The catalytic enantioselective constructruction of molecules with quaternary carbon stereocenters[J].Angew Chem Int Ed,1998,37:388-401.
[3] Pu L, Yu H B. Catalytic asymmetric organozinc additions of carbonyl compounds[J].Chem Rev,2001,101:757-824.
[4] Schmidt B, Seebach D. Catalytic and stoichiometric enantioselective addition of diethylzinc to aldehydes using a novel chiral spirotitanate[J].Angew Chem Int Ed,1991,30:99-101.
[5] Gou S H Zaher, M A Judeh. Enantioselective additon of diethylzinc to aromatic aldehydes catalyzed by Ti(Ⅳ) complexes ofC2-symmetrical chiral BINOL derivatives[J].Tetrahedron Lett,2009,50:281-283.
[6] Eisenberg C, Knochel P. Catalytic asymmetric preparation of polyfunctional protected 1,2-diols and epoxides[J].J Org Chem,1994,59:3760-3761.
[7] Viso A, Urena M. Synthesis of chiral sulfinamido-sulfonamides and their evaluation as ligands for the enantioselective ethylation of aldehydes[J].Tetrahedron,2009,65:3757-3766.
[8] Soai K, Yokoyama S, Hayasaka T. ChiralN,N-dialkylnorephedrines as catalysts of the highly enantioselective addition of dialkylzincs to aliphatic and aromatic aldehydes.The asymmetric synthesis of secondary aliphatic and aromatic alcohols of high optical purity[J].J Org Chem,1991,56:4264-4268.
[9] Salehi P, Dairi M, Baghbanzadeh M. An efficient method for catalytic enantioselective addtion of diethylzinc to aryl aldehydes by aC2-symmetric chiral imino alcohol[J].Tetrahedron:Asymmetry,2009,20:2609-2611.
[10] Mcmanus H A, Guiry P J. Recent developments in the application of oxazoline-containing ligands in asymmetric catalysis[J].Chem Rev,2004,104:4151-4202.
[11] Richmond M L, Seto C T. Modular ligands derived from amino acids for the enantioselective addtion of organozinc reagents to aldehydes[J].J Org Chem,2003,68:7505-7508.
[12] Hatano M, Miyamoto T, Ishihara K. Highly active chiral phosphoramide-Zn(Ⅱ) complexes as conjugate acid-base catalysts for enatioselective organozinc additon to ketones[J].Org Lett, 2007,9:4535-4538.
[13] Garcia C, Larochelle L K, Walsh P J. A practical catalytic asymmetric additon of alkyl groups to ketones[J].J Am Chem Soc,2002,124:10970-10971.
[14] Ramon D J, Yus M. First enantioselective addition of diethylzinc and dimethylzinc to prostereogenic ketones catalysed by camphorsulfonamide-titanium alkoxide derivatives[J].Tetrahedron,1998,54:5651-5666.
