实时荧光聚合酶链反应检测宫颈人乳头瘤病毒在宫颈癌筛查中的应用
2011-11-23程娇影卞美璐
程娇影,卞美璐,马 莉,陈 颖,刘 军
卫生部中日友好医院妇产科,北京 100029
·短篇论著·
实时荧光聚合酶链反应检测宫颈人乳头瘤病毒在宫颈癌筛查中的应用
程娇影,卞美璐,马 莉,陈 颖,刘 军
卫生部中日友好医院妇产科,北京 100029
人乳头瘤病毒;宫颈肿瘤;聚合酶链反应
人乳头瘤病毒(human papillomavirus,HPV)感染已被证明是宫颈癌的直接病因[1],Woodman等[2]研究发现其归因危险性达到90%以上。有研究证明,高危型HPV检测筛查宫颈病变的敏感性为90%~95%[3-9],因此,宫颈HPV检测已成为宫颈癌筛查及治疗后随访的重要内容。本研究评估了实时荧光聚合酶链反应(polymerase chain reaction,PCR)方法用于筛查宫颈病变的临床应用价值,以期为今后的临床应用提供参考。
对象和方法
对象2008年7月至2010年2月在中日友好医院妇科门诊行宫颈液基细胞学检查(liquid-based cytological test,LCT)的妇女10 452名,排除急性生殖道炎症和曾接受过宫颈锥切及子宫切除手术者后,将自愿要求同时接受LCT检查和实时荧光PCR检测HPV筛查宫颈癌者(2286例)按照出生日期进行排序,以5岁为1个年龄段进行分层,计算各层人数分布比例,并按照相同比例在各层内以随机数字表方法随机选取1500例入组,其中248例拒绝入组研究,实际纳入研究对象为1252名,平均年龄为(38.15±11.0)岁。
LCT诊断标准采用2001年TBS分类。
实时荧光PCR检测检测HPV16、18、31、33、35、39、45、51、52、56、58、59、68。灵敏度为5000copies/ml。结果分析:基线和阈值设定原则是刚好超过阴性对照品扩增曲线的最高点,且循环阈值(cycle threshold,CT)不出现任何数值。阴性对照CT值应显示为空白,同时阳性对照CT值应≤36。样品CT值显示空白判断为阴性,CT值≤40判断为阳性。
组织病理学检查对LCT提示≥不能明确意义的不典型鳞状上皮细胞(atypical squamous cells - undetermined significance,ASC-US)和/或实时荧光PCR结果高危型HPV阳性者在阴道镜下进行活检。
统计学处理采用SPSS 16.0统计软件,以组织病理学检查结果作为金标准,组间比较采用χ2检验,P<0.05为差异有统计学意义。
结 果
实时荧光PCR结果、宫颈高度病变与年龄的关系1252名妇女的实时荧光PCR检测发现,高危型HPV感染率在65岁之前的各年龄段无明显变化,65岁后明显升高。在45~54岁高危型HPV阳性者中宫颈高度病变患者的比例明显升高。以45和55岁为分界点统计,结果显示,<45岁组(213/768)、45~54岁组(102/326)和≥55岁(44/158)组的高危型HPV感染率差异无统计学意义(P均>0.05)。比较不同组高危型HPV阳性者中≥CINⅡ患者的比例差异,结果显示<45岁组(94/213)和45~54岁组(67/102)差异有统计学意义(χ2=12.82,P<0.05),45~54岁组(67/102)与>55岁组(7/44)差异亦具有统计学意义(χ2=30.47,P<0.05),<45岁组(94/213)和≥55岁组(7/44) 差异也有统计学意义(χ2=12.17,P<0.05),即实时荧光PCR检测高危型HPV阳性者中,45~54岁妇女患宫颈高度病变比例最高,在≥55岁妇女中最低。
实时荧光PCR筛查宫颈高度病变及宫颈癌的临床价值实时荧光PCR筛查宫颈高度病变和宫颈癌的敏感性为92.82%,特异性为82.17%,阳性预测值为46.80%,阴性预测值为98.54%(表1)。
讨 论
实时荧光PCR技术是从普通PCR发展出的新型核酸检测技术,将基因扩增的灵敏性、分子杂交的特异性及荧光化学反应的精确性合为一体,因而具有DNA杂交的高特异性和光谱技术的高精确性;数据采集分析全部由仪器自动完成,使检测操作步骤更简单,结果观测更方便;每批检测时间短;单批次可检测32~96份临床样本,更适合中小规模的临床检测;实时荧光PCR检测的花费低;采用荧光PCR仪可克服传统PCR需电泳分析和样本间污染[10-13]等缺点。缺点是仪器操作较复杂,需专人操作;对于检测结果接近阈值的需要观察PCR曲线才能判断结果。本研究中实时荧光PCR方法筛查高度宫颈病变和宫颈癌的敏感性达92.82%,阴性预测值达98.54%,用于宫颈癌筛查的临床价值理想。在893名实时荧光PCR检测高危型HPV结果为阴性者中,仅有13名患者经过活检证实为≥CINⅡ病变, 考虑原因可能为:(1)导致宫颈癌变的HPV型别不在本检测方法可以检测到的13种HPV之列;(2)宫颈细胞中的HPV含量低于试剂盒检测阈值;(3)采集到的宫颈脱落细胞过少,HPV拷贝数过少从而导致检测结果出现假阴性;(4)标本中含有较多的PCR抑制物,如血液中含有的可以严重抑制PCR的复合物、来自亚铁血红素族的卟啉和抗凝血剂柠檬酸盐及肝素等。因此,为了提高检测的准确性,应该在保证取材充分的同时尽量避免出血。
本研究中1252名妇女的高危型HPV检测总体阳性率为28.67%,明显高于武明辉等[14]报道的北京地区感染率9.89%,推测其原因可能与选取的研究对象为门诊就诊妇女,即机会性筛查所致。本研究中,45~54岁年龄段妇女高危型HPV阳性者中患宫颈高度病变的比例明显升高,提示对此年龄段高危型HPV阳性者需提高警惕,密切随访。
根据说明书:CT值空白判断为阴性,CT值≤40判断为阳性。而在检测中发现一些样本的CT值显示在40上下很小的范围内,对阈值的轻微调整就可能产生完全不同的结果。此时则需要对荧光扩增曲线进行分析。根据实时荧光PCR的原理,阳性标本反应管中荧光团的增长应为平滑的S型曲线,即反应产物在经过短时间缓慢增长后迅速进入呈对数曲线生长的快速反应期,继而又出现缓慢增长的平台期。而一些CT值在40左右的标本增长曲线并未呈光滑的S型甚至出现上下抖动,不符合标准的PCR增长曲线,考虑原因可能是检测样本中含有拷贝数极低的HPV DNA,因此将此类标本检测结果定义为阴性时并不代表被检测妇女完全除外13种高危型HPV感染。HC-Ⅱ检测在对≥CINⅡ病变的敏感度与HPV病毒载量关系的研究中发现:将阈值设定在4700个HPV拷贝数时最理想,即病毒含量在此水平下的妇女,8~10年内发生≥CINⅡ可能性极低,与更低的阈值相比既没有明显降低检测宫颈高度病变的敏感性,又避免了HPV病毒载量较低者的过度恐慌。与用于实验室研究的检测希望将所有感染者全部筛查出来目的不同,用于筛查宫颈癌及其癌前病变临床检测的目的并非是把所有HPV感染者无论其病毒载量高低全部筛查出来,而是尽可能只将潜在的宫颈病变患者筛查出来。因此,检测阈值并非设定的越低越好,而是要保证临床检测的应用价值。本组34例CT值显示在37.06~43.57范围内的样本,将符合平滑S型曲线者判定为阳性的9例中有2例为宫颈高度病变患者;将扩增曲线上下抖动,不符合平滑S型曲线者判定为阴性的25例无一例为宫颈高度病变患者。
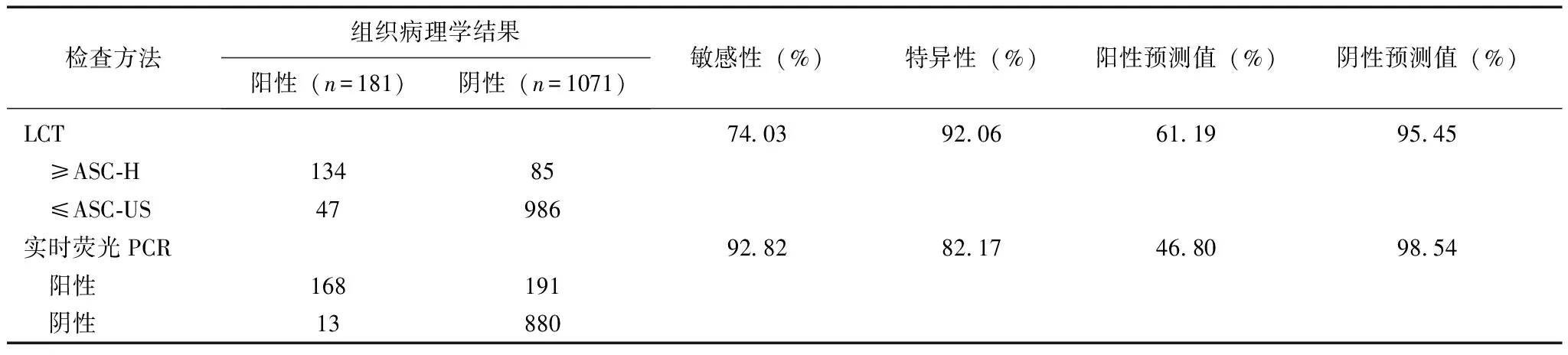
表 1 LCT、实时荧光PCR的筛查宫颈高度病变及宫颈癌的价值
LCT:宫颈液基细胞学检查;ASC-H:不除外高度病变的不典型鳞状上皮细胞;ASC-US:不能明确意义的不典型鳞状上皮细胞
综上,本研究结果显示,实时荧光PCR无论在筛查宫颈高度病变的灵敏度还是其检测的阴性预测值都很理想,可用于宫颈癌筛查。因此建议增长曲线呈现平滑的S型或许应列为阳性结果的判读依据之一。由于45~54岁年龄段妇女高危型 HPV阳性者中患宫颈高度病变的比例明显升高,对此年龄段高危型HPV阳性者需提高警惕,密切随访。
[2] Woodman CB, Collins S, Winter H, et al. Natural history of cervical human papillomavirus infection in young women:a longitudinal cohort study[J]. Lancet, 2001, 357(9271):1831-1836.
[3] Arbyn M, Sasieni P, Meijer CJ, et al. Chapter 9: Clinical applications of HPV testing: a summary of meta-analyses[J]. Vaccine, 2006, 24(Suppl 3):78-89.
[4] Sherman ME, Lorincz AT, Scott DR, et al. Baseline cytology, human papillomavirus testing, and risk for cervical neoplasia: a 10-year cohort analysis[J]. J Natl Cancer Inst, 2003, 95(1):46-52.
[5] Bulk S, Bulkmans NW, Berkhof J, et al. Risk of high-grade cervical intra-epithelial neoplasia based on cytology and high-risk HPV testing at baseline and at 6-months[J]. Int J Cancer, 2007, 121(2):361-367.
[6] Ronco G, Segnan N, Giorgi-Rossi P, et al. Human papillomavirus testing and liquid-based cytology: results at recruitment from the new technologies for cervical cancer randomized controlled trial[J]. J Natl Cancer Inst, 2006, 98(11):765-774.
[7] Ronco G, Giorgi-Rossi P, Carozzi F, et al. Human papillomavirus testing and liquid-based cytology in primary screening ofwomen younger than 35 years: results at recruitment for a randomised controlled trial[J]. Lancet Oncol, 2006, 7(7):547-555.
[8] Mayrand MH, Duarte-Franco E, Rodrigues I, et al. Human papillomavirus DNA versus Papanicolaou screening tests for cervical cancer[J]. N Engl J Med, 2007, 357(16):1579-1588.
[9] Arbyn M, Anttila A, Jordan J, et al. European Guidelines for Quality Assurance in Cervical Cancer Screening. Second edition-summary document[J]. Ann Oncol, 2010, 21(3):448-458.
[10] Ginzinger DG. Gene quantification using real-time quantitative PCR: an emerging technology hits the mainstream[J]. Exp Hematol, 2002, 30(6):503-512.
[11] Nagao S, Yoshinouchi M, Miyagi Y, et al. Rapid and sensitive detection of physical status of human papillomavirus type 16 DNA by quantitative real-time PCR[J]. J Clin Microbiol, 2002, 40(3):863-867.
[12] Peitsaro P, Johansson B, Syrjänen S. Integrated human papillomavirus type 16 is frequently found in cervical cancer precursors as demonstrated by a novel quantitative real-time PCR technique[J].J Clin Microbiol, 2002, 40(3):886-891.
[13] Sherman ME, Schifman M, Cox JT, et al. Effects of age and human papilloma viral load on colposcopy triage:data from the randomized Atypical Squamous Cells of Undetermined Significance/Low-Grade Squamous Intraepithelial Lesion Triage Study (ALTS)[J].J Nat I Cancer Inst, 2002, 94(2):102-107.
[14] 武明辉,张淞文,张为远, 等. 2007-2008年北京地区25~54岁已婚妇女高危型人乳头状瘤病毒感染的流行病学调查[J]. 中华妇产科杂志, 2009,44(12):892- 897.
卞美璐 电话:010-84206109, 传真:010-64217749,电子邮件:cjy19781031@163.com
R71
A
1000-503X(2011)03-0345-03
10.3881/j.issn.1000-503X.2011.03.027
2010-08-24)
