N-(6-氨乙基)-5-氯-1-萘磺酰胺在体外对人脂肪间充质干细胞转分化为内皮细胞的影响
2011-11-23翟羽佳仉红刚张秋菊修瑞娟
翟羽佳,陈 嘉,仉红刚,张 静,张秋菊,修瑞娟
1中国医学科学院 北京协和医学院 研究生院,北京1007302中国医学科学院 北京协和医学院 微循环研究所,北京100005
·论著·
N-(6-氨乙基)-5-氯-1-萘磺酰胺在体外对人脂肪间充质干细胞转分化为内皮细胞的影响
翟羽佳1,2,陈 嘉1,2,仉红刚2,张 静2,张秋菊2,修瑞娟2
1中国医学科学院 北京协和医学院 研究生院,北京100730
2中国医学科学院 北京协和医学院 微循环研究所,北京100005
目的研究N-(6-氨乙基)-5-氯-1-萘磺酰胺(W7)在体外对人脂肪间充质干细胞(hADSCs)转分化为内皮细胞(EC)的影响。方法以含40 ng/ml血管内皮生长因子(VEGF)和10 ng/ml碱性成纤维细胞生长因子(bFGF)的干细胞无血清分化培养基进行细胞培养,分为空白对照组(不含W7的分化培养基)和高(30 μmol/L)、中(20 μmol/L)、 低(10 μmol/L)剂量W7组。hADSCs加药8 d后,采用流式细胞术(FCM)检测各组EC von Willebrand因子(vWF)和血管选择性钙黏素(VE-Cadherin)表型变化,激光共聚焦显微镜检测钙荧光探针(Fluo-3)标记的细胞内[Ca2+]i变化;同时将W7处理后的hADSCs种植在Matrigel胶上,观察细胞成血管能力;采用Western blot技术分析不同浓度药物处理8 d后细胞外调节激酶(ERK)和磷酸化ERK(p-ERK)变化。结果分化至8 d时,与空白对照组相比,hADSCs转分化后的细胞VE-Cadherin 和vWF表达量随W7浓度降低而显著上升(P<0.01),胞质[Ca2+]i显著升高(P<0.01)。W7干预组的培养细胞均有管腔样血管结构形成,空白对照组的细胞无血管管型形成。与空白对照组相比,不同剂量W7干预组间细胞的ERK表达水平差异无统计学意义(P>0.05);随着W7浓度的降低,p-ERK表达水平明显升高(P<0.05)。结论适当浓度的W7可促进hADSC向EC诱导分化,其机制可能与促进细胞内[Ca2+]i增加,激活细胞分化过程中的ERK/MAPK信号通路有关。
N-(6-氨乙基)-5-氯-1-萘磺酰胺;人脂肪间充质干细胞;内皮细胞;诱导分化
钙离子(Ca2+)作为第二信使,在细胞分裂、极性形成、增殖、分化、衰老、凋亡等过程中均发挥着重要的调控作用[1-2]。Ca2+信使系统启动的中心环节是胞质内[Ca2+]i的改变,其瞬间有效变化是细胞响应各种刺激信号的初始步骤,由此可引发一系列信号转导的向下传递而改变细胞行为。本课题组以往直接采用[Ca2+]i调节剂进行祖细胞分化干预研究,结果显示:钙离子载体A23187在高浓度时(55 μmol/L)可通过有效改变细胞内[Ca2+]i,促进内皮祖细胞(endothelial progenitor cell,EPC)向内皮细胞(endothelial cell,EC)分化[3],故在EPC诱导分化成熟EC过程中,改变祖细胞内[Ca2+]i会有效改变其分化中的细胞行为,但有关具有细胞内[Ca2+]i调节功能的N-(6-氨乙基)-5-氯-1-萘磺酰胺[N-(6-aminohexyl)-5-chloro-1- naphthalenesulfonamide,W7]对干、祖细胞体外诱导分化EC的相关作用及其机制目前尚未见报道。本研究评估了W7在体外对人脂肪间充质干细胞(human adipose-derived stem cells,hADSCs)转分化为EC的影响,探讨了其调控机制。
材料和方法
材料基底胶Matrigel购自美国BD公司,Fluo-3荧光探针购自美国Biotium公司;CD144[血管选择性钙黏素(VE-cadherin)],血管性血友病因子(von Willebrand factor,vWF)抗体,细胞外调节激酶(extracellular regulated kinase, ERK)一抗(鼠抗人),磷酸化细胞外调节激酶(phosphorylated ERK, p-ERK)一抗(鼠抗人),β-actin多克隆抗体(鼠源)、二抗(羊抗鼠)购自美国Santa Cruz公司;血管内皮生长因子(vascular endothelial growth factor,VEGF)购自英国Peprotech公司;无血清培养基、碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)购自德国Invitrogen公司;十二烷基硫酸钠(sulfate dodecyl sodium,SDS)、N,N,N’,N’-四甲基乙二胺(N,N,N’,N’-Tetramethylethylenediamine,TEMED)、吐温20(Tween20)、W7、I型胶原酶购自美国Sigma公司;磷酸盐缓冲液(phosphate be lanced solution,PBS)、双抗、L-谷氨酰胺、低糖DMEM、胎牛血清和0.25%的胰酶均由中国医学科学院基础医学研究所细胞中心提供;光学倒置相差显微镜购自日本Nikon公司;流式细胞仪(flow cytometry,FCM)(型号:EPICS XL)购自美国Coultor公司;CO2细胞培养箱购自德国Heraeus公司。不同浓度W7诱导培养液配制:以2 ml DMSO将50 mg W7干粉溶解,后吸取20 μl以无血清分化培养基(含40 ng/ml VEGF、10 ng/ml bFGF、1%谷氨酰胺、1%双抗的无血清培养基)稀释至2 ml,再分别吸取该稀释液226、453、679 μl,均再以无血清培养基加至15 ml,即配制为W7低(10 μmol/L)、中(20 μmol/L)、高(30 μmol/L)剂量干预组培养基。
hADSCs的采集、分离和培养
采集:成人脂肪组织取自北京协和医院整形外科25~40岁的健康女性皮下吸脂手术患者,经无菌采集约200 ml脂肪组织,供者均知情同意。
分离和培养:将得到的脂肪组织用含5%青霉素/链霉素(双抗)的PBS冲洗2次,洗去血细胞,以手术剪剪成体积约1 mm×1 mm×1 mm的小块,加入0.1%的Ⅰ型胶原酶37℃消化1 h,以含10%胎牛血清、1%谷氨酰胺、1%双抗的低糖DMEM培养基终止反应后,2000 r/min (r=13 cm)离心10 min收集细胞,以104个悬浮细胞/ml的密度接种于上述终止反应用培养基中,置37℃、5%CO2培养箱培养,72 h后换液,弃去未贴壁的细胞,后每3 d换液1次,当细胞达70%~80%融合时,以0.25%胰酶常规消化传代。取第3代(P3)细胞以FCM鉴定其CD45-FITC、CD44-FITC、CD29-FITC、CD14-FITC和CD105-PE细胞表型[4-5]。
W7干预hADSC诱导分化EC取P3 hADSC进行W7药物干预实验。调整细胞浓度为1.0×105/ml,接种于含40 ng/ml的VEGF和10 ng/ml bFGF的无血清分化培养基中进行诱导分化,于5%CO2、37℃下培养8 d,此组为空白对照组。同期以上述配制的10、20和30 μmol/L W7诱导培养液培养P3细胞,作为低、中、高剂量W7干预组。参照本课题以往研究,以含40 ng/ml的VEGF和10 ng/ml的bFGF无血清分化培养基配制的终浓度为50 μmol/L的A23187溶液同期培养P3细胞,作为下述FCM检测的阳性对照组[3]。
细胞形态学观察在诱导分化培养后的0、4、8 d,采用光学倒置显微镜观察空白对照组和低、中、高剂量W7干预组培养细胞的形态学变化。
FCM鉴定诱导分化8 d时,弃掉培养基,加入0.25%的胰酶,待95%的细胞被消化后,弃掉剩余的胰酶上清,加入上述各组不同的培养基吹打悬浮细胞,分别吸入离心管中,2000 r/min (r=13 cm)离心5 min,弃上清。后分别进行vWF-FITC和VE-Cadherin-FITC分析,实验步骤:在不同管中分别加入抗vWF和VE-Cadherin一抗,4℃孵育1 h;PBS洗2次,加入标记FITC的二抗,4℃孵育1 h;PBS洗2次,加入500 μl PBS重悬细胞后,采用FCM进行分析。空白对照组细胞在培养至第50 d时进行表型鉴定,方法同前。
细胞内[Ca2+]i变化检测以各组细胞制作细胞爬片,具体方法为:于6孔板中每孔置入已灭菌的18 mm×18 mm盖玻片,将P3细胞种在盖玻片上,分为高、中、低3个剂量W7干预组和3个空白分化0、8、15 d无药物干预对照组;其中,3个W7干预组药物干预时间均为8 d。上述细胞培养结束后,将6孔板中的上清弃去,PBS洗2次,分别加入10 μmol/L的Fluo-3荧光探针250 μl,37℃下孵育45 min;PBS洗2次,在载玻片上滴上1滴甘油:PBS为1∶1的混合溶液,将盖玻片倒扣在载玻片上,用指甲油封片。在激光共聚焦显微镜下观察荧光强度(F),以此反映[Ca2+]i的浓度(C)的变化,其钙离子浓度变化△C=(F’实验组-F’空白组)/F’空白组。
细胞血管管腔样结构形成能力观察在96孔板备用孔内加入20 μl的Matrigel胶,37℃下放置30 min。 将已用3个剂量W7干预组(10、20、30 μmol/L) 培养基及不含W7的无血清分化培养基(作为空白对照组)分别预处理了24h的P3 hADSCs细胞浓度调整到3×104/ml,在每个已加入Matrigel胶的孔内分别加入100 μl上述细胞悬液。24 h后置于相差倒置显微镜下观察。
ERK和p-ERK的Westernblot分析向W7各剂量组干预分化8 d后的单层贴壁细胞中加入含1 μmol/L 苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的放射免疫沉淀法(radio-immunoprecipitation assay,RIPA)裂解液100 μl,置4℃ 20 min后以细胞刮片将细胞刮下,12 000 r/min(r=13 cm)离心5 min,将各组细胞总蛋白上清分装,-80℃保存备用。取各组总蛋白,以12.5%聚丙烯酰胺(sodium dodecyl sulfate polyacry- lamide gel electropheresis,SDS-PAGE)凝胶分离(浓缩胶:80 V;分离胶:120 V),每孔上样量为30 mg/ml。将分离后的蛋白质湿转至聚偏氟乙烯(polyvinylidenefluoride,PVDF)膜上(电 流I=86 mA, 时间t=3.5 h)。5%脱脂奶粉室温封闭1 h, 洗脱后,分别加入1∶500稀释的ERK和p-ERK多克隆抗体,一抗4℃孵育过夜。洗脱后加入1∶1000稀释的荧光二抗,室温孵育1 h,本研究以β-actin作为内参照物,一抗使用1∶500稀释的β-actin多克隆抗体,二抗同上。其抗原抗体复合物采用电化学发光法(electrochemiluminescence,ECL)显示照相,采用Quantity One软件对照片上蛋白质条带的平均光密度(OD)进行分析。以检测靶蛋白OD值/β-actin OD值的比值来反映蛋白质含量的变化。同法分析p-ERK的蛋白含量。
统计学处理采用SPSS 14.0统计软件,数据以均数±标准误表示,组间比较采用单因素方差分析,两两比较采用最小显著差数法,P<0.05为差异有统计学意义。
结 果
细胞形态学观察结果相差倒置显微镜观察显示,原代细胞培养72 h后大部分贴壁,细胞最初为短梭形,2~3 d后大部分生长为长梭形或多边形,有的可见双核,呈成纤维细胞样,细胞如刷状和漩涡状生长。原代培养的细胞30 d可达80%~90%融合,传代细胞增殖速度较原代细胞快,大约7 d左右可长至90%。选取P3细胞按上述分组进行诱导培养,诱导培养至第8天时,各组细胞显示不同程度的短、圆状(图1)。上述细胞FCM结果显示为:CD45(-),CD14(-),CD29(+),CD44(+),CD105(+)。
FCM表型鉴定结果诱导分化至第8天时,以FCM分析各组培养细胞的免疫表型VE- Cadherin(CD144)和vWF,结果显示:空白对照组为弱阳性,W7干预组依浓度的降低VE-Cadherin和vWF阳性表达率增加(表1、图2)。空白对照组继续诱导培养至第50天时,VE-Cadherin和vWF阳性率均方可达到91.5%(图3)。
细胞内[Ca2+]i变化观察结果空白对照组0、8、15 d的[Ca2+]i分别为17.30±1.08、27.38±0.93、46.79±3.53;8、15 d的[Ca2+]i均明显高于0 d(P均=0.000)。分化至8 d时,高、中、低剂量W7组的[Ca2+]i分别为28.3±1.77、60.58±2.46、97.78±5.44,高剂量W7组与同期空白对照组间差异无统计学意义(P=0.646),中、低剂量W7组细胞[Ca2+]i均明显高于同期空白对照组(P均=0.000)(图4)。
成血管能力测定结果倒置显微镜下观察可见,空白对照组的细胞在Matrigel胶上24 h后未见有管腔样结构形成,W7干预组在24 h后均可见血管管腔样结构形成,且随着W7浓度的降低,其促进分化后hADSC血管成型能力呈增加趋势(图5)。
ERK1/2、p-ERK水平分析结果与空白对照组相比,不同剂量W7干预组间细胞的ERK表达水平差异无统计学意义(P>0.05);随着W7浓度的降低,p-ERK表达水平明显升高(P<0.05)(表2、图6)。
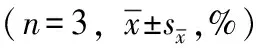
表 1 流式细胞术检测vWF和VE-Cadherin结果
W7: N-(6-氨乙基)-5-氯-1-萘磺酰胺;vWF: 血管性血友病因子;VE-cadherin:血管内皮钙黏素;与空白对照组比较,aP<0.01
W7: N-(6-aminohexyl)-5-chloro-1-naphthalenesulfonamide;vWF: von Willebrand factor;VE-cadherin:vascular endothelial cadherin;aP<0.01 compared with control group
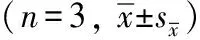
表 2 Western blot检测结果
ERK:细胞外调节激酶;p-ERK:磷酸化细胞外调节激酶;与空白对照组比较,aP<0.05
ERK: extra cellular regulated kinase; p-ERK: phosphorylated extracellular regulated kinase,aP<0.05 compared with control group
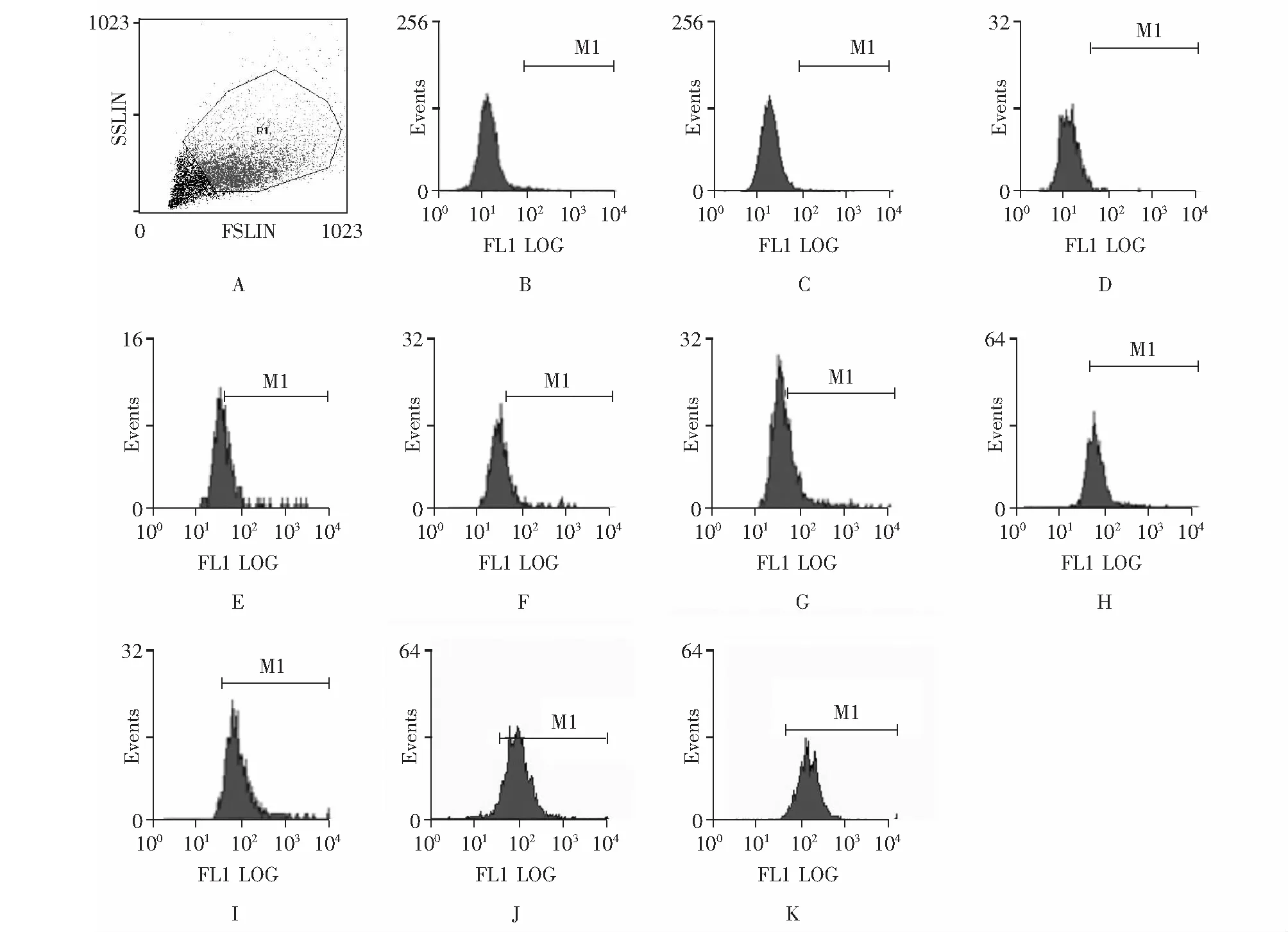
vWF: 血管性血友病因子;W7: N-(6-氨乙基)-5-氯-1-萘磺酰胺;hADSC:人脂肪间充质干细胞;vWF: von Willebrand factor;W7: N-(6-aminohexyl)-5-chloro-1-naphthalenesulfonamide;hADSC:human adipose-derived mesenchymal stem cellsA.散点图;B. 空白对照组CD144;C. 空白对照组vWF;D. W7-30 μmol/L组CD144;E. W7-30 μmol/L组vWF;F. W7-20 μmol/L组CD144;G. W7-20 μmol/L组vWF;H. W7-10 μmol/L组CD144;I. W7-10 μmol/L组vWF;J. A23187阳性对照组CD144;K. A23187阳性对照组vWFA. scatter diagram;B. CD144 presents on control group’s hADSC;C. vWF presents on control group’s hADSC;D. CD144 presents on W7-30 μmol/L group’s hADSC;E. vWF presents on W7-30 μmol/L group’s hADSC;F. CD144 presents on W7-20 μmol/L group’s hADSC;G. vWF presents on W7-20 μmol/L group’s hADSC;H. CD144 presents on W7-10 μmol/L group’s hADSC;I. vWF presents on W7-10 μmol/L group’s hADSC;J. CD144 presents on A23187 group’s hADSC;K. vWF presents on A23187 group’s hADSC
图 3 空白对照组诱导至50 d表型鉴定Fig 3 Phenotype identification in of the blank control group after 50 days of induction
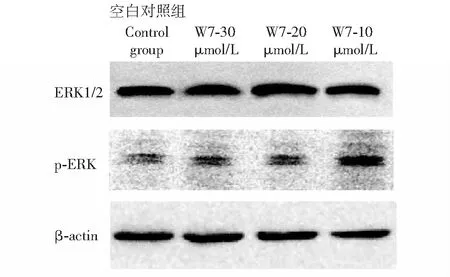
ERK:细胞外调节激酶;p-ERK:磷酸化细胞外调节激酶ERK: extracellular regulated kinase;p-ERK: phosphorylated extracellular regulated kinase
讨 论
一定程度的调控细胞内 [Ca2+]i能够通过多条信号转导通路达到有效促进干、祖细胞的诱导分化,但当细胞内[Ca2+]i过高时会引起细胞凋亡发生,有效调控细胞内[Ca2+]i且不会引起细胞凋亡发生的调节剂,对于干、祖细胞体外诱导分化,研究干、祖细胞诱导分化机制均有着重要意义和应用价值。已有研究证实,在hADSC向成骨、成脂细胞等诱导分化过程中,细胞内[Ca2+]i浓度呈增加趋势[6-7],但目前尚未见hADSC诱导分化EC过程中[Ca2+]i调控及其变化相关报道。W7是一种钙调蛋白(calmodulin,CaM)抗剂类工具药物[8],近年研究证实,W7还可以通过增强细胞内质网钙库的Ca2+释放及细胞外Ca2+内流,导致细胞内[Ca2+]i升高[9]。
本研究采用原代培养的细胞,经细胞免疫表型鉴定结果显示为CD45(-),CD14(-),CD29(+),CD44(+),CD105(+),证实为hADSC。在无W7药物干预的情况下,使用含40 ng/ml VEGF和10 ng/ml bFGF的分化培养基对生长状态良好稳定的P3 hADSC进行向EC的转分化诱导,培养至第50天时,vWF和VE-Cadherin的阳性表达率可达到90%以上;但随培养时间延长,凋亡细胞逐渐增多;而在10 μmol/L W7诱导作用下,hADSCs分化至第8天时,vWF和VE-Cadherin的阳性表达率就可高达75%~90%,随着W7药物浓度的递增,中剂量组(20 μmol/L)处理的hADSCs vWF和VE-Cadherin阳性表达率为20%~35%;高剂量组(30 μmol/L)为7%~15%,反呈降低趋势。上述中、高W7剂量组的vWF和VE-Cadherin的阳性表达率仍显著高于空白对照组,且细胞状态良好,无细胞凋亡现象,证实W7可促进hADSC向EC的分化,且不导致细胞凋亡。
本研究中,随着诱导分化时间的延长,同空白对照组8 d时的细胞相比,W7低、中剂量组细胞内[Ca2+]i浓度显著升高,而高剂量组与空白对照组8 d时的细胞无明显差异。本课题组以往研究结果显示:A23187可使细胞膜上的钙离子通路开放,导致细胞内[Ca2+]i升高,且能够显著增加EPC体外诱导分化EC过程中细胞vWF和VE-Cadherin的表达[3]。本研究结果亦进一步证实,vWF和VE-Cadherin升高与[Ca2+]i的升高确呈正相关。同时,3个不同浓度W7药物干预组随着细胞vWF和VE-Cadherin表型表达的升高,其相应体外成血管管型的能力增强,且随着W7药物浓度的降低,其促进分化后hADSC血管成型能力呈增加趋势,低剂量W7(10 μmol/ L)组的成血管管型能力为最强。
迄今发现的3条MAPKs信号通路(ERK通路、JNK/SAPK通路和p38MAPK通路)中, ERK通路主要调控细胞的分化[10],其传导通路的激活均与EGF、VEGF、PDGF等生长因子以及钙离子密切相关。ERK的短暂激活可使细胞增殖,而ERK的持续激活可使细胞分化[11]。有研究证实,细胞内[Ca2+]i的增加可导致ERK/MAPK信号通路的激活[12],其分子机制包括:(1)激活钙依赖酪氨酸激酶PYK2;(2)刺激核苷酸交换因子Ras-GRF;(3)抑制Ras-GAPs(一种Ras的GTP酶活化蛋白),激活钙调蛋白依赖激酶Ⅰ和Ⅱ来稳定EGF受体。本研究结果显示,以看家基因β-actin为内参照,与空白对照组相比,3种不同浓度W7干预组的ERK1/2表达均无显著性差异;随着W7浓度逐渐降低和其细胞内[Ca2+]i的逐步升高,p-ERK表达逐渐升高,其中,低剂量组的p-ERK磷酸化水平较空白分化对照组升高最为显著。上述结果提示,适当浓度的W7可以有效激活ERK/MAPK信号通路,促进诱导hADSC向EC分化;当浓度为10 μmol/L时,W7可较大程度激活该信号传导通路。
Xia等[13]研究证实,活化JNK和p38或抑制ERK的活化可以促进细胞凋亡。本研究结果显示:高剂量W7组在分化至第8天时,胞内[Ca2+]i较空白对照组8 d时稍高,但无显著性差异;中、低剂量W7组在分化至第8天时,胞内[Ca2+]i浓度均显著升高,甚至高于空白对照组15d时,但并未出现细胞凋亡现象,提示W7药物可通过提高细胞内[Ca2+]i,激活ERK磷酸化,而ERK的活化在一定程度上起到了抑制细胞凋亡的作用。
综上,适当浓度的W7能够促进体外诱导hADSC转分化为EC,不仅具有EC的表型,且具有EC的功能,本研究结果为开发W7老药物新用途和促进体外诱导hADSC转分化为EC进一步提供了新的研究依据。
(本文图1、4、5见插图第1、2页)
[1] Lipskaia L, Hulot JS, Lompré AM. Role of sarco/endoplasmic reticulum calcium content and calcium ATPase activity in the control of cell growth and proliferation[J]. Pflugers Arch, 2009, 457(3):673-685.
[2] Brnjic S, Olofsson MH, Havelka AM, et al. Chemical biology suggests a role for calcium signaling in mediating sustained JNK activation during apoptosis[J]. Mol Biosyst, 2010, 6(5):767-774.
[3] 王琴. 钙离子载体A2187对脐血来源EPC作用及应用蛋白质芯片检测蛋白质表达差异的研究[D].北京:北京协和医学院,2010.
[4] Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies[J]. Tissue Eng, 2001, 7(2):221-228.
[5] Bunnell BA, Flaat M, Gagliardi C, et al. Adipose-derived stem cell: isolation, expansion and differentiation[J]. Method, 2008, 2(45):115-120.
[6] Ding SJ, Shie MY, Hoshiba T, et al. Osteogenic differentiation and immune response of human bone-marrow-derived mesenchymal stem cells on injectable calcium-silicate-based bone grafts[J]. Tissue Eng Part A, 2010, 16(7):2343-2354.
[7] Shin MK, Kim M,Bae Y, et al. A novel collagen-binding peptide promotes osteogenic differentiation via Ca2+/calmodulin-dependent protein kinase Ⅱ/ERK/AP-1 signaling pathway in human bone marrow-derived mesenchymal stem cells[J]. Cell Signal, 2008, 20(4):613-624.
[8] Hiroyoshi H, David JH. Calmodulin antagonists and cellular physiology[M]. London: Academic Press, 1985:13-23:
[9] Jan CR,Yu CC,Huang JK. N-(6-aminohexyl)-5-chloro-1-naphthalenesulfonamide hydrochloride) (W-7) causes increases in intracellular free Ca2+levels in bladder female transitional carcinoma (BFTC) cells[J]. Anticancer Res,2000, 20(6B):4355- 4359.
[10] Liang L, Ma T, Chen W, et al. Therapeutic potential and related signal pathway of adipose-derived stem cell transplantation for rat liver injury[J]. Hepatol Res, 2009, 39(8):822-832.
[11] Marshall CJ. Specificity of receptor tyrosine kinase signaling transient versus sustained extracellular signal regulated kinase activation[J].Cell, 1995, 80(2):179-185.
[12] Chuderland D, Seger R. Calcium regulates ERK signaling by modulating its protein-protein interactions[J]. Commun Integr Biol, 2008, 1(1):4-5.
[13] Xia Z, Dickens M,Raingeaud J,et al. Opposing effects of ERK and JNK-p38 MAP kinases on apoptosis[J].Science,1995, 270(5240):1326-1331.
InVitroEffectofN-(6-aminohexyl)-5-chloro-1-naphthalenesulfonamideonDifferentiationfromHumanAdipose-derivedMesenchymalStemCellstoEndothelialCells
ZHAI Yu-jia1,2, CHEN Jia1,2, ZHANG Hong-gang2, ZHANG Jing2, ZHANG Qiu-ju2, XIU Rui-juan2
1Graduate School, CAMS and PUMC, Beijing 100730, China
2Institute of Microcirculation,CAMS and PUMC, Beijing 100005, China
ZHANG Hong-gang Tel: 010-65123243, E-mail: zhanghg1966126@yahoo.com.cn
ObjectiveTo explore the effect of N-(6-aminohexyl)-5-chloro-1-naphthalenesulfonamide(W7) on the differentiation from human adipose-derived mesenchymal stem cells (hADSCs) to endothelial cells.MethodshADSCs were cultured with serum-free differential medium containing 40 ng/ml vascular endothelial growth factor (VEGF) and 10ng/ml basic fibroblast growth factor (bFGF). Cells were divided into control group (differential medium without W7), high-dose group (containing 30 μmol/L W7), medium-dose group (containing 20 μmol/L W7), and low-dose group ( containing 10 μmol/L W7). The hADSCs were cultured for 8 days, and then the changes in the phenotypes of von Willebrand factor (vWF) and vessel-selective cadherin (VE-Cadherin) were detected by flow cytometry (FCM). The intracellular Ca2+labeled with Fluo-3 was detected by laser confocal microscopy. After hADSCs planting on Matrigel, their angiogenic potentials were observed under the inverted phase contrast microscope, and the expression of extracellular regulated kinase (ERK) and phosphorylated extracellular regulated kinase (p-ERK) were evaluated by Western blot.ResultsAfter the hADSCs were cultured for 8 days, compared with the control group, the expressions of vWF and VE-Cadherin significantly increased along with the decrease of W7 level and the intracellular Ca2+also significantly increased (P<0.01). Lumina-like vascular structure was formed in W7 treatment groups, but not in the blank control group. Compared with the blank control group, the expression of ERK showed no significant in W7 treatment groups (high-, medium-, and low-dose groups)(P>0.05); however, along with the decrease of W7 levels, the expression of p-ERK significantly increased(P<0.05).ConclusionW7 in proper levels can effectively induce the differentiation from hADSCs to endothelium by increasing the intracellular Ca2+level and thus activating the ERK/MAPK pathway.
N-(6-aminohexyl)-5-chloro-1-naphthalenesulfonamide;human adipose-derived mesenchymal stem cells;endothelial cells; induce differentiation
ActaAcadMedSin, 2011,33(3):306-312
仉红刚 电话:010-65123243,电子邮件:zhanghg1966126@yahoo.com.cn
Q254
A
1000-503X(2011)03-0306-07
10.3881/j.issn.1000-503X.2011.03.019
科技部社会公益专项(2005DIBIJ086)Supported by the Special Social Commonweal Research Programs of the Ministry of Science and Technology(2005DIBIJ086)
2010-12-06)
