MicroRNA-9-1慢病毒载体的构建及其对小鼠骨髓间质干细胞诱导分化为神经细胞的影响*
2011-11-22景黎君贾永林鲁晶晶王舒阳李尽义贾延劼
景黎君, 贾永林, 鲁晶晶, 韩 瑞, 王舒阳, 李尽义, 彭 涛, 贾延劼
(郑州大学第一附属医院神经内科, 河南 郑州 450052)
MicroRNA-9-1慢病毒载体的构建及其对小鼠骨髓间质干细胞诱导分化为神经细胞的影响*
景黎君, 贾永林, 鲁晶晶, 韩 瑞, 王舒阳, 李尽义, 彭 涛, 贾延劼△
(郑州大学第一附属医院神经内科, 河南 郑州 450052)
目的探讨microRNA-9-1在体外诱导小鼠骨髓间充质干细胞(MSCs)向神经细胞分化中的作用。方法构建小鼠microRNA-9-1慢病毒载体(microRNA-9-1-LV)并感染小鼠MSCs,筛选最适感染复数(MOI);实验分为未感染组、感染组(感染microRNA-9-1-LV)、阴性对照组(感染FU-RNAi-NC-LV);采用β-巯基乙醇诱导感染后小鼠MSCs分化为神经细胞。倒置荧光显微镜下观察MSCs感染后荧光表达情况;采用免疫细胞化学染色检测神经元烯醇化酶(NSE)、神经微管结合蛋白(MAP-2)和胶质纤维酸性蛋白(GFAP)的表达变化;PT-PCR检测MAP-2 mRNA的表达变化;MTT方法检测细胞存活率。结果(1)阳性克隆PCR证明小鼠microRNA-9-1慢病毒载体构建成功,孔稀释法测定病毒滴度为1×1012TU/L。(2)倒置显微镜下观察小鼠microRNA-9-1慢病毒载体感染成功,MOI值为20,感染4 d时感染率最高,细胞存活率较高,感染率可达 91.3%±4.2%。(3)β-巯基乙醇可以诱导MSCs向神经细胞分化,其中以感染组诱导效果最佳,NSE和MAP-2的表达率显著高于其它各组(P<0.05)。结论(1)MicroRNA-9-1-LV可高效感染小鼠MSCs。(2) 感染miRNA-9-1-LV后MSCs经β-巯基乙醇诱导向神经细胞分化比率增加。
MicroRNA-9-1; 骨髓间充质干细胞; 神经元; 慢病毒
MicroRNA是生物体内源的小RNA分子,可以在转录水平、转录后水平、表观遗传学水平等水平调控基因组的表达,参与生命过程中一系列的重要进程[1]。诱导骨髓间质干细胞(marrow mesenchymal stem cells, MSCs)分化为神经细胞有可能成为临床中枢神经系统疾病治疗的可行性方法[2],但其具体机制尚不清楚,研究发现MSCs分化为神经细胞过程中,microRNA在其中起着重要调控作用[3]。microRNA-9在脑组织中表达较为丰富,研究表明,microRNA-9在神经干或前体细胞分化发育中起着重要作用[4]。MSCs可以向神经细胞方向分化,但是microRNA-9是否在MSCs诱导分化中起作用尚不清楚。本研究根据确定的microRNA-9-1序列,构建目的microRNA慢病毒载体,将其感染小鼠MSCs,β-巯基乙醇诱导各组细胞,观察microRNA-9在小鼠MSCs横向分化为神经细胞中作用。
材 料 和 方 法
1动物
SPF级BALB/c小鼠,雌雄不限,6-8周龄,18-20 g,由河南省实验动物中心提供,许可证号:SCXK(豫)2005-0001。MSCs由小鼠股骨中分离提取,连续传10代以上。293T细胞和大肠杆菌菌株DH5α由郑州大学生物化学教研室惠赠。
2主要试剂
XbaI、HpaI及T4 DNA ligase购自NEB;RNA干扰载体pFU-GW-RNAi和病毒包装三质粒:pGC-LV 重组载体(同时可表达绿色荧光蛋白)和pHelper 1.0和pHelper 2.0均购自上海吉凯基因化学有限公司;感染试剂Lipofectamine 2000 购自Invitrogen;DMEM液体培养基和胎牛血清购自Gibco;神经元烯醇化酶(neuron-specific enolase, NSE H-300,sc-15343)、神经微管结合蛋白(microtubulin-associated protein 2, MAP-2,sc-20172)和胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP H-50,sc-9065)兔抗多克隆抗体购自Santa Cruz;Cy3标记山羊抗兔IgG(H+L)购自上海碧云天公司;RNeasy Mini试剂盒和OneStep RT-PCR试剂盒均为Qiagen产品;凝聚胺、多聚赖氨酸和噻唑蓝(MTT)购自Sigma;其它生化试剂均为进口分装或国产分析纯。所用引物由上海吉凯基因技术有限公司根据设计合成,见表1。
3主要方法
3.1MicroRNA-9-1慢病毒载体的构建 根据miRBase数据库获得microRNA-9-1(MI0000720)的序列,设计合适的引物序列, PCR方法合成含双链DNA oligo,其两端含酶切位点黏端。将pFU-GW-RNAi载体XbaⅠ和HpaⅠ双酶切后,在T4 DNA连接酶作用下,与双链DNA oligo于4 ℃ 12 h连接反应制备克隆连接液,转化大肠杆菌感受态细胞后进行阳性克隆PCR鉴定。脂质体介导的瞬时感染方法进行慢病毒颗粒的包装。感染前24 h,调整细胞293T 细胞密度为6×108cells/L,重新接种于15 cm2细胞培养皿,37 ℃、5% CO2培养箱内培养。待细胞密度达70%-80%时即可感染。DNA溶液(pGC-LV载体20 μg ,pHelper 1.0载体15 μg,pHelper 2.0载体10 μg),与相应体积的Opti-MEM混合均匀,调整总体积为2.5 mL,加入离心管中,室温下温育5 min。取100 μL Lipofectamine 2000 试剂在另一离心管中与2.4 mL Opti-MEM混合,室温下温育5 min。然后将分别含有DNA和脂质体溶液混合,轻柔混匀,室温下温育20 min。将DNA与Lipofectamine 2000 混合液转移至293T细胞的培养液中,混匀,于37 ℃、5%CO2细胞培养箱中培养。培养8 h后倒去含有感染混和物的培养基,每瓶细胞加入20 mL的PBS液,轻轻左右晃动培养瓶以洗涤残余的感染混和物,然后倒去。每瓶细胞中加入含10% 血清的细胞培养基25 mL,于37 ℃、5% CO2培养箱内继续培养48 h。收集感染后48 h的293T细胞上清液。于4 ℃、4 000×g离心10 min,除去细胞碎片。0.45 μm滤器过滤上清液于40 mL 超速离心管中,再离心浓缩病毒液至所需浓度。收集病毒液,分装后-80 ℃长期保存。取其中1支用孔稀释法进行病毒滴度测定。同样方法制备仅含GFP报告基因的阴性对照慢病毒载体。
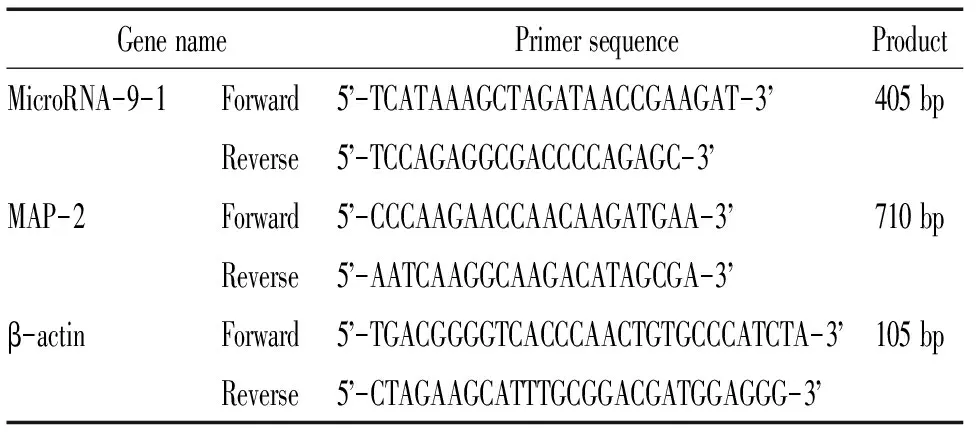
表1 引物序列
3.2感染复数(multiply of infection,MOI)值测定 取培养10代以上的小鼠MSCs,以2×109cells/L的密度接种至24孔板,培养2 d至细胞融合度达到30%-50%。分为5个不同梯度的MOI值。在完全培养基中加入含有microRNA-9-1和GFP(绿色荧光报告基因)的慢病毒载体上清,对照组B组加入仅含GFP的阴性对照慢病毒载体上清,两组均加上终浓度为5 mg/L的凝聚胺(polybrene)。共感染24 h, 换新鲜培养基。感染后每天倒置荧光显微镜下观察各组细胞GFP表达情况,并计数GFP阳性细胞的百分比。
3.3小鼠MSCs感染及实验分组 取microRNA-9-1-LV以最适MOI值感染小鼠MSCs,同时,取同一MOI值的FU-RNAi-NC-LV感染阴性对照组置于37 ℃、5% CO2培养箱内孵育,孵育24-72 h。根据感染情况将同时点的MSCs细胞分为3组:未感染组:不进行感染,其它培养条件同各感染组;感染组:感染microRNA-9-1-LV,即含有microRNA-9-1病毒和GFP;阴性对照组:感染FU-RNAi-NC-LV,即只含有GFP。在倒置荧光显微镜下观察感染后24 h、48 h、72 h、96 h GFP荧光表达情况,评价细胞感染效率。
3.4体外诱导MSCs分化为神经细胞 取各组细胞进行诱导实验。去除DMEM完全培养基,D-Hank’s液清洗3次,加入预诱导液(DMEM培养基+10%胎牛血清+1 mmol/L β-巯基乙醇)置于37 ℃、5% CO2条件下培养24 h。预诱导后,加入诱导液(DMEM培养基,5 mmol/L β-巯基乙醇),37 ℃、5% CO2条件下培养5 h。
3.5MTT比色法 将感染microRNA-9-1-LV和FU-RNAi-NC-LV前后各时点的MSCs移入96孔培养板,加入MTT(5.0 g/L)50 μL/well、置入培养箱孵育4 h,离心弃上清,加入二甲基亚砜200 μL,采用酶联免疫检测仪测定各孔吸光度值,评价细胞存活率。
3.6免疫细胞化学染色法 将各组细胞用PBS清洗之后,迅速经4%多聚甲醛的固定液中于4 ℃固定过夜,0.2% Triton X-100处理10 min,并用封闭液封闭1 h。然后分别用NSE抗体(1.0 mg/L)、MAP-2抗体(1.0 mg/L)和GFAP抗体(1.0 mg/L)4 ℃孵育 24 h。用PBS 洗3遍后,用Cy3标记山羊抗兔IgG(1∶500)在室温下进行染色标记、观察。细胞图像通过显微镜用 ×10或 ×20摄取。每组独立的实验都会采集超过30个区域的细胞。而且,在明视野下所采集的每幅图像都尽量包含相同的细胞数目。应用ImagePro Plus 6.0专业图像分析软件分析各实验组的荧光图片单个细胞的累积吸光度值,进行统计学分析。
3.7RT-PCR 采用RNeasy Mini试剂盒分离纯化各组细胞的总RNA,分光光度法测定计算提取的总RNA含量及浓度。参照OneStep RT-PCR试剂盒实验操作说明进行RT-PCR,总反应体积50.0 μL,其中5×OneStep RT-PCR buffer 10.0 μL,dNTP Mix 2.0 μL,OneStep RT-PCR Enzyme Mix 2.0 μL,5×Q-solution 10.0 μL, RNase inhibitor 10U, RNA1.0 μg,引物 0.6 μmol/L。扩增条件为:50 ℃逆转录30 min, 95 ℃ 15 min, 94℃ 1 min, 55 ℃ 1 min,72 ℃ 1 min, 30-35个循环, 72 ℃ 10 min。然后,取RT-PCR产物10.0 μL,加上样缓冲液2.0 μL,在2%琼脂糖凝胶上电泳,70 V 40 min,凝胶图像成像系统拍摄保存实验结果,凝胶图像分析系统(GelPro Analyzer 3.0)分析各目的基因与β-actin基因条带吸光度值。
4统计学处理
结 果
1miRNA-9-1慢病毒载体的构建
pFU-GW-RNAi载体经HpaⅠ 和XhoⅠ酶切后,琼脂糖凝胶电泳显示载体中位于两酶切位点间的原有片段被分离, 载体被切割成线性,见图1。挑选阳性克隆送测序,阳性克隆测序结果,见图1。证明大鼠miRNA-9-1慢病毒载体构建成功。慢病毒载体系统的3 个质粒pGC-LV、pHelper 1.0和pHelper 2.0按一定比例共感染293T 细胞,收集感染后48 h的293T细胞上清液,进行离心浓缩。取浓缩的病毒液用孔稀释法进行病毒滴度测定,T=1×1012TU/L(TU, transduction unit)。

Figure 1. PCR results for constructed microRNA-9-1-LV vector. A: enzyme-digested product. 1: marker; 2: the pFU-GW-RNAi plamsid without digested; 3: The pFU-GW-RNAi plamsid digested by XbaⅠ and HpaⅠ. B: PCR for cloned target gene. 1:the group with ddH2O; 2:the group with empty vector; 3:the group with GAPDH; 4: marker; 5-12:the groups with transformants of microRNA-9-1.
2MicroRNA-9-1慢病毒感染
本研究采用含有绿色荧光报告基因(GFP)标记的病毒载体观察、评估感染效率。倒置荧光显微镜观察感染24 h,可以观察到部分绿色荧光,感染4 d时GFP表达最理想,感染组和阴性对照组GFP感染率没有明显差异,见图2、表2。
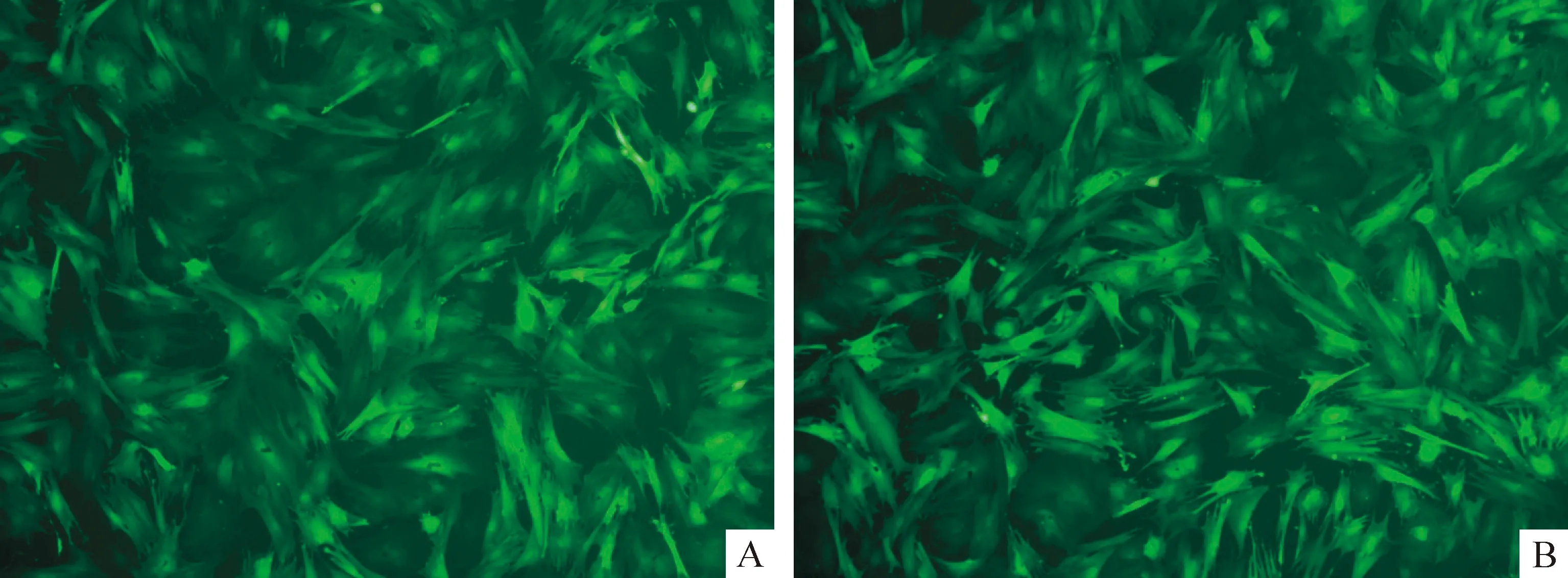
Figure 2. The cell infection rate(48 h after transfection, ×200). A: transfected group; B: negative control group.
表2 细胞感染率
3MTT结果
感染前各组MSCs的MTT结果无显著差异(P>0.05);感染24 h,感染组MTT值显著下降,与各对照组MTT比较均有显著差异(P<0.05),各对照组之间无显著差异。感染48 h、72 h、96 h后MTT值虽较24 h有所上升(P<0.05),但与其它组MTT比较仍有显著差异(P<0.05),见表3。
4β-巯基乙醇体外诱导MSCs分化为神经细胞
未感染组MSCs诱导5 h,部分细胞出现神经细胞改变,胞体收缩呈多角形或圆形,突起细长,有数个分支,部分在局部形成网络。感染microRNA-9-1-LV组诱导后,细胞形态变化更为迅速和显著,诱导5 h多数细胞胞体收缩呈圆形、锥形,细胞突起细长,交织成网,形成较典型的神经细胞结构,少量细胞脱落、死亡。阴性对照组和未感染组类似,见图3。
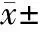
表3 MSCs MTT 结果

Figure 3. β-ME induced MSCs into neurons(×200). A: transfected group; B: negative control group.
5免疫细胞化学染色法
感染组诱导5 h,NSE和MAP-2的表达率分别为 87.2%±2.0%和85.5%±0.8%,显著高于其它各组(P<0.05)。各组GFAP表达率均小于1%,无显著差异,见图4、表4。
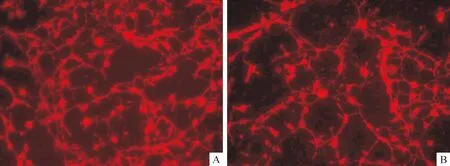
Figure 4. Expression of MAP-2 in β-ME-induced differentiation of MSCs into neurons(5h after induction, ×200). A:transfected group; B: negative control group.
表4 β-巯基乙醇诱导5 h各组细胞免疫化学染色结果
6RT-PCR结果
3组分别诱导分化5 h均表达MAP-2 mRNA,未转然组和阴性对照组比无显著差异,感染microRNA-9-1组表达MAP-2 mRNA较前2组明显增高,差异显著,见图5、6。
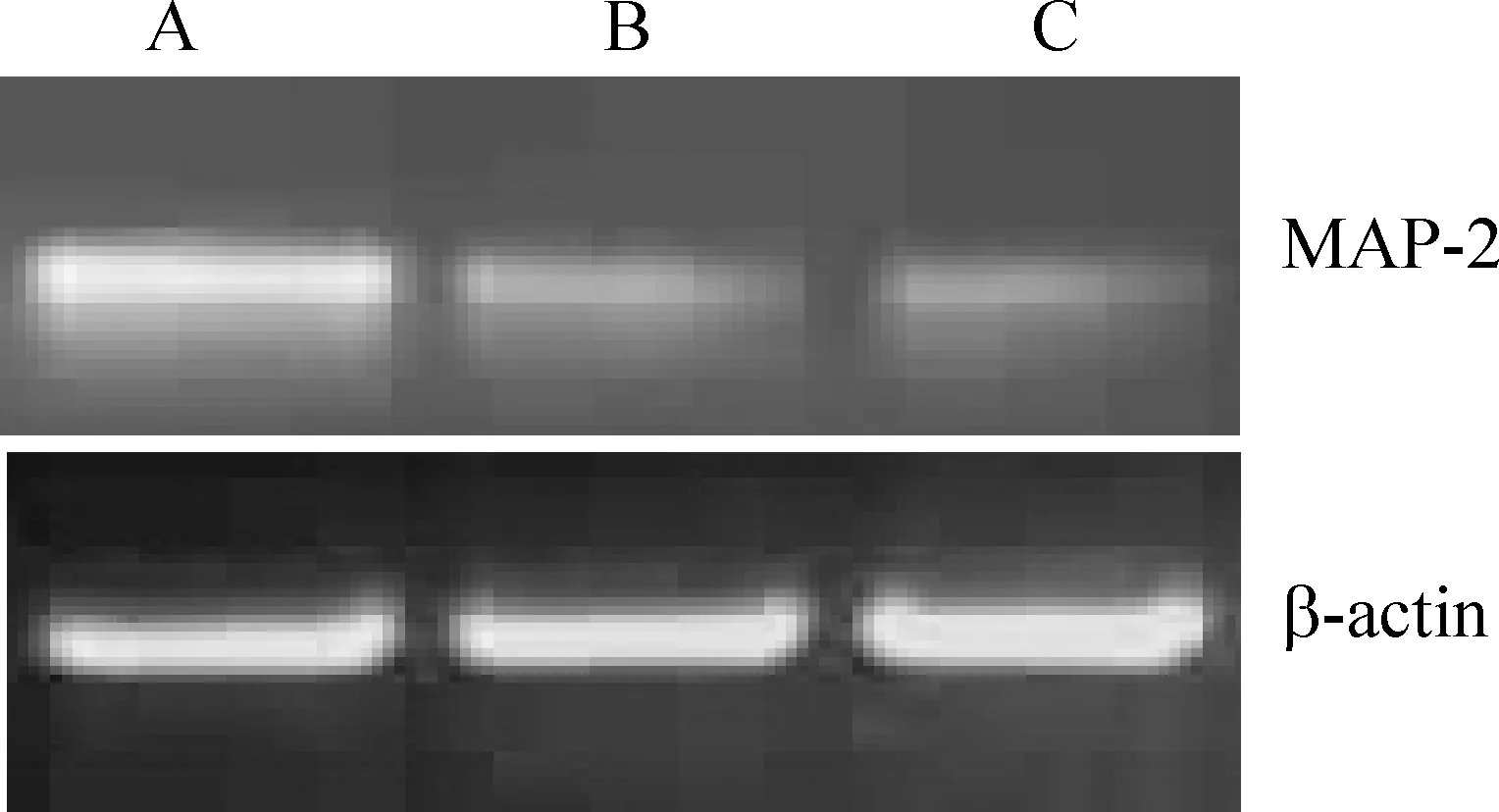
Figure 5. The RT-PCR for MAP-2. A: transfected group;B: negative control group; C: non-transfected group.
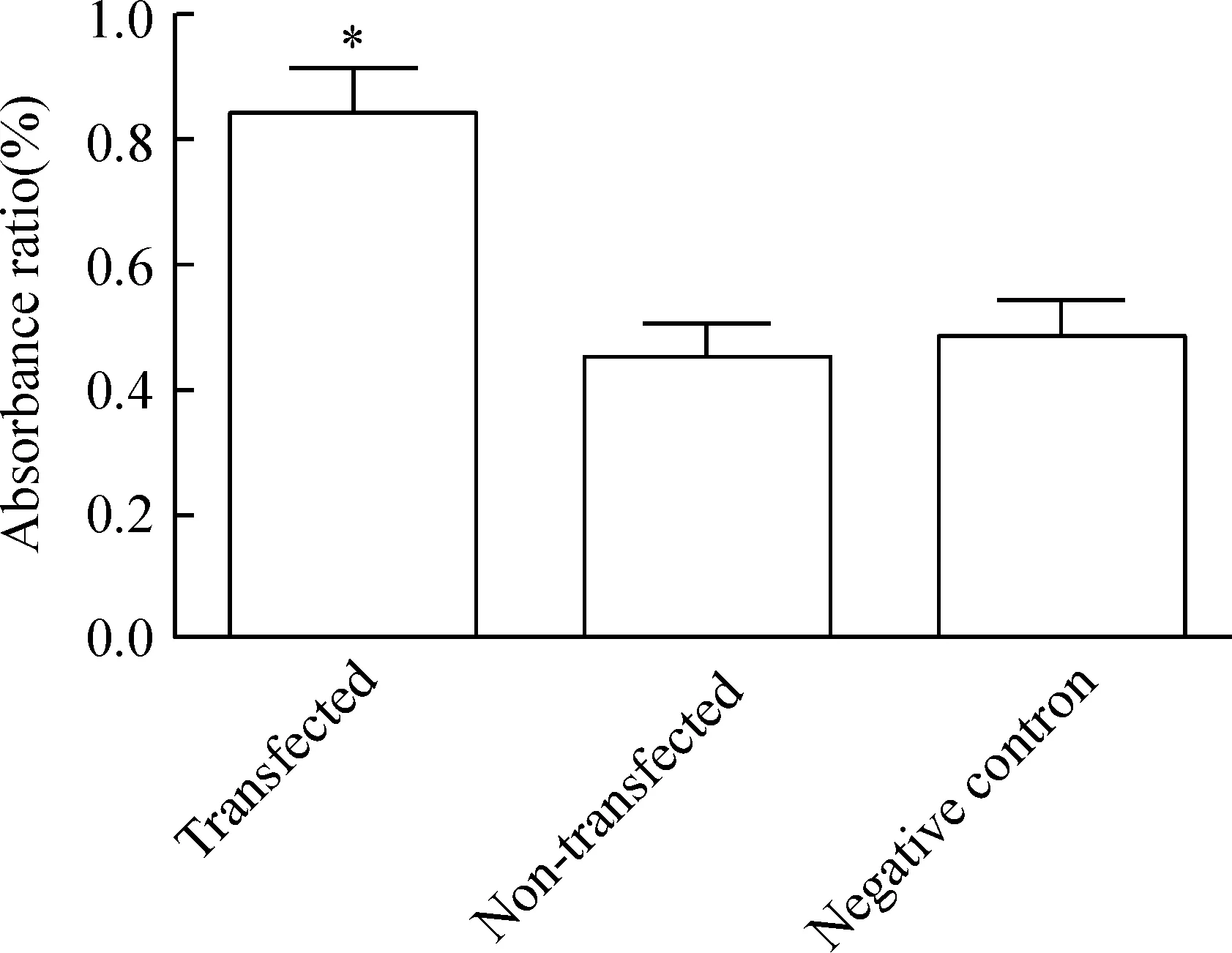
Figure 6. MAP-2 mRNA expression.s.n=15.*P<0.05 vs other groups.
讨 论
1慢病毒载体感染技术
慢病毒基因转导载体包容量大,能够感染任何类型神经细胞,其携带的目的基因可整合到宿主细胞基因组使外源基因获得长期稳定表达,且不编码病毒蛋白,在中枢神经系统中也不会引起免疫反应[5]。在人和小鼠脑组织中成熟的microRNA-9有3种不同形式,microRNA-9-1、-9-2和-9-3,其原始转录本分别位于3、13、7号染色体上。通过用维甲酸处理小鼠P19细胞发现,microRNA-9-1在诱导后有明显变化,经历急剧上升至迅速下降过程,且处理后神经特异性标志物MAP-2逐渐上升,提示microRNA-9-1在神经分化中起着重要调控作用和生物指示作用[6]。
据此本研究采用三质粒表达系统即pGC-LV载体、pHelper 1.0载体和pHelper 2.0载体来构建慢病毒载体,建立microRNA-9-1增强体外模型,并探讨其在MSCs诱导分化为神经细胞中的作用提供依据。
2MicroRNA-9在MSCs向神经细胞分化中的作用
MicroRNA可以作为发育开关以及微调发育程序来调控生物体内多种发育过程[7]。MicroRNA-9是脑组织特异表达的一种小RNA,它在小鼠胚胎干细胞和肿瘤细胞的分化中起重要调控作用[8]。研究发现,microRNA-9在神经干细胞向神经元分化过程中起重要调控作用[9],通过影响转录激活因子STAT3信号通路来促进神经分化[5],通过Fgf信号通路调控中脑后脑交接区(midbrain-hindbrain boundary,MHB)的组织活性[10]。 Krichevsky等[4]研究发现在胚胎发育的第5阶段microRNA-9/9*表达较高,此阶段是神经元前体向神经元和胶质细胞分化的关键时期,抑制神经前体细胞中microRNA-9表达可使神经元数量减少29%-31%。MicroRNA-9调控着由胚胎干细胞衍生来的神经祖细胞的增殖和迁移,由其直接调控的一个靶基因可以编码一种19 kD的磷酸蛋白stathmin,该蛋白特异性在神经祖细胞上表达,可以增加微观的不稳定性,从而促进细胞定向迁移[11,12]。本研究发现感染microRNA-9-1慢病毒载体的MSCs向神经细胞分化效率增加,考虑可能和microRNA-9的上述作用有关。
MSCs是一种成体干细胞,可以向骨、软骨、脂肪等多种组织分化,研究发现还可以向神经细胞分化[13、14]。与神经干细胞定向分化所不同,MSCs分化为神经细胞是一种横向分化方式,其调控因子目前了解较少。Greco等[3]发现在人MSCs分化为神经细胞过程中,microRNA在其中起着重要调控作用。但与神经干细胞分化机制是否相同,microRNA-9是否参与分化过程尚未见报道。本研究首次采用感染microRNA-9-1慢病毒载体,构建microRNA-9-1增强模型,观察其在MSCs诱导分化中的作用。本研究发现,microRNA-9-1慢病毒载体可高效感染小鼠MSCs,感染后报告基因GFP可稳定表达。本研究MTT结果发现,感染microRNA-9-1慢病毒后,MSCs存活率下降,但感染仅含有报告基因的慢病毒载体后MSCs存活率变化不大,表明microRNA-9在MSCs保持细胞自我更新、分裂、凋亡等生理功能中起到一定作用。
本研究发现,与未感染和感染仅含有GFP的慢病毒的MSCs相比感染microRNA-9-1慢病毒后,MSCs向神经细胞分化效率显著提高,神经细胞早、中期标志物NSE和成熟神经细胞特异性标志物MAP-2表达均明显增高,且未见GFAP表达。这提示microRNA-9-1可能在MSCs横向分化神经细胞中起作用,提高microRNA-9-1的表达,可以促进MSCs向神经细胞分化。发现单独感染microRNA-9-1慢病毒并不能使MSCs向神经细胞分化,还必须在诱导剂(巯基乙醇等)的作用下才能分化。这说明microRNA-9-1在MSCs在横向分化为神经细胞过程中不是唯一的,可能是对一些信号途径调控,如Notch信号途径[15],从而提高诱导效率。但是具体机制尚不明确。
综上所述,本研究采用慢病毒感染技术,建立microRNA-9-1过表达细胞模型,从而促进MSCs向神经细胞的分化效率,提示microRNA-9-1在MSCs诱导分化为神经细胞过程中可能起促进作用。
[1] Lagos-Quintana M, Rauhut R, Yalcin A, et al. Identification of tissue-specific microRNAs from mouse[J]. Curr Biol, 2002, 12(9):735-739.
[2] 原清涛,邓宇斌,李树浓.骨髓间质干细胞诱导分化为神经元及其应用的研究进展[J]. 中国病理生理杂志,2004,20(11):2139-2142.
[3] Greco SJ, Rameshwar P. MicroRNAs regulate synthesis of the neurotransmitter substance P in human mesenchymal stem cell-derived neuronal cells[J]. Proc Natl Acad Sci USA, 2007, 104(39):15484-15489.
[4] Krichevsky AM, Sonntaq KC, Isacson O, et al. Specific microRNAs modulate embryonic stem cell-derived neurogenesis[J]. Stem Cells, 2006, 24(4):857-864.
[5] Simmons A, Whitehead RP, Kolokoltsov AA, et al. Use of recombinant lentivirus pseudotyped with vesicular stomatitis virus glycoprotein G for efficient generation of human anti-cancer chimeric T cells by transduction of human peripheral blood lymphocytesinvitro[J]. Virol J, 2006, 3:8.
[6] Ko MH, Kim S, Hwang do W, et al. Bioimaging of the unbalanced expression of microRNA9 and microRNA9*during the neuronal differentiation of P19 cells[J]. FEBS J, 2008, 275(10):2605-2616.
[7] Krol J, Loedige I, Filipowicz W. The widespread regulation of microRNA biogenesis, function and decay [J]. Nat Rev Genet, 2010, 11(9):597-610.
[8] Delaloy C,Gao FB. microRNA-9 multitasking near organizing centers[J]. Nat Neurosci, 2008, 11(6):625-626.
[9] Conaco C, Otto S, Han JJ, et al. Reciprocal actions of REST and a microRNA promote neuronal identity[J]. Proc Natl Acad Sci USA, 2006, 103(7):2422-2427.
[10]Leucht C, Stiqloher C, Wizenmann A, et al. MicroRNA-9 directs late organizer activity of the midbrain-hindbrain boundary[J]. Nat Neurosci, 2008, 11(6):641-648.
[11]Delaloy C, Liu L,Lee JA, et al. MicroRNA-9 coordinates proliferation and migration of human embryonic stem cell-derived neural progenitors[J]. Cell Stem Cell, 2010, 6(4):323-335.
[12]Nobuko U.MicroRNA-9 controls a migratory mechanism in human neural progenitor cells[J]. Cell Stem Cell, 2010, 6(4):294-296.
[13]Cho KJ, Trzaska KA, Greco SJ, et al.Neurons derived from human mesenchymal stem cells show synaptic transmission and can be induced to produce the neurotransmitter substance P by interleukin-1 alpha[J]. Stem cells, 2005, 23(3):383-391.
[14]施雪英,陈先文,胡慧敏,等.三七总皂甙和维甲酸联合诱导大鼠MSCs分化为神经元样细胞[J]. 中国病理生理杂志,2007,23(3):612-613、624.
[15]Wang Z, Li Y, Kong D, et al. Cross-talk between miRNA and Notch signaling pathways in tumor development and progression[J]. Cancer Lett, 2010, 292(2):141-148.
EffectoflentiviralvectorofmicroRNA-9-1ondifferentiationofmousebonemarrowmesenchymalstemcellsintoneurons
JING Li-jun, JIA Yong-lin, LU Jing-jing, HAN Rui, WANG Shu-yang, LI Jin-yi, PENG Tao, JIA Yan-jie
(DepartmentofNeurology,TheFirstAffiliatedHospital,ZhengzhouUniversity,Zhengzhou450052,China.E-mail:jiayanjie1971@yahoo.com.cn)
AIM: To investigate the role of microRNA-9 in inducing bone marrow mesenchymal stem cell(MSCs) differentiation into neurons.METHODSThe lentiviral vector of microRNA-9-1(microRNA-9-1-LV) was constructed and transfected into mouse MSCs. The cells were divided into non-transfected group, transfected group(transfected with microRNA-9-1-LV) and negative control group(transfected with FU-RNAi-NC-LV). MSCs were treated with β-mercaptoethanol(β-ME) as an inducer for triggering the cells to differentiate into neurons. The fluorescence expressed by transfected MSCs were observed under inverted fluorescence microscope. The mRNA expression of microtublin-associated protein 2(MAP-2) was detected by RT-PCR. The expression of neuron-specific markers,neuron-specific enolase(NSE), MAP-2 and glial fibrillary acidic protein(GFAP), were measured by immunocytochemical method. The viability of MSCs was determined by MTT method.RESULTSThe results of PCR confirmed successful construction of mouse microRNA-9-1-LV. The virus titer was 1×1012TU/L(TU, transduction unit). The best transfection efficiency(up to 91.3%±4.2%) and survival rate appeared when multiply of infection(MOI)was 20 and on 4th day. β-ME induced MSCs to differentiate into neurons and the best efficiency of the induction was observed in transfected group. The expression levels of NSE and MAP-2 in transfected cells were higher than those in the cells of other group(P<0.05).CONCLUSIONMicroRNA-9-1-LV has high transfection efficiency in mouse MSCs. Higher differentiation rate from mouse MSCs to neurons is induced by β-ME after the cells are transfected with microRNA-9-1-LV.
MicroRNA-9-1; Marrow mesenchymal stem cells; Neurons; Lentivirus
R329.21
A
10.3969/j.issn.1000-4718.2011.02-022
1000-4718(2011)02-0326-06
2010-09-07
2010-11-09
国家自然科学基金资助项目(No.30770758);河南省教育厅自然科学研究计划资助项目(No.2008A320032)
△通讯作者 Tel:0371-66295112; E-mail:jiayanjie1971@yahoo.com.cn
