外源性EGR1瞬时表达对骨肉瘤细胞细胞周期和凋亡的影响*
2011-11-22张惠华郭淑军段飞蝶陈友鹏梁旭竞陈小佳
秦 丽, 张惠华, 郭淑军, 段飞蝶, 陈友鹏, 梁旭竞, 陈小佳△
(1暨南大学生物工程研究所,基因工程药物国家工程研究中心,广东省生物工程药物重点实验室; 2暨南大学附属第一医院感染科,广东 广州 510632)
外源性EGR1瞬时表达对骨肉瘤细胞细胞周期和凋亡的影响*
秦 丽1, 张惠华1, 郭淑军1, 段飞蝶1, 陈友鹏2, 梁旭竞2, 陈小佳1△
(1暨南大学生物工程研究所,基因工程药物国家工程研究中心,广东省生物工程药物重点实验室;2暨南大学附属第一医院感染科,广东 广州 510632)
目的获得人早期生长反应1(EGR1)基因,并在人骨肉瘤细胞中瞬时表达,研究该基因在人骨肉瘤细胞中的作用,并探讨其可能的作用机制。方法以人胎盘组织为模板,巢式PCR(nest PCR)扩增获得EGR1全长基因,克隆入真核表达载体pcDNA3.1(-),酶切、PCR鉴定并测序正确后,命名为pcDNA-EGR1。脂质体法将重组载体转染人骨肉瘤细胞U2OS,实时荧光定量PCR(qPCR)和免疫印迹检测目的基因的表达; MTT法检测细胞生长和增殖情况;流式细胞仪和DAPI染色检测细胞的周期变化和凋亡情况;qPCR检测细胞中与细胞周期、凋亡相关基因的表达变化情况;短发夹RNA(shRNA)干扰EGR1后,检测细胞的变化情况。结果成功获得了人EGR1基因并构建了其重组表达载体pcDNA-EGR1。EGR1可有效地在U2OS中瞬时表达;可显著抑制细胞增殖(P<0.05),并呈一定的剂量依赖。EGR1可引起细胞周期停滞于G0/G1期,并促进凋亡率增加(P<0.05)。EGR1可引起细胞核出现明显的固缩和凋亡表型。EGR1可引起周期相关基因表达下调,凋亡相关基因表达则显著上调。shRNA干扰EGR1后,细胞凋亡表型和EGR1所调控的相关基因表达水平与对照组一致。结论EGR1具有抑制骨肉瘤细胞增殖作用,能调节骨肉瘤细胞周期和凋亡相关基因的表达,从而促进细胞周期停滞和凋亡率的增加。
基因,早期生长反应; 瞬时表达; 骨肉瘤细胞; 生长抑制
早期生长反应1(early growth response 1, EGR1)蛋白是一个重要的核转录因子,又称为神经生长因子诱导蛋白1(nerve growth factor-induced protein A,NGFI-A)、锌指蛋白268(zinc finger protein 268,Zif268)、锌指蛋白225(zinc finger protein 225,Zif225)和Krox-24蛋白。其基因EGR1为早期生长反应基因家族(EGR family)重要成员,编码59 kD的核磷蛋白,最早被发现是因其能被丝裂原和分化因子诱导[1],无外界刺激时,EGR1在大多数组织中表达量都很低。EGR1含有1个高度保守的DNA结合域,该结合域由3个锌指结构构成,它能与富含GC的序列GCGC(G/T)GGGCG结合[2];同时EGR1含有1个核定位信号,2个激活域和1个抑制域,有利于其调控目的基因的表达[3]。
EGR1在不同细胞类型或刺激下,有多方面作用,包括分化、生长、生长抑制和凋亡,它可结合到目的基因DNA上起到激活转录作用[4]。有研究表明[5],EGR1 能逆转HT1080 纤维肉瘤细胞、ZR27521乳腺癌等细胞的恶性表型,并抑制这些细胞的转化性生长和在裸鼠体内的致瘤性;郝淼旺等[6]也报道外源表达EGR1对某些肝癌及食管癌细胞生长具有抑制作用。然而,在前列腺癌等一些癌症中,EGR1表达却是上调的,这表明它具有原癌性。相继有报道指出,EGR1具有促进前列腺癌进行的作用[7]。这表明EGR1并不是一个纯粹的肿瘤抑制子,而是具有肿瘤抑制和促进双重生物学作用。鉴于此,将其作为一个安全的癌治疗靶标之前,必须对其作用全面了解,并深入研究相关机制。
EGR1的抑癌机制在乳腺癌、卵巢癌等癌症中研究较多[4],而在人骨肉瘤U2OS中的生物学功能尚未见深入报道[8],本文构建真核表达载体将EGR1转入U2OS中,采用MTT[3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐,3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide]、FCM(流式细胞术,flow cytometry,又名FACS)、DAPI(4’,6-二脒基-2-苯基吲哚,4’,6-diamidino-2-phenylindole)染色、qPCR(实时荧光定量PCR,real-time quantitative PCR)和RNAi(RNA干扰,RNA interference)实验等方法检测EGR1对细胞增殖、细胞周期和凋亡等方面的影响,为进一步研究EGR1在骨肉瘤中的抑癌机制奠定基础。
材 料 和 方 法
1材料
1.1菌株、质粒和细胞 DH5α菌株和pcDNA 3.1(-)质粒均购自日本TaKaRa公司;U2OS细胞购自美国ATCC。
1.2主要试剂 Trizol试剂、SYBR green real-time PCR mix和MTT分别购自Invitrogen、Toyobo和Sigma;ECL发光液和逆转录酶MLV分别购自Pierce和Promega;内切酶EcoRⅠ、HindⅢ购自NEB;Primer Star和T4 ligase购自TaKaRa;质粒提取试剂盒、胶回收试剂盒及无内毒素质粒小量提取试剂盒购买于Omega;LipofectamineTM2000脂质体转染试剂购自Invitrogen;细胞周期和凋亡检测试剂购自碧云天;抗体购自CST。
1.3引物的设计和合成 根据GenBank(NM_001964.2)收录的EGR1 cDNA全长序列,利用生物软件Primer Primer 5.0设计巢式PCR特异性引物, 外侧引物序列如下:上游引物5′-ACACCAGCTCTCCAGCCTGCTCGTC-3′,下游引物5′-CTCCTCCTGTCCTTTAAGTCTCTTG-3′,扩增长度1 727 bp;内侧:上游引物5′-ATGCGAATTCGCTAGCGCCGCCACCATGGCCGCGGCCAAGGCCGAGAT-3′(含EcoRⅠ酶切位点和Kozak序列),下游引物5′-ATGCAAGCTTTTAAGCGTAATCTGGAACATCGTATGGGT-AGCAAATTTCAATTGTCCT-3′(含HindⅢ酶切位点和HA标签),扩增长度1 697 bp。
根据GenBank(NM_001964.2)收录的EGR1 cDNA全长序列,由上海吉玛公司设计合成的EGR1 shRNA序列为EGR-1(601):正义链5′-r(CAACGAGAAGGUGCUGGU G)d(TT)-3′,反义链5′-r(CACCAGCACCUUCUCGUUG)d(TT)-3′,此序列克隆入PGPU6/GFP/Neo载体,命名为sh601。
2方法
2.1模板制备 取冷冻的人胎盘组织,加入适量的Trizol,酚仿法提取组织RNA,经RT-PCR得到cDNA。
2.2构建EGR1真核表达载体 采用巢式PCR扩增EGR1全长cDNA,按PrimerStar PCR系统说明书操作。扩增产物回收、纯化后进行EcoRⅠ/HindⅢ双酶切,产物纯化后,与同样处理的pcDNA3.1(-)载体连接过夜,转化DH5α,涂板,37 ℃,培养15 h,挑取单客隆,于LB-AMP+中扩增,抽提质粒,经酶切和PCR扩增目的序列2种方法鉴定,获得的重组子命名为pcDNA-EGR1。
2.3脂质体法转染人骨肉瘤细胞U2OS 对数生长期的U2OS细胞计数后,按1×106cells/well,种于6孔板内,待细胞融合度为70%时,进行质粒转染。以转染pcDNA 3.1-EGR1(以下简称pEGR1)和shRNA(以下简称pEGR1+sh601)为实验组,转染pcDNA 3.1(-)空载(以下简称pV)为对照组,按每孔4μg DNA(shRNA∶DNA =4∶1),用5μL LipofectamineTM2000介导转染细胞,48 h后,收集细胞。具体转染步骤按LipofectamineTM2000试剂操作说明。
2.4qPCR和Western blotting检测目的基因表达 转染48 h后,用适量Trizol裂解细胞,酚仿法抽提RNA。设计跨内含子引物,qPCR检测目的基因表达情况。引物序列如下:EGR1-正义链5′-GCAGCAGCAGCACCTTCAAC-3′,EGR1-反义链5′-TCTCGTT GTTCAGAGAGATG-3′。
转染48 h后,裂解细胞,收集裂解液,蛋白定量,12%SDS-PAGE电泳分离,进行常规的Western blotting实验。
2.5质粒转染U2OS细胞后的MTT法分析 对数生长期的U2OS细胞计数后,按1×104cells/well,种于96孔板内,待细胞融合度为70%时,进行质粒转染。设计pV组、分别以50 ng/well、133 ng/well、250 ng/well转染pEGR1质粒的过表达组,按每孔0.25 μL LipofectamineTM2000的转染试剂转染细胞,48 h后,弃培养基,加MTT液50 μL培养4 h。甩干孔内培养液后,加100 μL异丙醇振荡10 min。酶标仪检测各孔A值(检测波长570 nm,参考波长630 nm)。计算细胞的增殖率=各EGR1过表达组平均A/对照组(pV组)平均A×100%。
2.6流式细胞仪和DAPI染色检测质粒转染后U2OS细胞的细胞周期和凋亡 按2.3方法,转染48 h后收集细胞,常规固定处理,PI染色, 筛网过滤细胞悬液后,在流式细胞仪上进行细胞周期分析。按2.3方法,转染48 h后收集细胞,常规固定处理,DAPI染色20 min,荧光显微镜下观察细胞核状态。
2.7qPCR检测EGR1过表达和shRNA干扰EGR1后U2OS细胞内相关基因的表达 按2.3方法,得到cDNA后,qPCR检测相关基因表达情况。引物序列见表1。

表1 细胞周期和凋亡相关基因的QPCR引物序列
3统计学处理
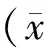
结 果
1EGR1基因的克隆及真核表达载体的构建
以人胎盘组织提取的总RNA逆转录产物为模板,经巢式PCR扩增得到外引和内引产物分别为1 727 bp和1 697 bp的cDNA片段,见图1A。扩增产物经双酶切、纯化后,将其克隆到pcDNA3.1(-)EcoR Ⅰ/HindⅢ酶切位点得到pcDNA-EGR1重组质粒(以下简称pEGR1),重组子酶切和PCR产物经电泳分析,各泳道片段大小均与理论值相符,鉴定为重组表达载体,见图1B。测序结果与NCBI一致。该序列3′端加了HA标签,以便区分内、外源EGR1蛋白。
2qPCR和Westernblotting检测外源目的基因表达
首先对引物扩增特异性进行检测,分析熔解曲线和定量曲线,如图2A、B所示,扩增产物有单一峰,且pV组与pEGR1组的峰形一致,表示该引物特异性扩增EGR1基因。qPCR检测目的基因EGR1 mRNA在实验组细胞中的表达量是空载组的3 036倍,见图2C。Western bloting结果显示,pEGR1组中EGR1蛋白表达量较空载组高,见图3。

Figure 1. Identification of human EGR1 cDNA and recombinant plasmid pcDNA-EGR1.(A):M:DL2000 DNA marker; 1,2: amplification production of EGR1 cDNA outside primer and inside primer→respectively.(B):M:5 000 bp DNA marker; 1-4:empty vector plasmid and pEGR1 plasmid without or with restriction enzyme digestion, respectively;5:amplification production of pEGR1 plasmid.
3EGR1过表达对U2OS细胞增殖、细胞周期和细胞状态的影响
MTT结果显示(图4),pV组和低剂量pEGR1组的增殖率不存在显著差异(P>0.05);而高、中剂量组细胞的增殖率均有显著差异(P<0.05),并且pEGR1高剂量组的增殖率显著低于中剂量组(P<0.05)。
流式细胞结果(图5A)表明,pEGR1组G0/G1期细胞比例显著增加(P<0.05);S期和G2/M期细胞比例则显著减少(P<0.05)。 EGR1显著增加了细胞凋亡率(P<0.05),见图5B。
DAPI染色结果表明,与pV组相比,pEGR1组中细胞核出现明显的固缩,且有核破裂现象;pEGR1+sh601组中有GFP出现的细胞中,细胞核的凋亡特征消失,见图6。
4EGR1对U2OS细胞内基因表达的影响
设计相关基因的特异性引物(表1),qPCR检测其表达变化情况。结果显示(图7),EGR1过表达时,与对照相比,PTEN、p53等明显上调(P<0.01);CDC2、CDK2等细胞周期相关基因则显著下调(P<0.05);凋亡相关基因家族成员caspase-6、caspase-9、caspasee-10显著上调(P<0.05),抗凋亡基因bcl-2的表达无显著差异(P>0.05)。与对照相比,shRNA干扰EGR1后,相关基因表达水平恢复到与pV组相似水平。

Figure 2. The transcription levels of EGR1 in U2OS cells transfected with pEGR1 or pV.EGR1 mRNA levels were determined by qPCR. U2OS cells were transfected with pEGR1 or pV plasmids for 48 h,then the mRNA levels were compared. A: solubility curve;B: quantitation curve analysis;C:EGR1 relative expression level.±s.n=3 **P<0.01 vs pV.

Figure 3. The EGR1 expression levels in U2OS cells transfected with pEGR1 or pV. EGR1 protein levels were determined by Western blotting. U2OS cells were transfected with pEGR1 or pV plasmids after 48 h, then the expression levels were compared.
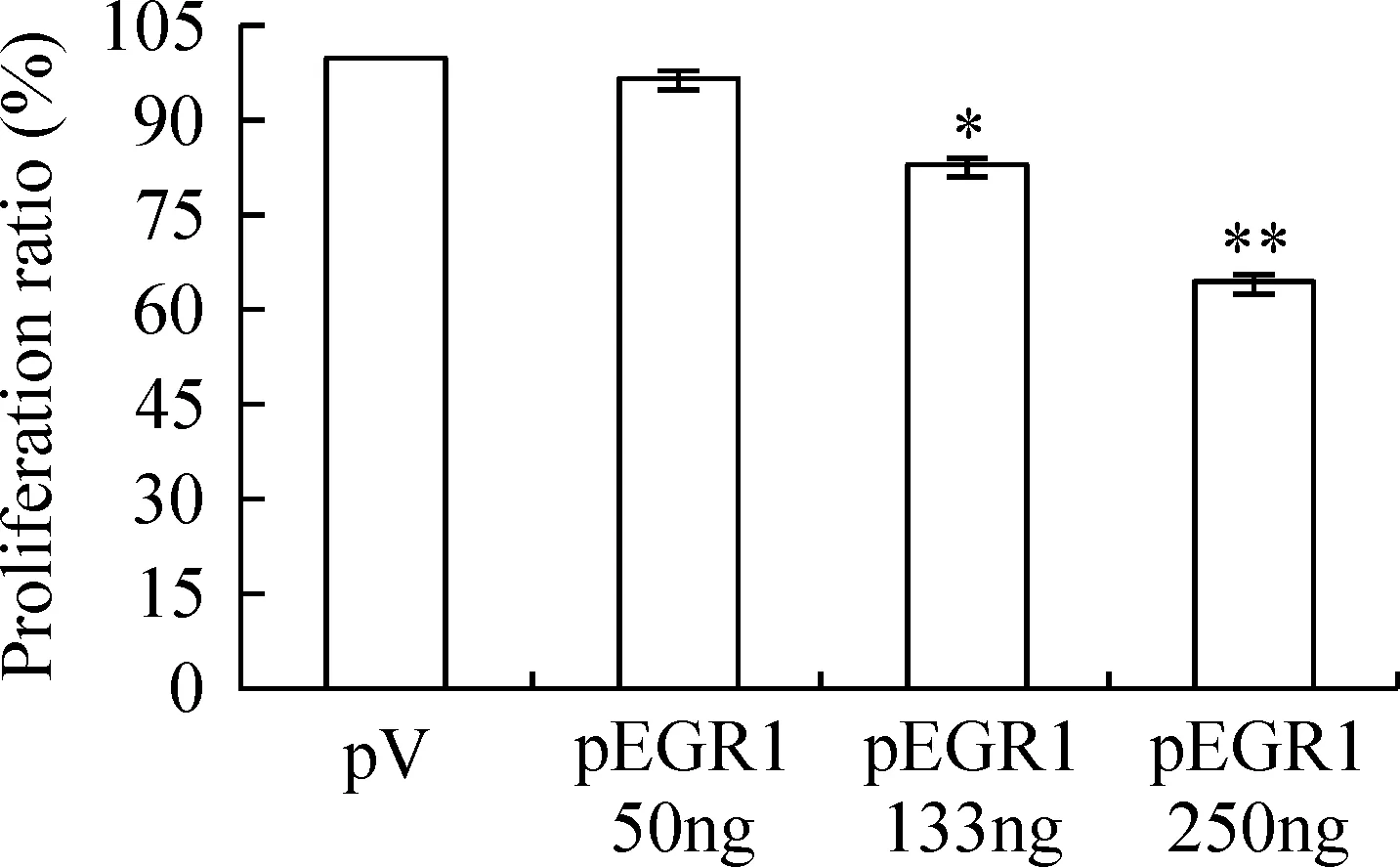
Figure 4. MTT assay for U2OS cells transfected with pEGR1 or pV. After transfected with different concentrations of pEGR1 or pV plasmids for 48 h, the cell proliferation were significantly inhibited in U2OS with higher EGR1 expression.±s.n=10. *P<0.05, **P<0.01 vs pV.

Figure 5. Effect of exogenous EGR1 on cell cycle and apoptotic rates of U2OS cells.s.n=3. *P<0.05, **P<0.01 vs pV.

Figure 6. The typical morphology changes of apotosis observed under the fluorescence microscope by DAPI staining. After transfected with various plasmids for 48 h, the U2OS cells were fixed by polyoxymethylene and then stained with DAPI.A and C: white field of U2OS cells transfected with pV or pEGR1,respectively;B and D: DAPI staining of A and C, respectively;E: DAPI staining of cells transfected with pEGR1+sh601.Bar=50 μm.
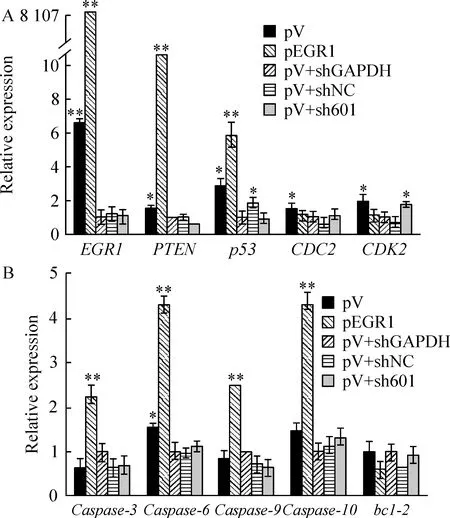
Figure 7. Relative expression level of apoptosis-associated genes affected by exogenous EGR1 in U2OS cells.mRNA levels of PTEN,p53,CDC2,CDK2(A) and members of caspase family(B), were detected by qPCR assays.±s.n=5. *P<0.05, **P<0.01 vs pV+shGAPDH.
讨 论
Hayflick提出衰老细胞假说[9], 认为机体内细胞寿命有一定界限,即所谓的Hayflick界限。因此,细胞衰老是细胞脱离细胞周期后进入一种相对稳定的状态,是正常细胞的必然归宿。
当机体在各种致癌因素作用下,染色体损伤,细胞失去对其生长的正常调控,周期紊乱,分化受阻,出现衰老障碍,细胞异常增生而形成的 "不死"细胞群,即为肿瘤[10]。由肿瘤的发生机制来看,抑制肿瘤要从调控细胞增殖与分化、细胞周期、细胞衰老与凋亡几个方面入手。
研究表明[4,11],经典的肿瘤抑制网络中,PTEN和p53等抑癌基因发挥着关键性作用,有报道指出EGR1也参与其中,并扮演了重要的角色:EGR1在p53调控的细胞凋亡中发挥着“管家”作用[12];EGR1通过Akt-EGR1-ARF-PTEN可以调控抑癌基因PTEN的表达[13]。我们通过qPCR检测发现,EGR1过表达后,U2OS细胞中PTEN和p53的表达确实明显上调(P<0.01);shRNA干扰EGR1表达后,细胞中二者的表达下调,提示在骨肉瘤细胞中,EGR1也可通过调控p53和PTEN发挥抑癌作用。
CDK2(cyclin-dependent kinase 2)和CDC2(cell division cycle 2)是推进细胞周期运行的2种重要因子。二者的异常表达,能引起细胞周期紊乱和异常增殖,导致癌症的发生[14],本文经qPCR检测发现pEGR1可显著抑制二者的表达(P<0.05);shRNA干扰EGR1表达后,二者的表达水平与对照组一致;同时U2OS细胞中过表达不同剂量的EGR1后,细胞增殖受到显著抑制(P<0.05),且抑制率与EGR1呈一定的剂量依赖;此外,EGR1可引起瘤细胞群体停滞在G0/G1期。这些结果提示在骨肉瘤中,EGR1可能是通过抑制CDK2和CDC2基因的表达,引起细胞周期停滞在G0/G1期,从而抑制了细胞增殖。
细胞凋亡是正常组织细胞更新的重要方式,也是清除异常和突变细胞的手段。诱导细胞凋亡是EGR1发挥作用的重要方式[8]。本实验研究发现,过表达EGR1可显著促进凋亡率增加(P<0.05),同时促进细胞核出现核固缩、核破裂等典型的凋亡表型,而shRNA可逆转这种表型。这提示我们,EGR1可以促进U2OS细胞凋亡。
在经典诱导凋亡途径中,保守的caspase家族是哺乳动物细胞中程序性死亡(PCD)的介导者和执行者, caspase-3蛋白是整个caspase家族活化的关键因素[15]。本文研究发现EGR1过表达时,caspase-3表达增高,同时该家族其它成员如caspase-6、caspase-9、caspase-10的表达也显著增高(P<0.05)。shRNA干扰EGR1表达后,这些基因表达水平均下调(P<0.05);这表明,EGR1诱导的凋亡可能是通过激活caspase家族蛋白而执行的。Bcl-2是线粒体凋亡途径的关键因素,而本实验中未发现EGR1过表达后对其表达有显著影响。提示EGR1诱导凋亡的信号途径可能与caspase家族介导的凋亡途径有关,而与Bcl-2的线粒体凋亡途径无关。
综上所述,实验证明瞬时过表达EGR1可以抑制骨肉瘤细胞U2OS的生长,使其凋亡率增加。其机制有可能是通过上调PTEN和p53的表达,进一步激活caspase家族而最终引起细胞程序性死亡。
Huang等[16]研究发现,EGR1可抑制骨肉瘤细胞Saos2的增殖,但Saos2为p53-/-型,而U2OS为p53+/+,我们猜测EGR1在2种细胞中发挥作用的机制是有所不同的,因此本文在U2OS中进行EGR1的瞬时表达研究,主要是为了判断EGR1对U2OS的作用,为进一步的机制研究和临床应用奠定基础。本文成功地将人EGR1基因克隆到了真核表达载体pcDNA3.1(-)中,并通过qPCR、免疫印迹、MTT、流式细胞术、DAPI染色和RNAi实验等初步研究表明,在U2OS细胞中,EGR1具有抑制细胞增殖,调节细胞周期和凋亡相关基因的表达,从而引起细胞周期停滞和促进凋亡作用,即具有抑癌的功能,因此下一步的工作是要建立合适的Tet-on稳定诱导表达系统,结合蛋白水平的验证和分子机制的研究,以及EGR1在Saos2和U2OS中调控细胞生长机制的差异性着手,进一步对EGR1在骨肉瘤中的功能深入研究。
总而言之,本研究为以后EGR1在骨肉瘤中抑癌机制的研究和临床应用研究提供了实验依据,奠定了良好的前期工作基础。
[1] Mibrandt J.A nerve growth factor-induced gene encodes a possible transcriptional regulatory factor[J].Science,1987,238(4828): 797-799.
[2] Liu C,Rangnekar VM,Adamson E,et al.Suppression of growth and transformation and induction of apoptosis by EGR1[J].Cancer Gene Ther,1998,5(1):3-8.
[3] Gashler AL,Swaminathan S,Sukhatme VP.A novel repression module,an extensive activation domain,and a bipartite nuclear localization signal defined in the immediate-early transcription factor Egr-1[J].Mol Cell Biol,1993,13(8):4556-4571.
[4] Baron V,Adamson E,Calogero A,et al.The transcription factor Egr1 is a direct regulator of multiple tumor suppressors including TGFβ1,PTEN,p53 and fibronectin[J].Cancer Gene Ther,2006,13(2):115 -124.
[5] Liu CT, Adamson E,Mercola D.Transcription factor EGR-1 suppresses the growth and transformation of human HT1080 fibrosarcoma cells by induction of transforming growth factor β1[J].Proc Natl Acad Sci USA,1996,93(21):11831-11836.
[6] 郝淼旺,刘彦仿,梁英锐,等. 外源表达EGR1对肝癌及食管癌细胞生长的影响[J].临床与实验病理学杂志,2000,16(4):318-321.
[7] Gitenay D,Baron VT.Is EGR1 a potential target for prostate cancer therapy? [J].Future Oncol,2009,5(7):993-1003.
[8] Yu J,Baron V,Mercola D,et al.A network of p73, p53 and Egr1 is required for efficient apoptosis in tumor cells[J]. Cell Death Differ, 2007,14(3):436-446.
[9] Hayclck L,Moorhead PS. The serial cultivation of human diploid cell strains[J].Exp Cell Res,1961,25(3):585-621.
[10]Duncan EL,Wadhwa R,Kaul SC.Senescence and immortalization of human cells[J].Biogerontology,2000,1(2):103-121.
[11]王长松, 李 红, 高春芳, 等. iASPP对表达野生型p53基因的乳腺癌细胞株MCF-7凋亡的影响[J].中国病理生理杂志,2010,26(2):282-286.
[12]Krones-Herzig A,Adamson E,Mercola D.Early growth response 1 protein, an upstream gatekeeper of the p53 tumor suppressor,controls replicative senescence[J].Proc Natl Acad Sci USA,2003,100(6):3233-3238.
[13]Yu J,Zhang S,Saito K,et al.PTEN regulation by Akt-EGR1-ARF-PTEN axis[J].EMBO J,2009,28(1):21-33.
[14]Schaefer JS,Sabherwal Y,Shi HY,et al.Transcriptional regulation of p21/CIP1 cell cycle inhibitor by PDEF controls cell proliferation and mammary tumor progression[J].J Biol Chem,2010,285(15):11258-11269.
[15]Hertrampf T,Gruca MJ,Seibel J,et al.The bone-protective effect of the phytoestrogen genistein is mediated via ERα-dependent mechanisms and strongly enhanced by physical activity[J].Bone,2007, 40(6):1529-1535.
[16]Huang RP, Liu C, Fan Y,et al. Egr-1 negatively regulates human tumor cell growth via the DNA-binding domain[J].Cancer Res,1995, 55(21):5054-5062.
TransientexpressionofexogenousEGR1affectscellcycleandapoptosisinhumanosteosarcomacells
QIN Li1, ZHANG Hui-hua1, GUO Shu-jun1, DUAN Fei-die1, CHEN You-peng2, LIANG Xu-jing2, CHEN Xiao-jia1
(1BioengineeringInstituteofJinanUniversity,NationalEngineeringResearchCenterofGeneticMedicine,GuangdongProvincialKeyLaboratoryofBioengineeringMedicine;2DepartmentofInfectiousDiseases,TheFirstAffiliatedHospital,JinanUniversity,Guangzhou510632,China.E-mail:tchenxj@jnu.edu.cn)
AIM: To obtain the gene of human early growth response 1(EGR1) and to study its function by transient expression ofEGR1 in human osteosarcoma cell line U2OS.METHODSTotal RNA was extracted from human placenta and reverse transcription of the RNA to cDNA was performed. The whole length ofEGR1 cDNA was isolated by nest PCR and cloned into pcDNA3.1(-), which was named pcDNA-EGR1. The pcDNA-EGR1 was transfected into U2OS cells by LipofectimeTM2000. The over-expression level ofEGR1 was detected by real-time quantitative PCR and Western blotting. The effects ofEGR1 expression on cell proliferation, cell cycle and apoptosis were analyzed by MTT, DAPI staining and flow cytometry, respectively.RESULTSThe eukaryotic expression vector pcDNA-EGR1 was constructed successfully and high expression level ofEGR1 in transfected U2OS cells was observed. Compared with the control cells, the proliferation of U2OS cells transfected withEGR1 was significantly inhibited(P<0.05), the cell cycle was significantly arrested at G0/G1stage and the apoptotic rate was increased(P<0.05). In U2OS cells transfected withEGR1, over-expression of exogenousEGR1 induced nuclear condensation. The expression of CDK2 and CDC2 gene was down-regulated, while thecaspasegenes were up-regulated(P<0.05). The apoptosis phenotype and the expression levels of related genes influenced byEGR1 were restored to the levels of control cells by the shRNA method for knocking down ofEGR1.CONCLUSIONEGR1 inhibits the proliferation of U2OS cells, arrests the cell cycle and increases the apoptotic rate.
Genes,early growth response; Transient expression; Osteosarcoma cells; Growth inhibition
R363
A
10.3969/j.issn.1000-4718.2011.02-016
1000-4718(2011)02-0293-07
2010-08-06
2010-10-27
暨南大学211重点学科《生物技术与生物工程药物》第三期预研资助项目;国家自然科学基金重大研究计划项目(No.90919050)
△通讯作者 Tel:020-85220221; E-mail: tchenxj@jnu.edu.cn
