P53结合位点对人NOD8基因的调控*
2011-11-20唐清亮胡巢凤柏志全
曾 琪, 张 芸, 田 莉, 唐清亮, 胡巢凤△, 柏志全
(暨南大学医学院 1病理生理学系,国家中医药管理局重点实验室,2生理学系,广东 广州 510632)
P53结合位点对人NOD8基因的调控*
曾 琪1▲, 张 芸1▲, 田 莉1, 唐清亮1, 胡巢凤1△, 柏志全2
(暨南大学医学院1病理生理学系,国家中医药管理局重点实验室,2生理学系,广东 广州 510632)
目的: 探讨P53结合位点在NOD8基因调控中的作用。方法利用生物信息学方法,我们发现人与黑猩猩的NOD8基因核心启动子区域相似位置含有P53结合位点;以人基因组DNA为模板, PCR扩增含有人NOD8基因序列,构建含有/缺失人P53结合位点的NOD8基因启动子驱动的、表达绿色荧光蛋白-NOD8融合蛋白的质粒pNOD8(760 bp)-EGFP-NOD8和mpNOD8(750 bp)-EGFP-NOD8;将构建的重组质粒经阳离子聚合物JetPeiTM介导瞬时转染HEK293细胞中,并加入不同浓度的P53抑制剂pifithrin alpha(PFT-α)处理HEK293细胞,用RT-PCR和Westren blotting 方法检测NOD8 mRNA和蛋白的表达;此外,用pNOD8(760 bp)-EGFP质粒转染HEK293细胞,利用染色质免疫共沉淀法(ChIP)观察P53是否与NOD8启动子结合。结果经酶切鉴定和序列测定证实重组质粒构建成功。ChIP实验证实P53能与NOD8启动子结合。 pNOD8 (760 bp)-EGFP-NOD8 转染组中NOD8 mRNA的表达显著高于pEGFP-C2转染组(Plt;0.05),并且NOD8 mRNA 在缺失人P53结合位点的mpNOD8 (750 bp)-EGFP-NOD8转染组中的表达明显降低(Plt;0.01);同时发现加入 PFT-α的pNOD8(760 bp)-EGFP-NOD8 转染组NOD8 mRNA的表达显著下降,并呈剂量依赖关系,其中90 μmol/L PFT-α 对NOD8 mRNA表达的抑制作用最为显著(Plt;0.01)。与mRNA检测结果一致的是pNOD8(760 bp)-EGFP-NOD8 转染组NOD8蛋白的表达量显著高于对照组pEGFP-C2; 而mpNOD8(750 bp)-EGFP-NOD8转染组NOD8蛋白的表达量明显低于pNOD8(760 bp)-EGFP-NOD8转染组和加入 PFT-α的pNOD8(760 bp)-EGFP-NOD8 转染组(Plt;0.01)。结论P53结合位点在NOD8基因调控中起着重要的作用,并且P53结合位点与NOD8基因之间可能存在正反馈调节。
启动子; 基因,NOD8; P53 结合位点; 核苷酸结合寡聚结构域样受体
在长期进化过程中,机体的免疫系统逐步形成一套复杂的防御系统,包括天然免疫和获得性免疫。天然免疫系统通过模式识别受体(pattern recognition receptors, PRRs)对病原体进行识别,从而发挥固有免疫作用[1]。目前研究发现的核苷酸结合寡聚结构域(nucleotide-binding and oligomerization domain, NOD)样受体(NOD-like receptors, NLRs)是胞内受体,NLRs家族由20多个成员组成,它们的主要特征是具有N末端的CARD(caspase-recruitment domain)结构域或pyrin结构域(pyrin domain, PYD),位于中央的NOD以及C-末端富含亮氨酸的重复序列(leucine-rich repeat, LRR)。LRRs识别细菌肽聚糖的部分结构,为病原细胞之间蛋白-蛋白的相互作用提供支架并调节蛋白的激活[2]。N-末端CARD结构域或PYD与接头蛋白RICK或ASC(apoptosis-associated speck-like protein containing a CARD)相互作用,激活NF-κB,引起炎症反应[3-5]。
近年来研究发现一种在体外具有抗炎活性的新型NLRs,它由N末端的PYD和中间的NOD组成,与该家族的其它蛋白不同之处是C-末端缺乏作为配体识别区域的富含亮氨酸的重复序列LRRs,故被命名为NOD8(也称PYNOD、NLRP10、NALP10、CLR11.1或PAN5)[6-7]。研究发现NOD8可抑制由caspase-1介导的IL-1β的分泌以及抑制ASC介导的NF-κB的活化和细胞凋亡。这是NLR家族中首个被发现的对炎症起负调节作用的成员。
我们应用生物信息学方法对不同种属的NOD8启动子内保守序列进行分析,发现在人与黑猩猩的NOD8基因核心启动子区域相似位置含有P53结合位点,P53作为生理和病理过程中的转录因子,调控着许多免疫反应的调节子。本研究将构建含有/缺失P53结合位点的人NOD8基因启动子驱动的、表达绿色荧光蛋白-NOD8融合蛋白表达载体,探讨P53结合位点是否在NOD8基因调控中发挥作用。
材 料 和 方 法
1材料
质粒pEGFP- C2和大肠杆菌E.coliDH5α为本室保存; DNA多聚酶Pyrobest、dNTP、Trizol裂解液及相关的buffer购自大连TaKaRa;限制性内切酶XhoI和KpnI为MBI产品;T4 DNA 连接酶购自Promega;DNA marker 等为北京普博公司产品。质粒小量抽提试剂盒,PCR 产物纯化及胶回收试剂盒购自Omega;pifithrin alpha(PFT-α)为 Calbiochem产品;二甲基亚砜(dimethyl sulfoxide,DMSO)为Sigma产品;细胞转染所用的阳离子聚合物JetPeiTM为Polyplus产品;HEK293购自中科院上海细胞所。细胞培养基DMEM为HyClone产品, 胎牛血清为杭州四季青公司产品;所用抗体均购自Santa Cruz。常用试剂中电泳及分离试剂均为分析纯试剂配制。
2方法
2.1pNOD8(760)-EGFP和mpNOD8(750)-EGFP质粒的构建 这2个质粒为本实验前期构建。根据GenBank提供的NOD8基因组序列(序列号NM_176821)和所选用的质粒pEGFP-C2设计合成引物,所扩增启动子区域的片段大小为760 bp,其中包括了P53结合位点(GGCAAATGGG);构建了NOD8基因启动子pNOD8(760)-EGFP质粒;并在此质粒上将P53结合位点缺失突变,构建了突变质粒mpNOD8(750)-EGFP[8]。
2.2染色质免疫共沉淀(chromatin immunoprecipitation,ChIP)验证P53与NOD8启动子的结合 将HEK293 细胞以3×106cells/well加入6孔板,转染pNOD8(760)-EGFP质粒48 h后,1% 甲醛处理细胞10 min ,用Millipore ChIP Kit 分析P53与NOD8启动子间的相互作用(按说明书操作)。P53抗体为山羊抗性(Santa Cruz Biotechnology) ;从蛋白-DNA复合物中分离得到的DNA片段被纯化并进行PCR分析,同时以基因组基因为模板扩增GAPDH作为阳性对照,并以在相同条件处理,用小鼠IgG抗体进行ChIP实验所得的基因片段作为阴性对照模板。NOD8上游引物5’-CCATC CGTCTAAGGAGGCATACAG-3’,下游引物5’-GCAAAGCTCCAAGAAAG ACAAG-3’, 扩增片段长度250 bp;GAPDH 上游引物5’-AGCACCCCTGGCCAAGGTCA -3’,下游引物5’-CAATGCCAGCCCCAGCGTCA-3’, 扩增片段长度454 bp。PCR 反应条件为:95 ℃预变性3 min,95 ℃ 30 s,58 ℃ 30 s,72 ℃ 40 s ,40个循环;72 ℃ 10 min。扩增产物在含0.5 mg/L溴化乙啶(EB)的10 g/L琼脂糖凝胶中电泳分析,用紫外观测仪观察结果。
2.3PCR扩增NOD8基因及回收 根据GenBank提供的NOD8基因组序列(序列号NM_176821)和所选用的质粒pEGFP-C2设计合成1对引物。所扩增的片段大小为1 968 bp;引物由上海生工合成。上游引物为5’ - CCGCTCGAGCCTTCCCCCAGATCACCAT - 3’,下游引物为5’- CGGGGTACCATATGTAAGTATTTTTTGGTGTTT - 3’。在上游引物和下游引物的5′端分别引入XhoI和KpnI 的酶切位点(下划线序列) 。以人基因组DNA为模板, PCR扩增出相应片段,反应体系如下:模版1 μL、10 ×PCR缓冲液2 μL、引物(10 mol/L ) 各 1 μL、TaqDNA聚合酶0.5 μL及10 mmol/L dNTP 2 μL, 加H2O至50 μL混匀。PCR 反应条件为:95 ℃预变性5 min,94 ℃ 30 s,55 ℃ 30 s ,72 ℃ 2 min ,35 个循环,72 ℃ 10 min。扩增产物在含0.5mg/L溴化乙啶的10 g/L琼脂糖凝胶中电泳分析,用紫外观测仪观察结果后,用Omega Agarose Gel DNA Purification Kit胶回收试剂盒切胶回收目的DNA片段(按说明书操作)。
2.4重组质粒构建与鉴定 限制性内切酶XhoI 和KpnI 双酶切带有酶切位点的目的NOD8基因片段及pNOD8(760 bp)-EGFP、mpNOD8(750 bp)-EGFP质粒,用10g/L琼脂糖凝胶电泳分离目的片段,切胶回收NOD8片段和线性化的pNOD8- EGFP、mpNOD8(750 bp)-EGFP, 在T4 DNA连接酶作用下16 ℃连接过夜。以Mandel等[9]提出的氯化钙法制备感受态细菌,连接产物转化大肠杆菌DH5α,将转化的菌液涂布于含卡那霉素的LB平板上,37 ℃培养16 h ,挑取阳性克隆,扩大培养后小量提取质粒, 进行XhoI和KpnI双酶切鉴定和PCR鉴定。经上述方法鉴定后的pNOD8(760 bp)- EGFP-NOD8和mpNOD8 (750 bp)-EGFP-NOD8重组质粒进行DNA序列分析,由大连TaKaRa公司测序,序列确证无误后,再大量扩增。
2.5细胞培养及细胞基因转染 采用DMEM培养液,按总溶液体积的10%添加胎牛血清及青霉素和链霉素各100 mg/L,在37 ℃、5%CO2条件下进行细胞培养。转染前1 d 将HEK293细胞按5×108/L的密度分别接种于6孔板内,所有实验组待细胞生长至70%融合时进行转染。将2 μg质粒DNA稀释于150 mmol/L NaCl至终体积150 μL, 取4 μL JetPeiTM,用150 μL 150 mmol/L NaCl稀释并混匀。随后,制备JetPeiTM/DNA复合物,将150 μL JetPeiTM溶液加入150 μL DNA溶液中。室温下孵育20 min;将JetPeiTM/DNA复合物加入12孔板,轻轻混匀,置于CO2培养箱(37 ℃、5%CO2)中孵育。48 h后用含800 mg/L G418 (Sigma)DMEM培养基对转染细胞进行筛选,10 d 后改用400 mg/L G418 DMEM培养基进行培养3~4 d,直至细胞融合。
2.6四甲基偶氮唑盐法(MTT)检测 将HEK293细胞以1×104cells/well 铺于96孔板,每组设4个复孔,并设与实验平行的本底对照孔。细胞长满78%~80%后加入不同浓度的PFT-α,孵育48 h后,每孔加入20 μL质量浓度为5 g/L的MTT溶液,37 ℃、5%CO2培养箱内孵育4 h,弃孔内液体,加入150 μL DMSO振荡10 min,在酶标仪上检测595 nm的吸光度值。细胞存活率=(加药组A值-不加细胞组A值)/(对照组A值-不加细胞组A值)×100%。
2.7检测PFT-α 对NOD8 mRNA表达的影响 实验分组:在质粒转染HEK293细胞48 h后,分为(1)pEGFP- C2转染组(对照组);(2)pNOD8(760 bp)-EGFP-NOD8转染组;(3)mpNOD8(750 bp)-EGFP-NOD8转染组;(4)加入不同浓度的PFT-α (P53 抑制剂)的pNOD8(760 bp)-EGFP-NOD8转染组,PFT-α 在转染前5 h以 20、 60、 90 μmol/ L 加入培养板中,然后处理同其它组转染HEK293细胞,转染后3 h, 将细胞用PBS洗2次,用含有PFT-α的DMEM培养细胞。收集上述处理组中的HEK293细胞以PBS洗涤后,加入500 μL/well Trizol裂解液,按说明书提取总RNA。逆转录:取0.5 μg细胞总RNA,加入0.5 μL逆转录酶, 按说明书合成cDNA。上游引物5’-CCATCCGTCTAAGGAGGC -3’ ,下游引物5’- GCAAAGCTCCAAGAAAG-3’,扩增产物长度为229 bp ;并设计GAPDH引物为内参对照,上游引物5’-AGCACCCCTGGCCAAGGTCA -3’,下游引物5’- CAATGCCAGCCCCAGCGTCA-3’。PCR反应体系20 μL,反应条件: 95 ℃ 5 min,94 ℃ 30 s,58 ℃ 30 s, 72 ℃ 30 s , 30个循环;72 ℃ 10 min。 扩增出的NOD8片段,用1.5%琼脂糖凝胶电泳进行观察其与预期DNA片段大小是否一致,并进行半定量灰度值分析:
NOD8 mRNA相对量=(NOD8灰度值/GAPDH灰度值)/(control组NOD8灰度值/control组GAPDH灰度值)×100%。
2.8Western blotting分析NOD8蛋白表达 实验分组:(1)pEGFP-C2转染组;(2)pNOD8(760 bp)-EGFP-NOD8转染组;(3)mpNOD8(750 bp)-EGFP-NOD8转染组;(4)加入90 μmol/L PFT-α的pNOD8(760 bp)-EGFP-NOD8转染组。收集各转染组细胞经PBS洗涤3次后, 加入细胞裂解液50 μL, 冰浴30 min, 12 000 r /min离心 15 min, 取上清加入等体积的 5×SDS上样缓冲液煮沸5 min。以 15 μL /well加样经50 g/L积层胶后进行120 g/L分离胶 SDS-PAGE电泳, 常规方法在Bio-Rad系统转移至硝酸纤维素膜上, 50 g/L脱脂奶粉封闭过夜; 第2 d TBST洗膜后,加入抗NOD8单克隆抗体 (mAb) (1 g/L) (1∶500)置摇床室温温育 2 h, 洗涤30 min后加入辣根过氧化物酶标记的兔抗山羊IgG(1∶2 000)为Ⅱ抗, 同上反应; 再次洗涤3次,每次10 min,然后用 ECL化学发光显影, GAPDH作为内参照。NOD8 蛋白相对量=(NOD8灰度值/GAPDH灰度值)/(control组NOD8灰度值/control组GAPDH灰度值)×100%。
3统计学处理
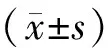
结 果
1ChIP实验结果
HEK293细胞转染pNOD8(760 bp)-EGFP质粒48 h后,经ChIP实验证实P53能够结合到NOD8基因启动子上。与P53抗体结合的DNA片段经PCR反应可见大量NOD8启动子扩增片段,片段长度为250 bp;小鼠IgG阴性对照组经PCR反应后未见特异性扩增片段,而在以全基因组片段为模板的GAPDH组中,可见大小约为454 bp大小的片段,但在与P53抗体结合的基因片段为模板的PCR反应中未扩增出特异性条带,证实免疫共沉淀成功,见图1。
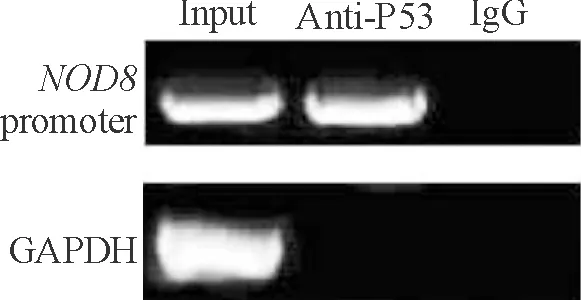
Figure 1. Binding of P53 to the NOD8 promoter was validated by ChIP. Before immunoprecipitation, an aliquot of each sample was served as an ‘input’ fraction (PCR control).
2NOD8基因DNA片段的PCR扩增
琼脂糖凝胶电泳显示, 扩增基因片段的大小分别为1 968 bp,结果与预期设计一致,见图2A。
3重组表达载体鉴定
将构建的2个重组质粒pNOD8(760 bp)-EGFP-NOD8和mpNOD8(750 bp)- EGFP-NOD8用XhoI 和KpnI双酶切,分别获得大小为1 968 bp的基因片段,见图2B,表明人NOD8基因序列已被插入到pEGFP-C2中,并且P53结合位点缺失突变成功。重组质粒由TaKaRa公司进行序列检测,测定结果联网到NCBI进行同源性分析, 同源性为100%。测序结果与GenBank 数据库相应的NOD8基因DNA 序列完全一致,表明含有/缺失人P53结合位点的NOD8基因启动子驱动的、表达绿色荧光蛋白-NOD8融合蛋白的质粒构建成功。

Figure 2. Identification of NOD8 gene recombinant plasmids. A: the NOD8 gene fragments obtained from PCR were separated by 1% agarose electrophoresis. Lane1: marker; Lane 2: the NOD8 gene fragment. B: identification of recombinant plasmids digested with Xho I and Kpn I restriction enzymes. Lane1: pNOD8(760 bp)-EGFP-NOD8; Lane2 :mpNOD8(750 bp)- EGFP-NOD8; Lane 3: marker.
4PFT-α对HEK293细胞活性的影响
不同浓度的PFT-α处理HEK293细胞48 h后,细胞活性不受影响,见图3,与空白对照组相比,差异无统计学意义(Pgt;0.05)。因此本实验选取20、60、90 μmol/L 3个剂量作为后续研究中的给药浓度。

Figure 3. Effect of PFT-α on HEK293 viability.
5转染不同质粒的HEK293细胞NOD8mRNA的表达
RT-PCR 结果显示,所有待分析样本的 cDNA均扩增出强度基本一致的GAPDH,表明 cDNA质量稳定,可用于靶基因的表达分析。采用上述特异性引物可扩增出大约229 bp的目的基因片段和454 bp的内参基因片段,见图4A。pNOD8(760 bp)-EGFP-NOD8转染组NOD8 mRNA的表达显著高于对照pEGFP-C2转染组,是其(138.4±6.4)%;而NOD8 mRNA在mpNOD8(750 bp)-EGFP-NOD8组中的表达最低为对照组的(49.2±3.5)%,并且显著低于b组(Plt;0.01),见图4B。
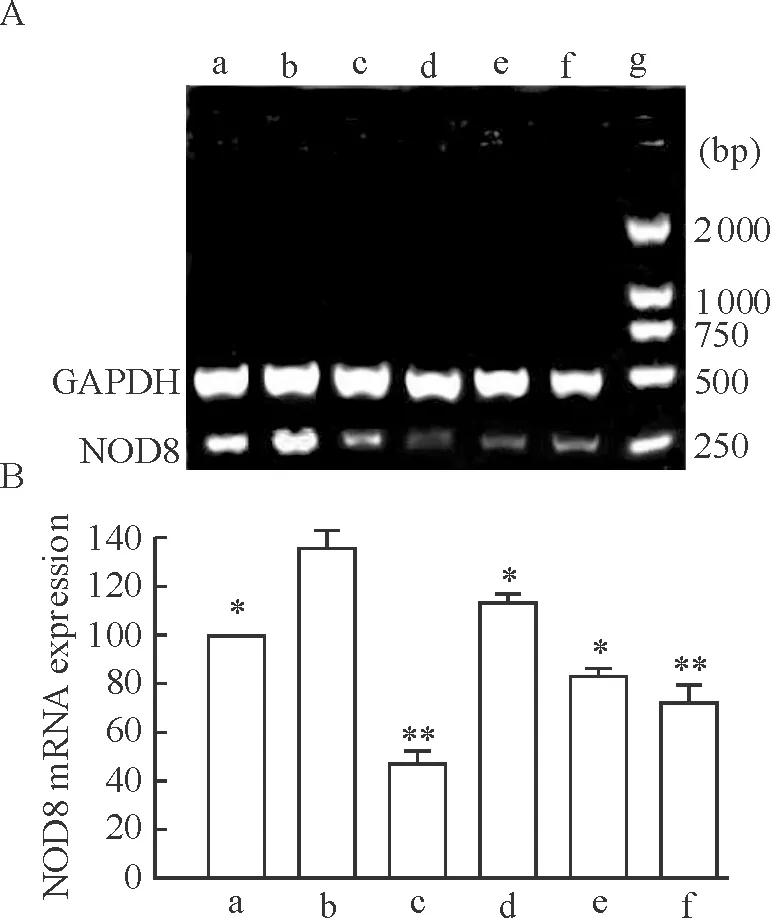
Figure 4. Relative NOD8 mRNA level after transfection and treatment with PFT-α . A: expression of NOD8 mRNA by 1%agarose gel electrophoresis;B: quantitation of NOD8 mRNA expression in HEK293 cells. a: pEGFP-C2; b: pNOD8(760 bp)- EGFP-NOD8; c: mpNOD8(750 bp)- EGFP-NOD8; d~f: pNOD8(760 bp)- EGFP-NOD8 and treated with PFT-α (20, 60, 90 μmol/L),respectively±s.n=3.*Plt;0.05,**Plt;0.01 vs b group.
6PFT-α对NOD8mRNA表达的影响
加入P53抑制剂PFT-α的pNOD8(760 bp)-EGFP-NOD8 转染组中NOD8 mRNA表达显著下降,且与PFT-α 呈剂量依赖关系,其中以90 μmol/L PFT-α 对NOD8 mRNA表达的抑制作用最为显著,见图4B,为a组的(72.5±2.6)%。这些结果表明NOD8启动子中P53结合位点具有上调NOD8基因的作用。
7NOD8蛋白在HEK293细胞中的表达
为进一步研究P53 结合位点对NOD8的调控作用,我们用Western bloting 检测各转染组[pEGFP-C2、pNOD8(760 bp)-EGFP-NOD8、mpNOD8(750 bp)- EGFP-NOD8和PFT-α处理的pNOD8(760 bp)-EGFP-NOD8]中NOD8蛋白的表达,见图5A。NOD8蛋白在 pNOD8(760 bp)-EGFP-NOD8 转染组中的表达量显著高于对照组pEGFP-C2;与mRNA检测结果一致的是,突变质粒mpNOD8(750 bp)-EGFP-NOD8和PFT-α处理的pNOD8(760 bp)-EGFP-NOD8)转染组NOD8蛋白的表达明显低于pNOD8(760 bp)-EGFP-NOD8转染组,分别为其(31.2±4.9)%和(50.5±3.4)%,Plt;0.01,见图5。基于以上结果推测,P53可与NOD8基因启动子上的P53结合位点相互作用,并上调NOD8蛋白的表达。

Figure 5. NOD8 protein expression detected by Western blotting analysis. a:pEGFP-C2; b: pNOD8(760 bp)-EGFP-NOD8; c: mpNOD8(750 bp)-EGFP-NOD8; d: pNOD8(760 bp)-EGFP- NOD8 treatment with 90 μmol/L PFT-α.±s.n=4.*Plt;0.05 vs a group;##Plt;0.01 vs b group.
讨 论
NLRs 广泛存在于植物、线虫、脊椎动物和人类的胞浆内,在遗传上高度保守,参与对细菌的识别及诱导炎症反应。NOD8基因位于16q12,编码NOD8蛋白,它的mRNA可表达于各种组织中。近年来发现,NOD8可与ASC相互作用并抑制ASC的多种功能,包括对NF-κB和caspase-1的激活,以及诱导凋亡。NOD8还可以与 caspase-1和 IL-1β 相互作用并能抑制caspase-1介导IL-1β的成熟。因此,NOD8可能是一个炎症与凋亡的多功能负调节因子[7]。NOD8在脑、心脏和肌肉高表达,而ASC在这些组织中的表达恰好相对较低,因此NOD8可能在ASC介导的炎症或凋亡中起着保护作用[10]。
转录因子在调节级联反应中起着重要作用,它可以与启动子中特殊的DNA序列直接结合从而发挥促进或抑制基因转录的作用。在本研究中,我们运用生物信息学方法发现在人与黑猩猩的NOD8基因核心启动子区域相似位置含有P53结合位点;另一方面,在小鼠与大鼠的启动子区域没有P53结合位点。因此我们认为在人与黑猩猩的NOD8基因调控中有着高度相似的机制。这种假设被研究人与黑猩猩之间全基因组调控进化论所支持[11]。我们认为该结合位点在NOD8基因的调控中扮演了重要的作用 。
我们前期的实验发现,在静息细胞中,含有P53结合位点的NOD8启动子重组质粒能驱动的绿色荧光蛋白表达,但荧光强度较阳性对照pEGFP-C2组低,说明NOD8基因启动子在转录起始位点上游-710 bp ~ -50 bp处已包含了需要起始转录的基本转录元件;而缺失P53结合位点的突变质粒mpNOD8-EGFP和加入PFT-α后的重组质粒pNOD8-EGFP绿色荧光蛋白表达显著减弱。说明P53结合位点在NOD8基因调控中发挥了正调节作用[8]。
为进一步研究 P53 结合位点对NOD8基因的调控作用,我们在前期实验基础上,通过ChIP方法证实了P53可以与NOD8启动子结合;同时构建了pNOD8(760 bp)-EGFP-NOD8和mpNOD8(750bp)-EGFP-NOD8重组质粒。将重组质粒转染进入HEK293细胞后发现,mpNOD8(750 bp)-EGFP-NOD8转染组(NOD8启动子中的P53结合位点被缺失突变) NOD8 mRNA的表达显著低于pNOD8(760 bp)-EGFP-NOD8转染组(NOD8启动子中包含P53结合位点);并且加入P53抑制剂PFT-α的pNOD8(760 bp)-EGFP-NOD8转染组NOD8 mRNA的表达也明显降低。此外,在mpNOD8(750 bp)-EGFP-NOD8转染组或转染pNOD8(760 bp)- EGFP-NOD8质粒并加入P53抑制剂的细胞中NOD8蛋白表达也显著低于pNOD8(760 bp)-EGFP-NOD8转染组。这些结果说明,P53可以与NOD8基因启动子上的P53结合位点结合,并且上调NOD8的表达,P53结合位点在NOD8基因调控中发挥了正调节作用。这种正性反馈调节可能在病原体入侵机体时发挥有效的抗炎作用,防止过度炎症造成的自我损伤,这对进一步了解天然免疫反应具有重要意义。
[1]Akira S, Uematsu S, Takeuch O. Pathogen recognition and innate immunity[J]. Cell,2006,124(4):783-801.

[4]胡巢凤.参与免疫及炎症反应调控的胞浆蛋白NODs[J].中国病理生理杂志,2004,20(7): 1304-1308.
[5]王娇莉,徐 峰,沈华浩.NOD蛋白与肺部疾病[J].中国病理生理杂志,2008,24(10): 2063-2067.
[6]Wang Y, Hasegawa M, Imamura R,et al. PYNOD, a novel Apaf-1/CED4-like protein is an inhibitor of ASC and caspase-1[J]. Int Immunol,2004,16(6): 777-786.
[7]Imamura R, Wang Y, Kinoshita T, et al. Anti-inflammatory activity of PYNOD and its mechanism in humans and mice[J]. J Immunol,2010,184(10): 5874-5884.
[8]曾 琪,蒋 宇,胡巢凤,等. P53结合位点在NOD8启动子基因克隆调节及其对NOD8基因中的作用[J].现代免疫学,2010,30(6): 471-476.
[9]Mandel M, Higa A. Calcium-dependent bacteriophage DNA infection[J]. Mol Biol,1970,53(1):159-162.
[10]Philpott DJ, Girardin SE, Sansonetti PJ. Innate immune responses of epithelial cells following infection with bacterial pathogens[J].Curr Opin Immunol,2001,13(4) : 410-416.
[11]Uddin M, Wildman DE, Liu G, et al. Sister grouping of chimpanzees and humans as revealed by genome-wide phylogenetic analysis of brain gene expression profiles[J]. Proc Natl Acad Sci USA,2004,101(9): 2957-2962.
EffectofP53bindingsiteonregulationofhumanNOD8gene
ZENG Qi1, ZHANG Yun1, TIAN Li1, TANG Qing-liang1, HU Chao-feng1, BAI Zhi-quan2
(1DepartmentofPathophysiology,KeyLaboratoryofStateAdministrationofTraditionalChineseMedicineofthePeople’sRepublicofChina,2DepartmentofPhysiology,SchoolofMedicine,JinanUniversity,Guangzhou510632,China.E-mail:thcf@jnu.edu.cn)
AIM: To investigated the characterization and biological function of P53 binding element in the regulation ofNOD8 gene.METHODSUsing the method of bioinformatics, we found a completely preserved P53 binding site inNOD8 core promoter both in humans and chimpanzees.NOD8 gene was amplified by PCR from human cDNA and correctly connected into the vector pNOD8(760 bp)-EGFP-C2/ mpNOD8(750 bp)-EGFP-C2. The constructed plasmids pNOD8(760 bp)-EGFP-NOD8 and mpNOD8(750 bp)-EGFP-NOD8 were transiently transfected into the cell line HEK293 by JetPeiTMand treated with pifithrin alpha (PFT-α,an inhibitor of P53) at different concentrations for 24 h. The mRNA and protein expression levels of NOD8 were detected by RT-PCR and Western blotting. In addition, chromatin immunoprecipitation (ChIP) assay was performed to determine the binding of P53 to theNOD8 promoter after recombinant plasmid pNOD8(760 bp)-EGFP was transfected into HEK293 cells.RESULTSThe plasmids pNOD8(760 bp) -EGFP-NOD8 and mpNOD8(750 bp)-EGFP-NOD8 were successfully constructed and conformed by restriction digestion and sequence analysis. The results of ChIP confirmed that P53 bound to the promoter ofNOD8. The mRNA expression of NOD8 in the cells transfected with pNOD8(760 bp)-EGFP-NOD8 was stronger than that in the cells transfected with control vector pEGFP-C2 (Plt;0.05). Furthermore, the mRNA expression of NOD8 was reduced in HEK293 cells transfectnt with the mutant plasmid mp NOD8 (750 bp)-EGFP-NOD8 compared with the cells transfected with pNOD8(760 bp)-EGFP-NOD8. Meanwhile, PFT-α inhibited the mRNA expression of NOD8 in the cells transfected with pNOD8(760 bp)-EGFP-NOD8 in a concentration-dependent manner, and PFT-α at concentration of 90 μmol/L was the most effective in inhibiting NOD8 mRNA expression (Plt;0.01). As expected, the protein expression of NOD8 inpNOD8 (760 bp)-EGFP-NOD8 group significantly increased compared with that inpNOD8-C2 group, the protein expression of NOD8 in mpNOD8 (750 bp)-EGFP-NOD8 group orpNOD8 (760 bp)-EGFP-NOD8 + PFT-α group was dramatically decreased compared with that in pNOD8(760 bp) -EGFP-NOD8 group.CONCLUSIONThe results suggest that the P53 binding site is critical for the regulation ofNOD8 gene and there is positive feedback regulation between P53 binding site andNOD8, which may maintain efficient balance between defense and self-inflicted injury in response to the invasion of pathogen.
Promoter; Genes,NOD8; P53 binding site; Nucleotide-binding and oligomerization domain-like receptors
1000-4718(2011)12-2362-06
R363
A
10.3969/j.issn.1000-4718.2011.12.023
2011-11-09
2011-11-21
广东省自然科学基金资助项目 (No. 06025159);广东省教育厅自然科学基金资助项目[No. 126 (2005)];暨南大学“211工程”三期预研项目;暨南大学重点实验室基金资助项目
△ 通讯作者 Tel: 020-85228079; E-mail: thcf@jnu.edu.cn
▲ 并列第1作者
