对国内32 个厂家阿司匹林肠溶片的质量考察
2011-11-20刘娜赵兴红杨天鸣张昌戎
刘娜 赵兴红 杨天鸣 张昌戎
(兰州军区联勤部药品仪器检验所,甘肃 兰州730000)
阿司匹林,又名乙酰水杨酸,为较温和的解热镇痛药,有较强的抗炎抗风湿作用,并有促进尿酸排泄和抗血小板凝集作用,临床用于头痛、风湿热、风湿性关节炎、痛风症和心脑血管疾病,预防短暂性脑缺血、中风、缺血性心脏病等,预防心肌梗死、减少心律失常的发病率和死亡率[1]。目前主要有原料药、片剂、胶囊剂、栓剂等剂型,已形成了相当的生产规模。本实验针对阿司匹林肠溶片的多种规格(25 mg、40 mg、50 mg 和0.3 g) 共计32 家企业236 批次进行了跨多地域全国范围内较为全面的质量考察[2],对临床用药提供了一定的参考。
1 仪器与材料
Agilent 1100 高效液相色谱仪(包括在线脱气机、四元泵、智能柱温箱、自动进样器、可变波长检测器、化学工作站;美国安捷伦公司);梅特勒- 脱利多AB135-S 和AE100 电子分析天平(瑞士梅特勒公司);HP-8453 型紫外分光可见光度计(美国惠普公司);ZRS-4 型智能溶出试验仪(天津无线电厂)。
阿司匹林对照品(中国药品生物制品检定所,批号100113-200603),水为超纯水,其余试剂均为分析纯。阿司匹林肠溶片为抽检的32 个企业的市售产品。
2 方法与结果
2.1 方法
此次质量考察中规格0.3 g 按《中国药典》2005 年版(二部)[3]进行检验,规格25 mg、40 mg 和50 mg 按《化学药品地方标准上升国家标准》 第七册WS-10001-(HD-0614)- 2002-2005 进行检验。
2.2 依据标准检验结果分析
2.2.1 总检验结果 本实验共检验样品数为236 批次,合格数为235 批次,占99.58%;不合格数为1 批次,占0.42%,说明该制剂的生产工艺较为成熟。
2.2.2 不同样品保存条件对样品检验结果影响分析 本实验检验样品的地域涉及多个省、直辖市、自治区,抽样时间在3 ~4 月,贮存温度在7 ~27℃、相对湿度14 %~75%。结果表明,不同抽样地点、保存条件对样品检验结果没有明显的影响。
2.2.3 不合格批次的生产企业、生产时间、抽样地点、保存条件分布与不合格可能原因分析 本次检验不合格数1 批次,为31 号企业产品,抽样地点温度25℃,相对湿度50%。因为只有1 批次,数据太少不能说明抽样地点和保存条件与该批次不合格的相关性。
2.3 按项目进行结果分析
2.3.1 性状 本实验样品来自于32 个生产企业,其中31个生产企业的产品为肠溶衣片,1 个生产企业的产品为糖衣片。本次评价抽验检出1 批不合格样品,不合格项目为含量测定。该批次不合格项与阿司匹林肠溶片性状相关性不大。
2.3.2 鉴别 利用阿司匹林水解生成水杨酸和三氯化铁的显色鉴别真伪。结果全部合格,本次评价抽验检出1 批不合格样品,不合格项目为含量测定。该批次不合格项与阿司匹林肠溶片鉴别项相关性不大。
2.3.3 重量差异 阿司匹林肠溶片片重与其处方及生产工艺有关,因此该检查项可以间接反映各生产企业生产工艺的稳定性。阿司匹林肠溶片25 mg 涉及24 个生产企业,共183 批次;40 mg 涉及1 个生产企业,共7 批次;50 mg涉及8 个生产企业,共33 批次,0.3 g 涉及2 个生产企业,共13 批次。各生产企业产品的平均片重及相对标准差统计分析结果详见表1。
结果表明,各企业的阿司匹林肠溶片生产工艺存在差异,表现在规格为25 mg 的24 个生产企业产品中,27 号的企业的平均片重为0.095 4 g,而19 号企业产品的平均片重为0.064 2 g;规格为0.3 g 的2 个生产企业产品中,24 号企业产品为糖衣片。由表7 可知,生产规格为25 mg的24 个企业中,31 号企业产品各批次间平均片重RSD值为13.48%(n= 4),是24 个生产企业中差异最大的,说明各企业生产工艺稳定性存在差异。
2.3.4 游离水杨酸检查结果分析 236 批次样品的游离水杨酸检查结果全部符合标准规定。不合格项目为含量测定,由于批次少,与含量不合格是否有相关性不能分析。
2.3.5 释放度检查结果分析 释放度是评价药物制剂质量的内在指标,释放度与原料、辅料、处方组成、包衣用料、药物晶型、颗粒大小、工艺条件和设备优劣等因素有关,因此释放度数据能反映出制剂的质量情况。各生产企业产品的释放度及相对标准差统计分析结果详见表1。
结果表明,236 批次合格率100%,其中31 号企业产品各批次间释放度RSD值为12.97%(n= 4),是32 家生产企业中差异最大的。该企业有1 批次产品含量不合格,且该批次的释放度也偏低,6 片分别溶出为83%,75%,83%,79%,79%,74%。
2.3.6 含量测定结果分析 236 批次含量测定结果合格率为99.58%,含量测定结果频数分布见图1,各生产企业产品的含量测定结果及其相对标准差统计分析结果详见表1。结果表明,目前市售阿斯匹林肠溶片大多数含量控制稳定。236 批次含量测定结果中不合格1 个批次,平均含量为标示量的78.9%。该企业样品4 批次的平均含量为标示量的91.6%,RSD为8.53%(n= 4),与其他企业比较,该企业产品含量偏低,批间相对标准差偏大。含量测定结果与释放度结果具有相关性,提示该企业产品工艺稳定性可能存在一定问题。
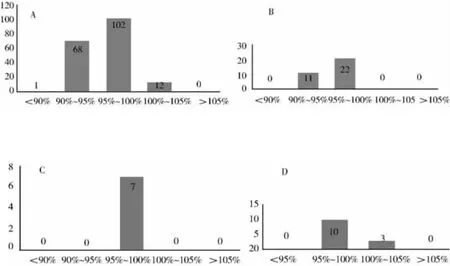
图1 183 批次25 mg(A)、33 批次50 mg(B)、7 批次40 mg(C)、13 批次0.3 g(D)阿司匹林肠溶片含量测定结果频数分布
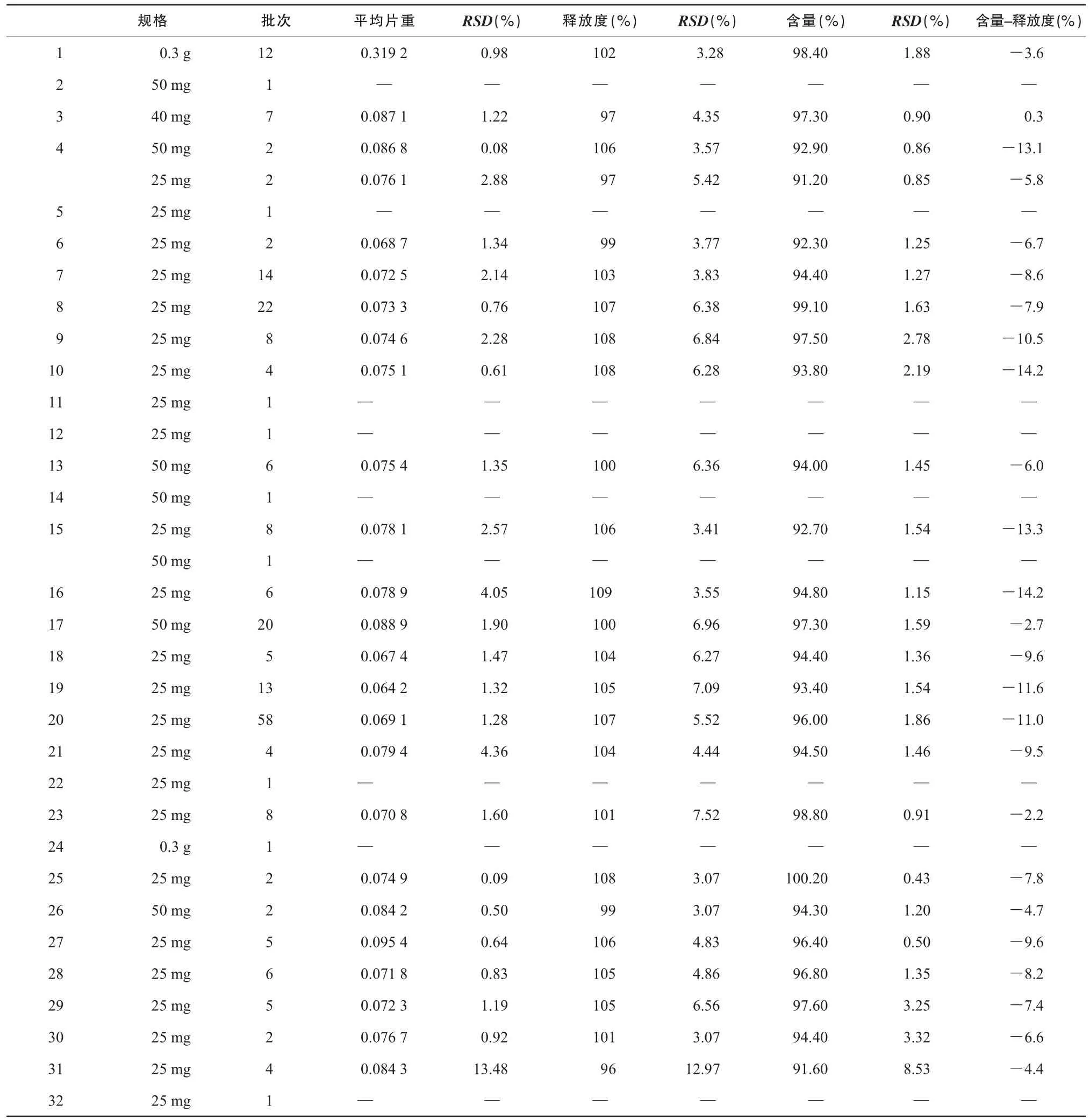
表1 各生产企业产品的测定结果及其相对标准差统计分析
2.4 对检验中发现的问题的分析
将各企业含量测定结果与释放度的对应关系比较详见表1。结果表明,测得释放度为标示量的96% ~109%,而含量测定结果只为标示量的91.6% ~100.2%,含量测定结果与释放度差值较大,最大相差14.2%。实验证明肠溶包衣对释放度的测定干扰很大(约30% ~50%),同时样品溶液及对照品溶液在测定波长(265 ± 2)nm 处也没有最大吸收,这些因素对测定结果影响很大[4]。
3 讨论
3.1 总体评价
以抽验合格率为统计指标,总体质量良好,32 个生产企业的产品236 批次,不合格1 批次,合格率99.58%。本次抽样覆盖面广,从抽样地点来看,涉及30 个省、直辖市、自治区。检验统计结果表明各生产企业工艺稳定,如片重差异、释放度和含量测定结果,同一厂家不同批号样品之间标准偏差较小。但有的企业产品生产工艺稳定性有待加强,但是基本质量可控。
3.2 游离水杨酸检查方法的讨论
阿司匹林(乙酰水杨酸)是以水杨酸为原料,在硫酸催化下经醋酐乙酰化制得。首先,其制剂在生产中因原料未乙酰化完全可能引入水杨酸;其次,阿司匹林极不稳定,在储存中易水解而游离出水杨酸[4]。水杨酸具有一定的刺激性与毒性,因此对阿司匹林肠溶片中的游离水杨酸作限量检查要求,以控制水杨酸的量,保证用药安全。《中国药典》2005 年版(收载规格0.3 g)及《国家药品标准化学药品地方标准上升国家标准》第七册(收载规格25、40 及50 mg)检查游离水杨酸的方法均为比色法,其检查原理是水杨酸分子结构中的酚羟基易与铁盐反应产生紫堇色(阿司匹林不与铁盐反应显色),根据生成颜色的深浅再与定量的对照水杨酸在同等条件下生成的颜色进行比较,从而达到限量控制的目的。该方法为目视比色法,在实际操作中容易出现因加入显色剂的先后、反应速度的快慢、样品辅料的干扰及个人视觉的差异等原因产生误差,特别是颜色相近时误差较大;而且操作繁杂,只能半定量,不易控制。《中国药典》2010 年版采用HPLC 法检查阿司匹林肠溶片中的游离水杨酸。该法专属性强、灵敏度高、快速、准确,可定量地检测出阿司匹林肠溶片中游离水杨酸的含量,为阿司匹林肠溶片的质量控制提供科学依据。
3.3 含量测定方法的讨论
《中国药典》2005 年版(收载规格0.3 g)采用容量法测定阿司匹林的含量,须将样品置研钵中加中性乙醇分次研磨后移入100 mL 容量瓶,研钵用水适量洗涤数次,洗液并入容量瓶中充分振摇,用水稀释至刻度,然后再进行酸碱中和滴定。这不仅费时费力,而且在转移过程中极易造成样品的损失,重现性差。《国家药品标准化学药品地方标准上升国家标准》第七册(收载规格25、40 及50 mg)采用紫外分光光度法测定阿司匹林的含量时,选择296 nm 波长处的吸光度,而在此波长处制剂中的杂质游离水杨酸也有吸收(图2)[4],专属性较差,影响阿司匹林含量测定结果。该方法溶剂用0.1 M 氢氧化钠溶液,而阿司匹林在碱性溶液中不稳定,也可能影响阿司匹林含量测定结果。
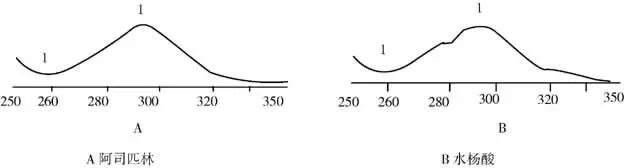
图2 紫外吸收光谱
《中国药典》2010 年版[6]采用HPLC 法测定阿司匹林肠溶片中的阿司匹林含量。该法专属性强、灵敏度高、快速、准确,可定量地检测出阿司匹林肠溶片中阿司匹林的含量,排除了水杨酸及辅料对含量测定的干扰,为阿司匹林肠溶片的质量控制提供科学依据[7]。
[1] 刘杰.阿司匹林药理作用的研究新进展[J]. 中国中医药现代远程教育,2009,1(7):86-87.
[2] 王平. 药品质量控制与质量标准[J]. 中国执业药师,2008,5(7):38-39.
[3] 国家药典委员会.中华人民共和国药典(二部)[S]. 北京:化学工业出版社,2005:284.
[4] 赵爱萍,魏晓慧,丁太刚.HPLC 法测定小剂量阿司匹林肠溶片含量[J].中国药师,2007,10(4):394-395.
[5] 张美雯,许江红,张若良. 阿司匹林肠溶片游离水杨酸检查方法的改进[J].中国药品标准,2008,9(5):378-380.
[6] 国家药典委员会.中华人民共和国药典(二部)[S]. 北京:中国医药科技出版社,2010:385.
[7] 吕红.阿司匹林肠溶片释放度测定方法的改进[J]. 海峡药学,2008,20(6):29-30.
