蕨根淀粉的组分分离和纯化研究
2011-11-17孟凡冰吴应梅
孟凡冰 陈 恋 钟 耕,2 吴应梅,3
(西南大学食品科学学院1,重庆 400716)
(重庆市特色食品工程技术研究中心2,重庆 400716)
(重庆三峡学院生物系3,重庆 404000)
蕨根淀粉的组分分离和纯化研究
孟凡冰1陈 恋1钟 耕1,2吴应梅1,3
(西南大学食品科学学院1,重庆 400716)
(重庆市特色食品工程技术研究中心2,重庆 400716)
(重庆三峡学院生物系3,重庆 404000)
以蕨根淀粉为原料,采用有机溶剂低温重结晶法和凝胶色谱分析对蕨根淀粉的分级和纯化进行了研究。结果表明:用正丁醇重结晶法重结晶 8次和 5次,可以得到高纯度的蕨根直链和支链淀粉。蕨根直链淀粉和支链淀粉与碘络合物的最大吸收波长分别为 640 nm和 547 nm,直链淀粉和支链淀粉的蓝值分别为0.91和 0.13,均处于相应的分布范围,表明纯化后蕨根直链和支链淀粉的纯度高。蕨根直链淀粉和支链淀粉的分子质量范围均小于玉米直链淀粉和支链淀粉。采用分光光度法测定蕨根淀粉含直链淀粉为 25.38%,高于玉米淀粉的 20.33%。
蕨根淀粉 分级 纯化 研究
天然可再生的淀粉是一种混合物。它是由两种不同糖苷键连接而成的淀粉组成,一种是直链淀粉,另一种是支链淀粉[1]。直链淀粉是一种相对分子质量较小的链状分子,而支链淀粉是一种相对分子质量较大、高度分枝的大分子[2]。直链淀粉由于分子排列比较整齐,分子容易相互靠拢重新排列,所以在冷的水溶液中,直链淀粉有很强的凝聚沉淀性能。支链淀粉的分子大,各支链的空间阻碍作用使分子间的作用力减小,而且由于支链的作用,使水分子容易进入支链淀粉的微晶束内,阻碍了支链淀粉分子的凝聚,使支链淀粉不易凝沉[3],工业上常利用这一特性将直链淀粉和支链淀粉分开。淀粉的级分组成、分子结构、相对分子质量分布等对其凝胶特性、流变特性、热特性和形貌有较大影响,从而影响到淀粉食品的深加工[4]。蕨根淀粉为天然的野生植物淀粉,研究证明蕨根淀粉制品具有强身健体、防癌抗癌之功效,开发前景十分广阔[5-6]。我国蕨根资源丰富,开发利用蕨根淀粉资源,将其应用于食品与保健食品中,具有重要的社会意义和经济价值[7]。关于蕨根淀粉的分离纯化、分子结构的基础研究尚未见报道。本试验以蕨根淀粉为原料,分离纯化蕨根直链淀粉和支链淀粉,并预测其相对分子质量范围,为从分子水平了解蕨根淀粉的物化特性提供理论支持。
1 材料与方法
1.1 试验材料与化学试剂
蕨根 (Athyeium.breuifrons)淀粉,自制[6],经测定淀粉纯度为 98.7%,水分质量分数为10.29%;玉米淀粉,华北制药康欣有限公司。
Sepharose CL-2B:瑞典 Phar macia公司,其余试剂均为国产分析纯。
1.2 主要仪器
FA2004A电子天平:上海精天电子仪器有限公司;TGL-16G型离心机:上海安亭科学仪器厂;S53-54型紫外可见分光光度计:上海棱光技术有限公司;HH-4型恒温水浴锅:金坛市富华仪器有限公司;DZF-6020型真空干燥箱:上海精宏试验设备有限公司;漩涡混合器:上海青沪仪器厂;79-1磁力搅拌器:上海金城国胜实验仪器厂;BS2-160自动部分收集器:上海精科实业有限公司;210型酸度离子仪:北京哈纳科仪科技有限公司。
1.3 方法
1.3.1 直链淀粉与支链淀粉的分离纯化
1.3.1.1 直链淀粉与支链淀粉的粗分离
称取 10.0 g淀粉,放入 500 mL烧杯中,加蒸馏水 50 mL使淀粉分散,再加 0.5 mol/L NaOH溶液300 mL。在沸水浴中加热 20~30 min至整个淀粉糊完全透明,冷至室温,离心 (4000 r/min,20 min)除去未分散的不溶性杂质 (沉淀部分)。以 2 mol/L HCL中和离心液至 pH为 6.5~7.5,再加 100 mL正丁醇-异戊醇 (3∶1)混合溶液,然后在沸水浴中加热搅拌10 min至整个体系透明,冷却至室温。移入 2~4℃冰箱中静置 24 h,离心 (6 000 r/min,20 min),沉淀物为粗直链淀粉,上清液即为粗支链淀粉[8-9]。分别收集备用。
1.3.1.2 直链淀粉的纯化
将沉淀物即粗直链淀粉全部移入装有 100 mL 90%的二甲基亚砜溶液中,再加入 200 mL饱和的正丁醇水溶液,然后在沸水浴中加热搅拌至溶液分散透明,冷至室温,在 2~4℃冰箱中保持 24 h,取出离心 (6 000 r/min,30 min),所得的沉淀物按上述步骤重复操作 8次 (即重结晶 8次),然后将沉淀物浸于无水乙醇中 24 h,再反复以无水乙醇洗涤沉淀,该沉淀物于室温下真空干燥,得到纯化的直链淀粉样品,经称量为 1.4 g(干基,下同)。无水乙醇洗涤沉淀的目的是除去直链淀粉中所络合的正丁醇。
1.3.1.3 支链淀粉的纯化
将 1.3.1.1中的粗支链淀粉上清液置于分液漏斗中静置,取下层液加 40 mL正丁醇 -异戊醇 (3∶1)混合液,在沸水浴中加热搅拌至溶液分散透明,冷至室温,移入 2~4℃冰箱中静置 24 h,离心 (6 000 r/min,30 min)去除沉淀物,用上清液重复上述操作 5次 (即重结晶 5次)。上清液加入 2倍体积的无水乙醇沉淀,离心,将沉淀溶于热的 200 mL 0.5 mol/L NaOH溶液中,离心去沉淀,中和。离心液中再加 2倍体积的无水乙醇,将沉淀溶于 200 mL蒸馏水中,用 2倍体积的无水乙醇再沉淀,以无水乙醇洗涤数次,室温下真空干燥得到纯化的支链淀粉样品,经称量为 5.7 g。
1.3.2 凝胶过滤层析
1.3.2.1 淀粉样品溶液的制备
分别称取天然淀粉、直链淀粉和支链淀粉样品 50 mg,用 1 mL无水乙醇湿润,加入 2 mL 2 mol/L NaOH溶液和 5 mL蒸馏水,在沸水浴中加热 20 min,使样品完全溶解后,在 4℃的冰箱中放置 12 h。用1 mol/L的盐酸中和至 pH 7.0左右,最后加蒸馏水将溶液定容至25 mL,此淀粉溶液的浓度为 2 mg/mL[10]。
1.3.2.2 层析条件
选用 Sepharose CL 2B层析柱 (Φ1.3×70 cm),取上述样品溶液 1mL进样,以 0.05 mol/L NaCL(含0.02%叠氮钠)溶液洗脱,洗脱速率 9 mL/h。用自动部分收集器收集洗脱液,每管收集 3 mL,取 1 mL收集液用苯酚 -硫酸比色法 (1 mL 6%苯酚和 5 mL浓硫酸),在 490 nm测定吸光度[11]。
1.3.3 纯化蕨根直链淀粉和支链淀粉碘复合物光谱扫描
准确称取 5 mg样品,加 0.1 mL无水乙醇浸润,再加 0.5 mL 2 mol/L NaOH,充分振荡,室温下放置12 h后,用 HC1将此溶液调至 pH 7.0左右,加水使其体积为 5 mL。此溶液的浓度为 1 mg/mL。取 1 mL淀粉溶液,加 35 mL蒸馏水,用 0.05 mol/L HC1调节至 pH 3.0,加入 0.5 mL碘试剂 (3.6 g碘化钾于20 mL蒸馏水中,加 1.3 g碘,溶解后定容至 100 mL),定容至 50 mL,充分混匀后用 S53-54紫外可见分光光度计于波长 400~800 nm对样品进行吸收光谱扫描测定[12]。
1.3.4 蓝值
称取直链和支链淀粉各 1 mg,用 10 mL蒸馏水溶解,加入 2 mg碘和 20 mg碘化钾,定容至 100 mL,在 680 nm处测定其吸光度。蓝值是表示淀粉结合碘能力的另一个指标,通过测定所形成络合物在一定波长下的光吸收值,按下式计算而得[13]。

1.3.5 直链淀粉含量测定
1.3.5.1 标注曲线的绘制
准确称取 0.100 0 g自制的蕨根标准直链淀粉和支链淀粉,置于 100 mL烧杯中,用 1 mL无水乙醇湿润,加入 1 mol/L氢氧化钠溶液 9 mL,在沸水浴加热至完全分散,迅速冷却后定容至 100 mL;将直链淀粉和支链淀粉分散液及 0.09 mol/L氢氧化钠溶液以一定比例混合;在混合溶液中加入乙酸溶液和碘试剂,显色 10 min后,在 620 nm处测定其吸光度;以吸光度为纵坐标,直链淀粉含量为横坐标,绘制标准曲线得出回归方程。
1.3.5.2 样品测定
准确称取 0.100 0 g淀粉样品,置于 100 mL烧杯中,用 1 mL无水乙醇湿润,加入 1 mol/L氢氧化钠溶液 9 mL,在沸水浴加热至完全分散,迅速冷却后定容至 100 mL;准确吸取 2.5 mL淀粉分散液于 50 mL容量瓶中,加入 0.5 mL 1 mol/L乙酸溶液和 1 mL碘试剂,用漩涡混合器充分混合,加水定容至 100 mL,显色 10 min后,在 620 nm处测定其吸光度[14]。
2 结果与讨论
2.1 影响直链淀粉和支链淀粉分离及纯度的主要因素
影响直链淀粉和支链淀粉分离及纯度的主要因素包括用碱液分散淀粉时的搅拌速度、直链淀粉从盐溶液中分离出来的速度、纯化时正丁醇和水的用量、离心力的大小等。用碱液分散淀粉时的搅拌速度是影响分离效果的主要因素,如果搅拌剧烈,会使整个胶体结构破坏,导致直链淀粉与支链淀粉无法完全分离,所以应用小玻璃棒轻轻搅动最好。直链淀粉在盐溶液中容易老化,一旦老化,分离的直链淀粉即使加热也极难溶解,在多次重结晶的过程中,增大水的用量使直链淀粉的浓度下降,可延缓直链淀粉的老化。离心力的大小和离心的温度也是影响淀粉分离及纯度的主要因素,当离心速度不够或离心温度过高时,离心液会出现混浊现象,直接影响到直链淀粉与支链淀粉的分离,因此,为了使直链淀粉和支链淀粉能够较好的分离,离心速度必须大于 6 000 r/min,离心温度最好控制在 2℃,离心时间最好大于20 min。
2.2 凝胶色谱分析
直链淀粉和支链淀粉不是单一的化合物,化学结构不同,性质也有差异。直链淀粉是葡萄糖通过α-D-1,4-糖苷键连接起来的直链状高分子化合物,在溶液状态下分子伸展,极性基团暴露,空间障碍小,很容易与一些极性有机化合物如正丁醇、异戊醇等通过氢键缔合,形成结晶性化合物而沉淀。而支链淀粉分子除有α-D-1,4-糖苷键外,还存在由α-D-1,6-糖苷键形成的分支结构,在溶液中呈分支状,当溶液中有极性有机化合物存在时,由于有较大的空间位阻,不易形成复合物沉淀。因此,利用这种性质可以对直链淀粉和支链淀粉进行分离。

图 1 蕨根淀粉凝胶色谱图
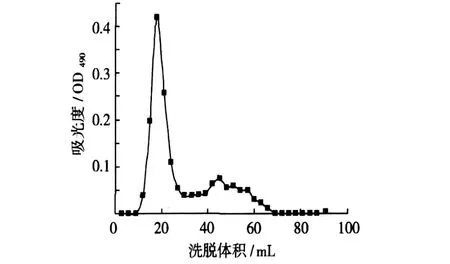
图 2 玉米淀粉凝胶色谱图
直链淀粉和支链淀粉的分子结构和相对分子质量,其中直链淀粉的相对分子质量小,一般在几万到几百万之间,支链淀粉的相对分子质量大,一般在几百万到几亿之间。当淀粉溶液通过层析柱时,分子直径比凝胶孔大的支链淀粉分子不能渗透到凝胶孔内,只经过凝胶颗粒之间的空隙,随洗脱液一起移动,先流出柱外;而分子直径比凝胶孔小的直链淀粉分子,能够进入凝胶相内,不能和洗脱液一样向前移动,移动的速度必然要落后于支链淀粉分子。因此,选用 Sepharose CL-2B(分级范围为 1×105~2×107)对淀粉进行凝胶色谱分析。蕨根淀粉和玉米淀粉的凝胶过滤色谱见图 1和 2。由图可知,蕨根淀粉和玉米淀粉主要有两个级分,分别为支链淀粉和直链淀粉,其中支链淀粉的平均聚合度较直链淀粉大的多。
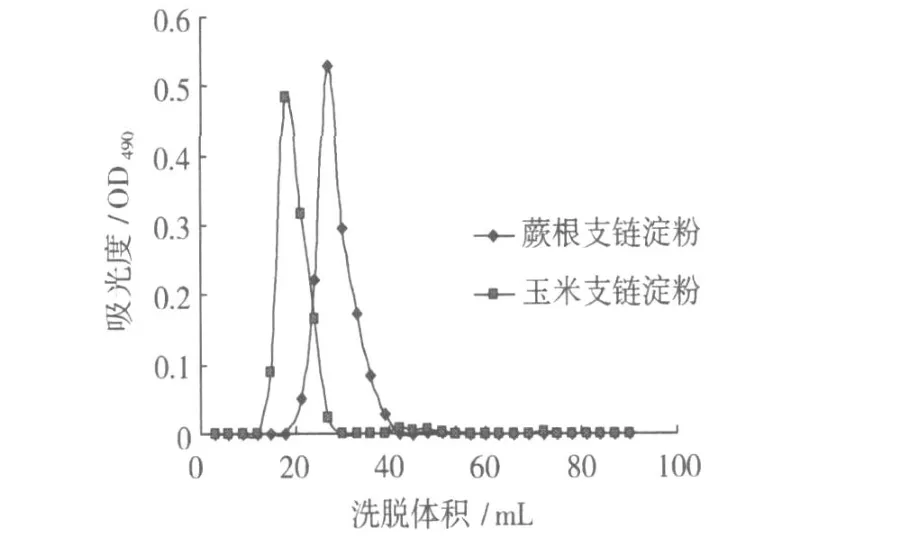
图 3 蕨根支链淀粉和玉米支链淀粉凝胶色谱图
分离纯化的蕨根支链淀粉和玉米支链淀粉 (重结晶 5次)凝胶色谱见图 3。由图 3可知,蕨根支链淀粉和玉米支链淀粉的出峰位置都靠近外水体积,在洗脱体积为 10~50 mL之间出现单一的吸收峰,但蕨根支链淀粉的出峰时间要晚于玉米支链淀粉,说明蕨根支链淀粉相对分子质量要小于玉米支链淀粉,而玉米支链淀粉的相对分子质量范围为 107~109,就是说,蕨根支链淀粉的相对分子质量应小于107~109。在 50 mL以后蕨根支链淀粉和玉米支链淀粉均无吸收峰出现,说明经过 5次重结晶得到的蕨根支链淀粉纯度已经非常高了。

图 4 蕨根直链淀粉和玉米直链淀粉凝胶色谱图
分离纯化的蕨根直链淀粉和玉米直链淀粉 (重结晶八次)凝胶色谱见图 4。由图 4可知,蕨根直链淀粉和玉米直链淀粉在外水体积处均无吸收峰出现,在洗脱体积为 30~70 mL之间出现单一的吸收峰。蕨根直链淀粉的出峰时间要晚于玉米直链淀粉,说明蕨根直链淀粉相对分子质量要小于玉米直链淀粉。经过 8次重结晶可以得到完全纯化的蕨根直链淀粉。
2.3 纯化蕨根直链淀粉和支链淀粉碘复合物吸收光谱
淀粉 -碘复合物的颜色由两种因素决定:一是连续的螺旋直链淀粉片段的平均长度;二是淀粉的结晶程度。直链淀粉在水溶液中并不是线型分子,而是由分子内氢键作用使链卷曲成螺旋状,每个环转含有 6个葡萄糖残基。当直链淀粉遇碘时,每个螺旋吸附 1个碘分子,碘分子位于螺旋中央,借助范德华力联系在一起,形成深蓝色络合物。支链淀粉与碘根据其分支和聚合度的不同而生成紫红 -棕红色,淀粉 -碘络合物吸收峰也随之发生变化。利用淀粉结合碘后所呈现的颜色差异,可以判断所分离淀粉的纯度。直链淀粉与碘生成蓝色,吸收峰在 600~650 nm;支链与碘生成紫红色,吸收峰为 530~590 nm。蕨根直链淀粉和支链淀粉碘复合物在 400~800 nm范围内的紫外可见光吸收图谱见图 5。从图 5可以看出蕨根直链淀粉的最大吸收波长为 640 nm,支链淀粉与碘络合物的最大吸收波长为 547 nm,均在相应的分布范围内,表明纯化后的蕨根直链淀粉和支链淀粉的纯度较高。
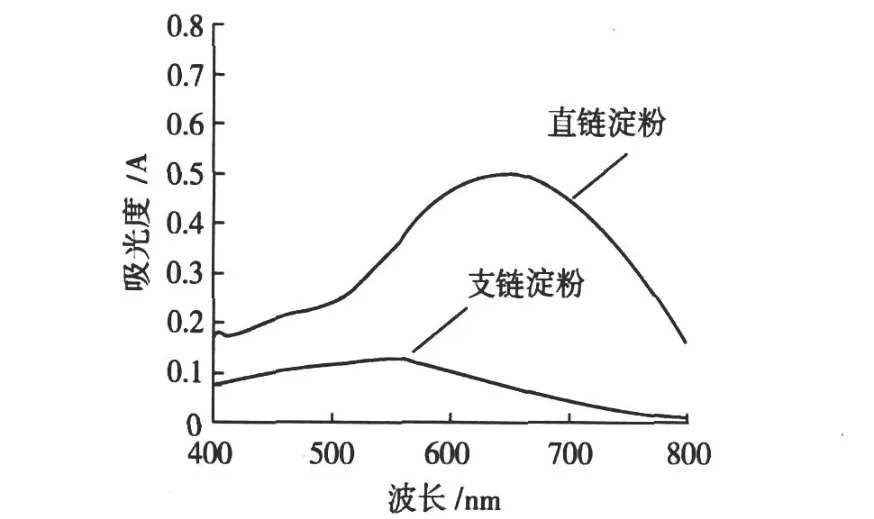
图 5 淀粉碘复合物吸收光谱
2.4 蓝值
直链淀粉和支链淀粉由于它们分子结构和线性聚合度有的差异,所以其蓝值也不同,直链淀粉由于其线性聚合度很高,故蓝值很大,一般为 0.8~1.2,支链淀粉的侧链链长只有 14~30葡萄糖残基,则蓝值在 0.08~0.22之间。试验测得蕨根直链淀粉和支链淀粉的蓝值为分别为 0.91和 0.14,均处于相应的分布范围内,表明纯化后的蕨根直链淀粉和支链淀粉的纯度较高。
2.5 直链淀粉含量测定
用自制蕨根直链淀粉和玉米直链淀粉纯品作标准品,测定不同直链淀粉含量溶液的吸光度,得出标准直链淀粉标准曲线,见图 6和图 7。
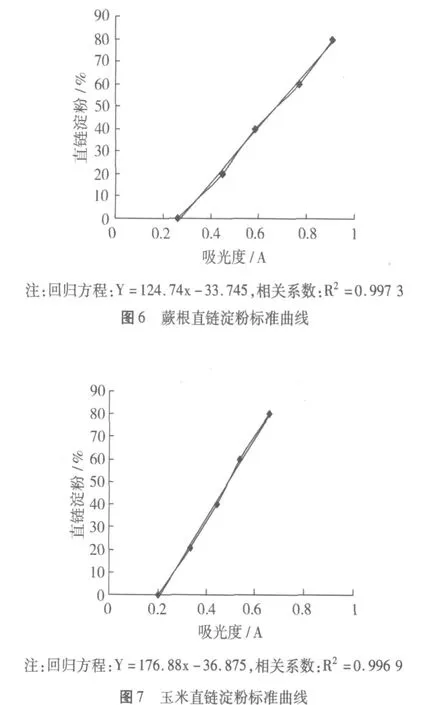
从直链淀粉标准曲线看到,直链淀粉的含量与620 nm处的吸光度呈显著的线性正相关。
在 620 nm处测定淀粉样液的吸光度并计算其直链淀粉含量,结果见表 1。如表 1所示,蕨根淀粉的直链淀粉含量高于玉米淀粉,为 25.38%。

表 1 蕨根淀粉和玉米淀粉吸光度及直链淀粉含量
3 结论
3.1 碱液分散淀粉时的搅拌速度、直链淀粉从盐溶液中分离出来的速度、纯化时正丁醇和水的用量、离心速度和离心时的温度对直链淀粉和支链淀粉的分离及纯度有影响。
3.2 用正丁醇重结晶法重结晶 8次和 5次可以得到纯度较高的蕨根直链淀粉和支链淀粉。凝胶过滤层析表明:蕨根直链淀粉和支链淀粉的相对分子质量均小于玉米直链淀粉和支链淀粉。
3.3 从纯化蕨根直链淀粉和支链淀粉碘复合物吸收光谱看出,蕨根直链淀粉与碘络合物的最大吸收波长为 640 nm,支链淀粉与碘络合物的最大吸收波长为 547 nm,均在相应的分布范围内。
3.4 蕨根直链淀粉和支链淀粉的蓝值分别为 0.91和 0.13,均处于相应的分布范围内,表明纯化后的蕨根直链淀粉和支链淀粉的纯度较高。
3.5 蕨根淀粉和玉米淀粉的直链淀粉质量分数分别为 25.38%和 20.33%,蕨根淀粉的直链淀粉含量较玉米淀粉高。
[1]Lindeboom N,Chang P R,Tyler R T.Analytical,biochemical and physicochemical aspects of starch granule size,with em2 phasis on small granule starches::A review [J].Starch,2004,56(3-4):89-99
[2]Hanashiro I,Takeda Y.Examination of number-average de2 gree of polymerization and molar-based distribution of amy2 lose by fluorescent labellingwith 2-aminopyridine[J].Car2 bohydrate research,1998,306(3):421-426
[3]Fredriksson H,Silverio J,Andersson R,et al.The influence of amylose and amylopectin characteristics on gelatinization and retrogradation properties of different starches[J].Carbohy2 drate polymers,1998,35(2):119-134
[4]洪雁,顾正标,刘晓欣.直链淀粉和直链淀粉纯品的提取及鉴定[J].食品工业科技,2004,(4):86-88
[5]潘航宇.蕨粉与葛粉[J].家庭中医药,2005,12(5):53
[6]钟耕,陈恋,郑红艳,等.蕨根抗性淀粉的制备工艺研究[J].中国粮油学报,2009,24(11):50-55
[7]刘媛,程治英,龙春林,等.蕨类植物的综合利用价值 [J].西南园艺,2006,34(6):39-42
[8]孙成斌.直链淀粉与支链淀粉的差异 [J].黔南民族师范学院学报,2000,(2):36-38
[9]倪小英.浅谈稻米直链淀粉含量的测定[J].粮食科技与经济,2006(4):46
[10]袁建,杨晓蓉,王肇慈.稻米直链淀粉含量测定方法的研究[J].粮食贮藏,2000,(1):38-43
[11]Takeda Y,Hizukuri S,Juliano B O.Purification and struc2 ture of amylose from rice starch[J].Carbohydrate research,1986,148:299-308
[12]杜先峰,王璋,许时婴.葛根直链淀粉和支链淀粉分离纯化的研究[J].食品与发酵工业,1998,24(4):18-21
[13]敖自华,王璋,许时婴,等.银杏淀粉的分离纯化 [J].食品科学,2001,22(1):23-25
[14]FasihuddinB A,PeterA W,Jean-LouisD,et al.Physicochemical characterisation of sago starch[J].carbohydrate polymers,1999,38:361-370
Fractionation and Purification of Fern Root Starch
Meng Fanbing1Chen Lian1Zhong Geng1,2Wu Yingmei1,3
(College of Food Science,Chongqing1400716)
(Engineering Technique Research Center of Chongqing for Special Food2,Chongqing 400716)
(BiologyDepartment,Chongqing Three gorgesUniversity3,Chongqing 404000)
Fern root starch was fractionated and purified by the methods of organic solvent,low temperature re2 crystallization and gel permeation.Results:Pure fern root amylose and amylopectin can be obtained,respectively after 8 times and 5 times recrystallization with n-butyl alcohol solvent.The adsorption wavelengthsλmaxof the amyloseiodine complex and the amylopectin-iodine are 640 nm and 547 nm,respectively,and their blue values are 0.91 and 0.13,respectively,all in corresponding range.It indicates that the fern root amylose and amylopectin obtained are of high-purity.The amylose contents of fern root starch and cornstarch are 25.38%and 20.33%,separately.
fern root starch,fractionation,purification,study
TS236.9
A
1003-0174(2011)01-0056-05
重庆市科技攻关项目(CSTC,2009AC5183)
2009-12-30
孟凡冰,女,1986年出生,硕士,现代食品加工理论与技术
钟耕,男,1964年出生,教授,博士生导师,粮油食品加工、碳水化合物理论与应用研究
