浓缩自体骨髓复合纤维蛋白胶修复兔桡骨陈旧性骨缺损
2011-11-16姚旺祥朱六龙彭兆祥边振宇何其芳
姚旺祥,马 安,朱六龙,陆 凯,朱 敏,彭兆祥,边振宇,何其芳
1杭州市第一人民医院骨科,杭州310006
2浙江省医学科学院寄生虫病研究所诊断室,杭州310003
3上海交通大学医学院附属第九人民医院骨科,上海200011
全世界每年因创伤、肿瘤、感染等原因造成的骨缺损患者超过80万例,其中大段骨缺损是目前骨科临床治疗的难点之一,自体骨移植是解决该问题最理想的方法,但其供给量非常有限,且供区存在发生感染和慢性疼痛等并发症的风险,特别是对于大段骨缺损更显得力不从心。同种异体骨和异种骨也可用于治疗大段、大块骨缺损,但存在传播传染性疾病和排斥反应的缺点,因此寻找安全、有效的生物骨替代材料一直是研究的热点。近年来,随着组织工程学技术的进步,通过体外组织工程技术制备骨替代材料修复临床常见的陈旧性骨缺损、骨不连受到越来越多的关注。而组织工程用种子细胞的获取及其与材料的复合仍是研究的主要内容。如何获得足够、即刻使用的种子细胞及如何使用微创方法修复临床常见的骨缺损都是急需解决的问题[1]。本研究通过浓缩自体骨髓获取骨髓基质干细胞,采用临床广泛使用的纤维蛋白胶 (fibrin glue,FG)作为支架,通过注射这一微创方法修复陈旧性兔桡骨缺损,并初步探讨其促进成骨的机制。
材料和方法
兔桡骨陈旧性骨缺损模型的构建与实验分组6月龄新西兰大白兔36只,雌雄不限,体重 (2100±300)g,购自上海市第九人民医院实验动物中心。采用速眠新、氯胺酮和阿托品复合肌注麻醉。左前肢中段内侧切口,长约3 cm。显露桡骨,分开尺、桡骨间膜,在距肘关节2.5 cm处完整截除带有骨膜的桡骨1.5 cm。两骨断端髓腔用骨蜡封闭,分层缝合切口。术后无外固定,分笼标准饲料喂养,术后每天肌注青霉素40万U 1次,连续3 d。术后1个月拍X线片检查构建模型效果并进行手术修复。
按体重编号,从随机数字表产生36个随机数,将随机数从小到大排列后得序号R,并规定R=1~12者为单纯纤维蛋白胶组 (A组),R=13~24者为纤维蛋白胶复合自体骨髓组 (B组),R=25~36者为纤维蛋白胶复合浓缩自体骨髓组 (C组),每组12只。
浓缩骨髓复合纤维蛋白胶的制作及检测麻醉动物后,自兔双侧髂棘消毒,铺无菌巾。双侧髂骨抽取共约10 ml骨髓。采集的骨髓经过滤,去除脂肪、骨屑等。通过Ficoll密度梯度离心法,采用血液成分分离机 (Eppendorf Centrifuge 5417R,德国Eppendorf公司),4℃下3500 r/min(r=8.5 cm)离心8 min,去除红细胞、多核细胞、血清和细胞碎片,收集到2~3 ml骨髓有核细胞悬液备用。
10只动物的浓缩骨髓1 ml,取0.5 ml行血细胞计数,评价浓缩前后的有核细胞数量变化。另外0.5 ml浓缩骨髓做体外培养,隔日半量换液去除不贴壁细胞,9 d后对细胞集落形成单位计数,并行碱性磷酸酶染色评价其活性。
所用纤维蛋白胶由哈尔滨瀚邦医疗科技有限公司生产 [药品注册证号:国药管械 (准)字2003第3650152号]。将浓缩骨髓无菌条件下与催化液混匀,使细胞终浓度为5×106/ml,分别将等量的主体胶溶液与含有浓缩骨髓的催化剂溶液加入双腔注射器针管中。行骨髓注射前取少许浓缩骨髓纤维蛋白胶混合物行电镜观察,并行细菌学培养及长期培养细胞检验有无致瘤性。
浓缩骨髓复合纤维蛋白胶修复陈旧性骨缺损麻醉下用11号针头穿入左侧桡骨骨缺损区,针尖多点穿刺,并剥离瘢痕组织,使之松解,以利浓缩骨髓复合物均匀渗入,推动共用的推液器使两种溶液在双腔注射器针头部等量均匀混合后注射入兔桡骨缺损中,注入约2.0~2.5 ml[(10~15)×106]为C组,退出时边退边做轻度的前后抽动,使穿刺通道被周围组织填充。B组每只注射自体骨髓与纤维蛋白胶的复合物,A组单纯注射纤维蛋白胶。术后无外固定,分笼标准饲料喂养,术后每天肌注青霉素40万U 1次,连续3 d。
放射学评价各组分别于术后4、8、12周摄X线片观察骨缺损区新骨形成情况。(投照距离1 m,投照条件46 kV,50 mA,曝光时间0.14 s),观察骨缺损愈合情况。所有照片依据Yang等[2]的评分标准进行放射学评分。
组织学评价严密观察新西兰大白兔的一般情况。术后4、8、12周处死动物取标本行硬组织切片,苦味酸-品红染色及脱钙后石腊包埋切片,HE染色观察成骨情况,并观察有无异物排斥反应。
统计学处理采用SPSS 10.0统计软件,数据以±s表示,B、C两组在8、12周2个时间点的评分差异用2×2析因设计方差分析,各组各时间点的差异以LSD法行多重比较,P<0.05为差异有统计学意义。
结 果
浓缩后细胞数量的变化浓缩后,骨髓中有核细胞数量由 (4.5±1.0)×106/ml提高至 (29.0±2.3)×106/ml,细胞集落形成单位由 (178±98)/ml浓缩至 (424±145)/ml,碱性磷酸酶染色显示为强阳性 (图1)。
细菌学培养结果及长期培养结果所有混合物细菌学培养均为阴性。长期培养,传5代后均未见细胞形态、生物学性状改变。
复合物的电镜观察单纯纤维蛋白胶固化后在电镜下观察见孔隙均匀,孔孔相通,有利于细胞的营养交换 (图2)。浓缩骨髓与纤维蛋白胶混合后,光镜下见有核细胞与胶混合较均匀 (图3);电镜下见复合物表面布满小孔,细胞黏附于其上 (图4);4 h后电镜观察见细胞伸出伪足,与胶相容性良好 (图5)。
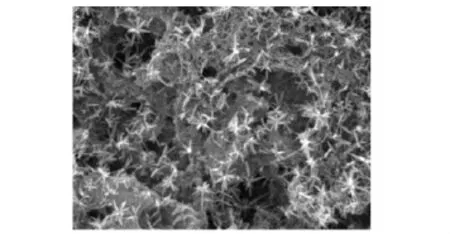
图2 纤维蛋白胶凝胶扫描 (×8500)Fig 2 Electron microscopy of the fabrin glue gelatination(×8500)
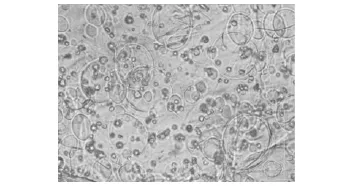
图3 浓缩骨髓与纤维蛋白胶混合物 (×200)Fig 3 Compounds of enriched bone marrow and fibrin glue(×200)
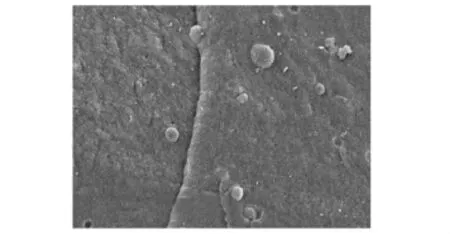
图4 浓缩骨髓与纤维蛋白胶混合物扫描 (×500)Fig 4 Electron microscopy of the compounds of enriched bone marrow and fibrin glue(×500)
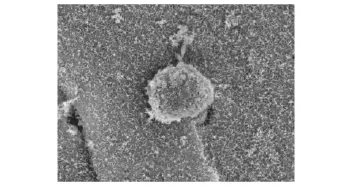
图5 骨髓有核细胞伸出伪足 (×2000)Fig 5 Pedes spurii of the bone marrow nucleated cells(×2000)
X线观察术后4周,3组均未见骨缺损的修复。术后8周,C组见缺损区内少许高密度影,两断端稍模糊,桡骨外部骨痂较多,缺损处内侧尺骨皮质密度增高;B组见两断段有新生骨向骨缺损区生长,缺损区内侧尺骨皮质旁密度稍增高。术后12周,C组骨缺损处呈均匀一致高密度影,双侧骨皮质连续,与断端分界不清,骨缺损已塑型改造,髓腔贯通;B组亦见骨缺损的修复,骨痂较成熟,髓腔贯通不明显。A组在观察时间点内均未见骨缺损的修复 (图6)。
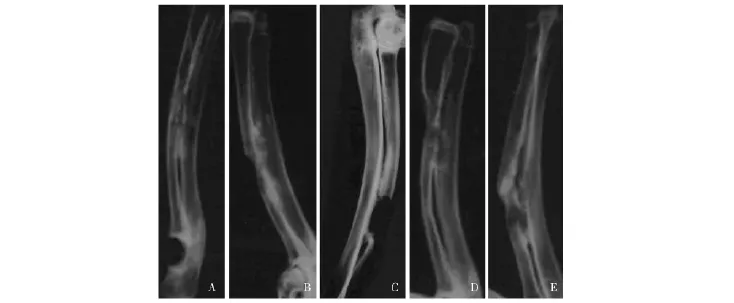
图6 术后各组X线片,因骨髓、纤维蛋白胶均不显影,故3组均表现为骨缺损Fig 6 X-ray of each group after operation,bone defects were equally found in three groups due to the nonvisulization of both bone marrow and fibrin glue
术后8、12周,C组的 Yang氏评分分别为(9.348±0.364)和 (12.664±0.388)分,明显高于B组的 (7.984±0.229)分 (F=40.167,P=0.001)和 (10.584±0.836)分 (F=20.3647,P=0.004)。B组(F=36.004,P=0.001)和C组(F=155.141,P=0.000)术后12周的Yang氏评分均明显高于术后8周。时间点与浓缩与否之间存在的交互效应差异也有统计学意义 (F=1.978,P=0.185)。
硬组织切片观察术后4周,因取标本见无肉眼可见成骨,标本被软组织及纤维蛋白胶包裹,故未行硬组织切片。HE染色在C组见部分幼稚的骨组织与大量软骨样组织,较多纤维蛋白胶未降解 (图7)(纤维蛋白胶由于在制片时流失,故表现为组织间的空白部分);B组见少许幼稚的骨组织与部分软骨样组织 (图8)。8周时硬组织切片在C组可见桡骨断端有部分成骨,为较幼稚的骨组织,可见新生血管 (图9);B组亦见少量较幼稚的成骨 (图10)。12周时见C组成骨较成熟 (图11),骨细胞排列较整齐,髓腔及新骨中仍有少许未降解的纤维蛋白胶参杂于其中,新骨在塑型中;而B组见断端有较多成骨 (图12),仍有未降解纤维蛋白胶,成骨多为黄绿色的未矿化的类骨质。A组各时间点均未见明显成骨。
讨 论
组织工程技术采用种子细胞复合支架材料,可构建即时使用的骨修复材料,为骨缺损的修复提供全新的手段,具有广泛的应用前景[3]。Connolly等[4]采用自体骨髓注射成功治疗20例胫骨骨不连,证实了自体骨髓的成骨作用。骨髓是唯一含有丰富定向性和诱导性骨祖细胞的组织,其所含有的骨髓基质干细胞诱导性或成骨活性最强[5]。Hernigou等[6]将自体骨髓通过细胞分离器浓缩后注射入胫骨萎缩性骨不连患者,证明其有效性与移植骨髓中基质细胞的数量有关,不经浓缩处理,其基质细胞数量并不能达到治疗骨不连的理想数目。
目前组织工程用种子细胞多采用体外采集培养扩增方法,在临床应用时要使患者等待一段时间才能使用;且体外培养必须避免各种微生物的污染,对环境及实验条件要求较高[7]。而采用浓缩自体骨髓技术获取骨髓有核细胞,对于临床应用而言,最大的优势在于即时、微创、有效性提高。
FG本身也是一种优良的骨修复材料,Pei等[8]提取自体膝关节滑膜细胞与FG复合后旋转培养1个月,见细胞保持原有形态,将其与材料复合后成功修复了兔股骨髁的骨软骨缺损。Abiraman等[9]将FG包被羟基磷灰石颗粒、生物活性玻璃陶瓷和磷酸钙硅酸钙系统分别植入鼠股四头肌,以未包被材料作为对照,结果表明FG可能有骨诱导作用。FG可以促进形成新的毛细血管及胶原沉积,这也将有利于骨形成[10]。
本研究通过使用可注射的纤维蛋白,在复合物混合均匀时即成凝胶,4h后电镜观察见细胞大量附着,伸出伪足,证实纤维蛋白胶与骨髓有核细胞相容性良好,为细胞提供了附着及生长所必需的支架,避免了单纯骨髓注射时有核细胞浓度下降。本研究利用纤维蛋白胶形成凝胶前两种成分 (纤维蛋白原和凝血酶)均为流体的特点,将浓缩的骨髓有核细胞作为种子细胞先加入纤维蛋白原溶液中,这使种子细胞的复合变得简单易行,且细胞负载率高。
关于凝胶的降解问题,文献报道一般在1周开始降解,1个月内降解完毕,但这都是在血运丰富的组织中得到的数据[11]。本研究观察到,1个月时见大量纤维蛋白胶未降解,被新生骨组织包绕,在2个月时仍可见未降解的纤维蛋白胶,这可能与混合物被种植于硬的骨组织之间,延缓了降解有关。纤维蛋白胶的延缓降解有利于复合的细胞及细胞因子的释放,从而与成骨同步起来[12]。
利用Yang评分代表局部骨缺损新骨形成的量,从而达到量化,可以进行更准确的比较。本研究通过放射学方法证明,对兔桡骨骨缺损8、12周时的成骨能力而言,浓缩骨髓复合纤维蛋白胶移植组的成骨能力>单纯骨髓复合纤维蛋白胶组>单纯纤维蛋白胶组。因为组织工程骨的成骨一般需要经过软骨内化骨的过程,在1个月时骨的成熟不明显,故在4周内3组的区别不明显。
综上,本研究结果证实,浓缩自体骨髓复合纤维蛋白胶可修复兔桡骨骨缺损,且具有可注射使用、体内成形、生物相容性好等优点,随着研究的不断深入,有望在骨不连、骨缺损修复领域发挥重要作用。
[1]Martins AM,Pham QP,Malafaya PB,et al.Natural stimulus responsive scaffolds/cells for bone tissue engineering:influence of lysozyme upon scaffold degradation and osteogenic differentiation of cultured marrow stromal cells induced by CaP coatings[J].Tissue Eng Part A,2009,15(8):1953-1963.
[2]Yang CY,Simmons DJ,Lozano R.The healing of grafts combining freeze-dried and demineralized allogeneic bone in rabbits [J].Clin Orthop Relat Res,1994(298):286-295.
[3]Betz OB,Betz VM,Abdulazim A,et al.Healing of large segmental bone defects induced by expedited bone morphogenetic protein-2 gene-activated,syngeneic muscle grafts[J].Hum Gene Ther,2009,20(12):1589-1596.
[4]Connolly JF,Guse R,Tiedeman J,et al.Autologous marrow injection as a substitute for operative grafting of tibial nonunions [J].Clin Orthop Relat Res,1991(266):259-270.
[5]Lacerda SA,Lanzoni JF,Bombonato-Prado KF,et al,Osteogenic potential of autogenous bone associated with bone marrow osteoblastic cells in bony defects:a histomorphometric study [J].Implant Dent,2009,18(6):521-527.
[6]Hernigou P,Poignard A,Beaujean F,et al,Percutaneous autologous bone-marrow grafting for nonunion.Influence of the number and concentration of progenitor cells [J].J Bone Joint Surg Am,2005,87(7):1430-1437.
[7]Lee K,Goodman SB.Cell therapy for secondary osteonecrosis of the femoral condyles using the Cellect DBM System:a preliminary report[J].J Aarthroplasty,2009,24(1):43-48.
[8]Pei M,He F,Boyce BM,et al,Repair of full-thickness femoral condyle cartilage defects using allogeneic synovial cell-engineered tissue constructs [J].Osteoarthritis Carti-lage,2009,17(6):714-722.
[9]Abiraman S,Varma HK,Umashankar PR,et al.Fibrin glue as an osteoinductive protein in a mouse model[J].Biomaterials,2002,23(14):3023-3031.
[10]Ornelas L,Padilla L,Di Silvio M,et al.Fibrin glue:an alternative technique for nerve coaptation-Part I.Wave amplitude,conduction velocity,and plantar-length factors [J].J Reconstr Microsurg,2006,22(2):119-122.
[11]Yamada Y,Boo JS,Ozawa R,et al,Bone regeneration following injection of mesenchymal stem cells and fibrin glue with a biodegradable scaffold [J].J Craniomaxillofac Surg,2003,31(1):27-33.
[12]Itosaka H,Kuroda S,Shichinohe H,et al,Fibrin matrix provides a suitable scaffold for bone marrow stromal cells transplanted into injured spinal cord:a novel material for CNS tissue engineering [J].Neuropathology,2008,29(3):248-257.
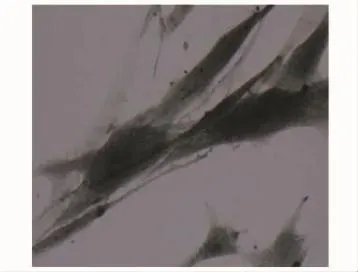
图1 碱性磷酸酶染色 (×40)Fig 1 Alkaline phosphatase staining(×40)
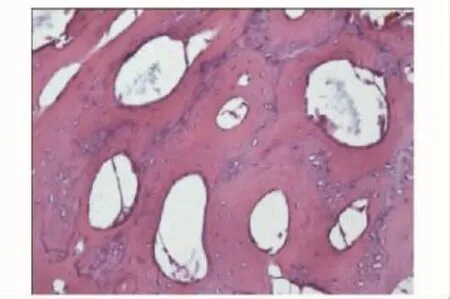
图7 C组4周 (HE,×200)Fig 7 Four weeks in group C(HE, ×200)
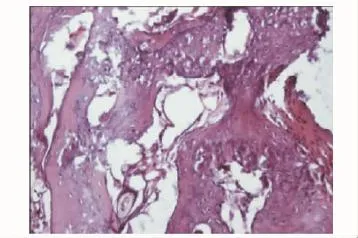
图8 B组4周 (HE,×200)Fig 8 Four weeks in group B(HE,×200)
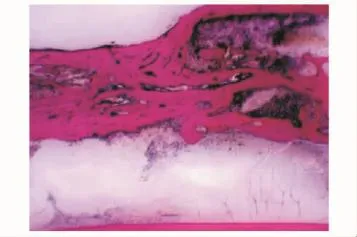
图9 C组8周 (Van Gieson,×1)Fig 9 Eight weeks in group C(van Gieson, ×1)
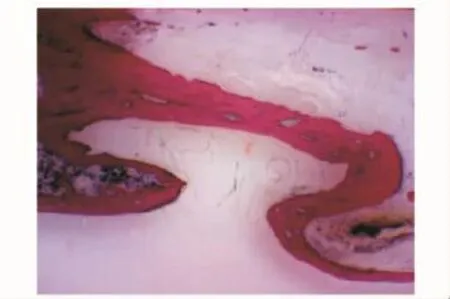
图10 B组8周 (Van Gieson,×1)Fig 10 Eight weeks in group B(van Gieson, ×1)
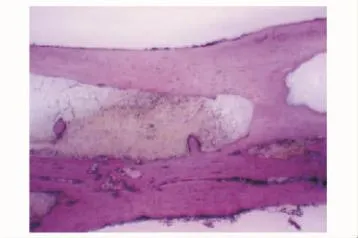
图11 C组12周 (Van Gieson,×1)Fig 11 Twelve weeks in group C(van Gieson, ×1)
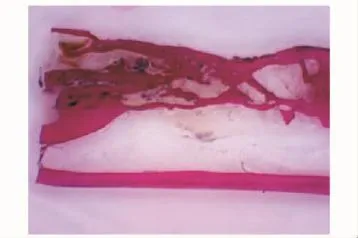
图12 B组12周 (Van Gieson,×1)Fig 12 Twelve weeks in group B(van Gieson, ×1)
