燃煤型氟中毒对大鼠睾丸组织氧化应激效应的影响
2011-11-16肖跃海李崇斌石家齐官志忠于燕妮
肖跃海,孙 发,李崇斌,石家齐,谷 江,谢 春,官志忠,于燕妮
1贵阳医学院附属医院泌尿外科,贵阳550004
2贵阳医学院公共卫生学院,贵阳550004
3贵阳医学院分子生物学实验室,贵阳550004
4贵阳医学院附属医院病理科,贵阳550004
燃煤型氟中毒是我国特有的一种氟中毒,涉及贵州、云南、四川等14个省、市及自治区,200个病区县,34 915个病区村,病区村人口达3430.36万人[1]。以往研究表明,机体摄入过量氟可导致睾丸生精功能降低,使精液质量下降,不育率升高[2]。但氟中毒对生殖系统的损害机制尚不十分明确。有学者提出氧化应激可能是氟中毒机制中的一个重要环节,认为过量氟导致机体氧化系统/抗氧化系统失衡,氧自由基代谢紊乱,对靶器官组织产生了氧化应激损伤[3]。本研究采用贵州省六盘水市氟中毒病区煤烘玉米加工的饲料来复制氟中毒模型,研究氧化应激在燃煤型氟中毒睾丸组织损伤中的作用,以期为氟生殖毒性机制的研究和防治提供理论依据。
材料和方法
试剂和仪器超氧化物歧化酶 (superoxide dismutase,SOD)测定试剂盒、丙二醛 (malondialdehyde,MDA)测定试剂盒、一氧化氮合酶 (nitric oxide synthase,NOS)分型测定试剂盒、考马斯亮蓝测定试剂盒均由南京建成生物工程研究所提供,721分光光度计购自上海青华科技仪器有限公司,高速冷冻离心机购自美国BECKMAN公司。
模型制备及分组清洁级雄性SD大鼠40只,体重90~110 g,由贵阳医学院实验动物中心提供[SCXK(渝)2007-0005]。随机分为对照组、低氟组、中氟组、高氟组4组,每组10只。对照组给予正常饲料 (实验动物中心提供,饲料中平均含氟量为1.3 mg/kg),低、中、高氟组分别喂饲含25%、50%、75%的病区煤烘玉米配制的饲料 (病区煤烘玉米含氟量均值为80 mg/kg),制作燃煤型氟中毒模型。自由饮用自来水。分别于染毒120、180 d分批处死动物,各时点每组随机抽出5只通过股动脉放血法处死。
大鼠氟斑牙分度分别于120、180 d分批观察各组大鼠氟斑牙出现情况,并参考氟斑牙分度标准[4]给予分度。
大鼠尿氟浓度测定分别于实验120、180 d后置大鼠于代谢笼,收集每只大鼠24 h尿,采用氟离子选择电极法测定尿氟水平。
睾丸组织病理学检测将睾丸组织采用10%中性甲醛固定、石蜡包埋、脱水、HE染色,光镜下观察睾丸组织病理形态改变。
睾丸组织匀浆制备处死动物后,迅速取出睾丸,用生理盐水洗去血液,剪开睾丸白膜,称取部分睾丸组织,以生理盐水为介质,二者重量/体积比为1∶9,于冰上迅速制成10%组织匀浆液,3000 r/m(r=13.5 cm)离心10 min,取上清液,4℃保存。部分组织采用10%中性甲醛固定,部分组织置于液氮中冻存备用。
睾丸匀浆MDA含量、SOD、总一氧化氮合酶、诱导型一氧化氮合酶测定采用硫代巴比妥酸显色法测定MDA含量,黄嘌呤氧化酶法测定SOD、化学比色法测定总NOS(T-NOS)和诱导型NOS(iNOS)活性。睾丸组织匀浆蛋白含量测定采用考马斯亮蓝法,具体操作严格按试剂盒说明书进行。
睾丸组织氟含量的测定称取干燥至恒重的睾丸组织0.5 g,采用酸浸-氟离子选择电极法[5]测定睾丸组织氟含量。
统计学处理采用SPSS 11.5统计软件,数据以均数±标准差表示,多组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
氟斑牙发生情况90 d开始出现氟斑牙,同一染氟时间段,各染氟组大鼠氟斑牙严重程度为:高氟组>中氟组>低氟组,对照组全部正常。同一染氟组180 d大鼠氟斑牙的严重程度重于120 d(表1)。
尿氟检测各染氟组大鼠尿氟均明显高于对照组 (P<0.05或P<0.01);在同一阶段中,尿氟随染氟剂量的增加而增加 (P<0.05或P<0.01);各染氟组180 d尿氟均明显高于同组120 d尿氟,(P<0.05或P<0.01)(表2)。
睾丸组织氟含量各染氟组大鼠睾丸组织氟含量明显高于对照组 (P均<0.01),且各染氟组间差异有统计学意义 (P均<0.01);高氟组180 d睾丸氟含量明显高于120 d(P<0.01)(表3)。
组织学观察各染氟组生精小管结构出现不同程度破坏,各级生精细胞结构疏松、紊乱,细胞肿胀,体积增大,胞浆空泡样变性,部分细胞坏死,损伤程度随染氟剂量的增加而加重 (图1)。
睾丸组织中SOD活性、MDA含量、T-NOS和iNOS检测结果
SOD:120 d和180 d时,各染氟组大鼠睾丸SOD活性较对照组明显降低 (P<0.05或P<0.01);染氟组SOD活力随染氟剂量的增加呈降低趋势,各染氟组间差异有统计学意义 (P<0.05或P<0.01)(表 4、5)。
MDA:120 d和180 d时,各染氟组大鼠睾丸MDA含量均明显高于对照组(P均<0.01)。随喂养时间推移,各染氟组大鼠睾丸MDA含量呈上升趋势,差异有统计学意义 (P均<0.01)(表4、5)。
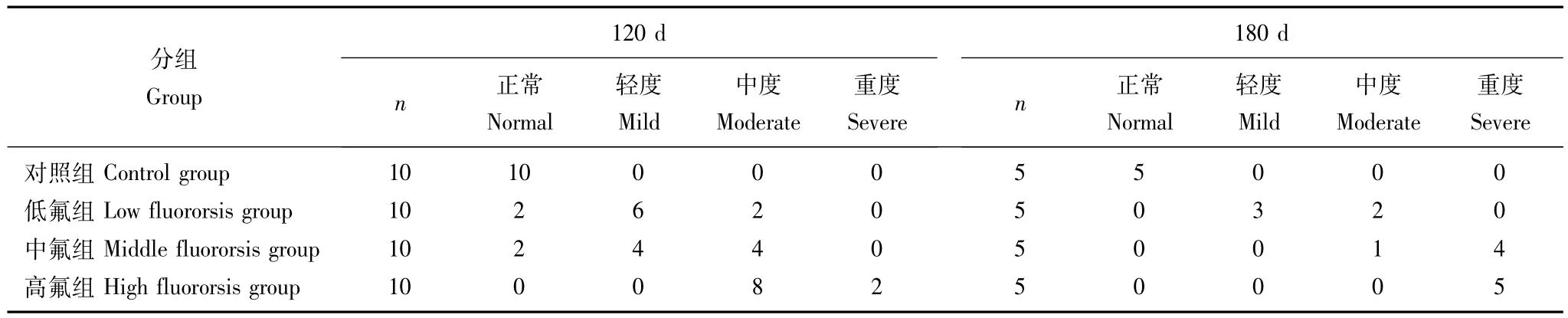
表1 各组大鼠氟斑牙分度结果Table 1 Dental fluorosis in three groups
表2 各组大鼠尿氟含量 (n=5,±s,mg/kg)Table 2 Urine fluorine from 120 d to 180 d in three groups(n=5,±s,mg/kg)
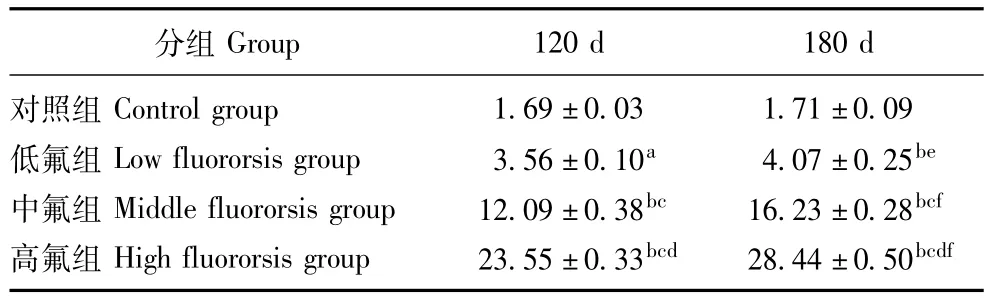
表2 各组大鼠尿氟含量 (n=5,±s,mg/kg)Table 2 Urine fluorine from 120 d to 180 d in three groups(n=5,±s,mg/kg)
与对照组比较,aP<0.05,bP<0.01;与低氟组比较,cP<0.05;与中氟组比较,dP<0.05; 与120 d比较,eP<0.05,fP <0.01aP<0.05,bP <0.01 compared with control group;cP <0.05 compared with low fluororsis group;dP<0.05 compared with middle fluororsis group;eP<0.05,fP <0.01 compared with 120 d
Group 120 d 180 d对照组 Control group 1.69±0.03 1.71±0.09低氟组 Low fluororsis group 3.56±0.10a 4.07±0.25be中氟组 Middle fluororsis group 12.09±0.38bc 16.23±0.28bcf高氟组 High fluororsis group 23.55±0.33bcd 28.44±0.50分组bcdf
表3 各组大鼠睾丸氟含量 (n=5,±s,mg/kg)Table 3 Testis fluorine from 120 d to 180 d in three groups(n=5,±s,mg/kg)
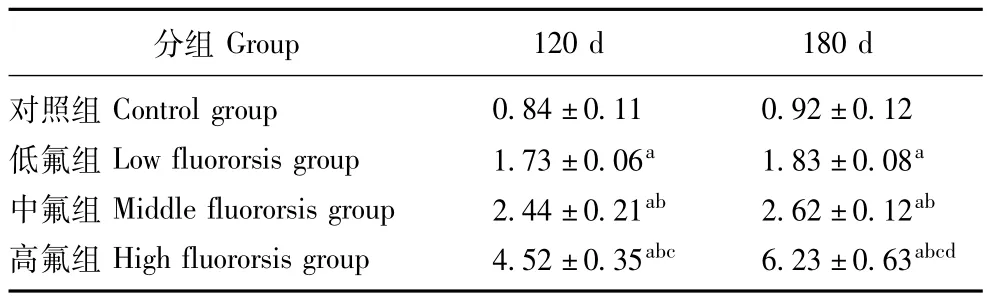
表3 各组大鼠睾丸氟含量 (n=5,±s,mg/kg)Table 3 Testis fluorine from 120 d to 180 d in three groups(n=5,±s,mg/kg)
与对照组比较,aP<0.01;与低氟组比较,bP<0.01;与中氟组比较,cP<0.01;与120 d比较,dP<0.01aP<0.01 compared with control group;bP<0.01 compared with low fluororsis group;cP<0.01 compared with middle fluororsis group;dP<0.01 compared with 120 d
Group 120 d 180 d对照组 Control group 0.84±0.11 0.92±0.12低氟组 Low fluororsis group 1.73±0.06a 1.83±0.08a中氟组 Middle fluororsis group 2.44±0.21ab 2.62±0.12ab高氟组 High fluororsis group 4.52±0.35abc 6.23±0.63分组abcd
T-NOS:120 d和180 d时,各染氟组大鼠睾丸组织的T-NOS活力均明显高于对照组 (P<0.05或P<0.01),染氟组T-NOS活力随染氟剂量的增加而呈升高趋势,差异有统计学意义 (P<0.05或P<0.01)(表4、5)。
iNOS:120和180 d时,各染氟组大鼠睾丸组织的iNOS活力均明显高于对照组 (P均<0.01),各染氟组iNOS活力随染氟剂量的增加而呈上升趋势,差异有统计学意义 (P均<0.01)(表4、5)。
讨 论
氟中毒对睾丸影响的机制目前尚不不明确,有学者提出氧化应激学说,认为氧化应激是氟中毒机制中一个重要的环节[3],Ghosh等[6]等研究了饮水型氟中毒对睾丸组织氧化应激效应,发现过量氟所致的生殖系统毒性效应与睾丸氧化应激密切相关。笔者的前期研究显示,燃煤型氟中毒与其他类型氟中毒相似,均可影响睾丸的生精功能。本研究显示,各染氟组睾丸内氟含量均明显高于对照组,并随染氟剂量的增加而增高;各染氟组大鼠睾丸生精小管均出现不同程度的病理损伤,其损伤程度亦随染氟剂量的增加而加重,与经饮水染氟的相关报道相似[6-8]。
SOD是重要的酶类抗氧化剂,是清除活性氧的重要物质之一,对机体的氧化和抗氧化平衡起着非常重要的作用,可保护机体免受氧化损伤,被称为体内抗氧化系统的第一道防线,SOD的活性可以反映组织的抗氧化能力。本研究结果显示,各染氟组SOD活力均较对照组显著降低,与梁刚等[9]对饮水加氟动物模型研究的结果类似,各染氟组SOD活力随染氟剂量的增加呈降低趋势,提示燃煤型氟中毒可导致睾丸的抗氧化能力降低,并与摄氟剂量密切相关。
MDA是脂质过氧化物生成的产物,其含量可间接反映睾丸组织自由基的水平和脂质过氧化程度,同时也反映了睾丸生殖细胞的受损程度。本研究结果表明,染氟组睾丸组织MDA含量较对照组明显增加,且随染氟剂量的增加呈上升趋势,与梁刚等[9]和安丽等[10]饮水中加氟化钠所得的结果相似,因此推测燃煤型氟中毒可使睾丸中的过氧化产物量增加,损害睾丸生殖细胞。
NOS分iNOS、神经元型NOS(nNOS)和内皮型NOS(eNOS)3种亚型,其中iNOS生理条件下表达极少,但当机体内存在诱生因素,氧化应激状态下iNOS表达增加,iNOS活性升高。通过测定FNOS和iNOS活性可反映睾丸组织合成NO的能力。NO是具有生物活性的自由基之一,与氧自由基关系密切。本研究结果显示,各染氟组大鼠睾丸组织的NOS活性和iNOS活性均较对照组显著升高,与陈树君等[8]和李积胜等[11]的研究结果类似,提示燃煤型氟中毒大鼠睾丸组织中NO的合成能力增强,进一步表明燃煤型氟中毒大鼠睾丸组织中氧化应激效应增强。
表4 120 d后各组大鼠睾丸组织中SOD、T-NOS、iNOS活性和MDA含量比较 (n=5,±s)Table 4 Comparison of testis SOD,T-NOS,iNOS activities,and MDA content among groups after having been fed for 120 days(n=5,±s)

表4 120 d后各组大鼠睾丸组织中SOD、T-NOS、iNOS活性和MDA含量比较 (n=5,±s)Table 4 Comparison of testis SOD,T-NOS,iNOS activities,and MDA content among groups after having been fed for 120 days(n=5,±s)
SOD:超氧化物歧化酶;MDA:丙二醛;T-NOS:总一氧化氮合酶;iNOS:诱导型一氧化氮合酶;与对照组比较,aP<0.05,bP<0.01;与低氟组比较,cP <0.05,dP<0.01; 与中氟组比较,eP<0.05,fP <0.01SOD:superoxide dismutase;MDA:malondialdehyde;T-NOS:total nitric oxide synthase;iNOS:iducible nitric oxidase synthase;aP<0.05,bP<0.01 compared with control group;cP <0.05,dP <0.01 compared with low fluororsis group;eP <0.05,fP <0.01 compared with middle fluororsis group
分组Group SOD(U/mgprot)MDA(nmol/mgprot)T-NOS(U/mgprot)iNOS(U/mgprot)对照组 Control group 154.1±9.02 3.25±0.16 2.06±0.09 0.84±0.06低氟组 Low fluororsis group 145.7±9.91a 3.80±0.29b 2.38±0.12a 1.02±0.11b中氟组 Middle fluororsis group 133.3±7.72ac 4.44±0.35bd 2.94±0.29bd 1.34±0.07bd高氟组 High fluororsis group 113.2±5.00bde 4.94±0.13bdf 3.52±0.17bdf 1.64±0.07bdf
表5 180 d后各组大鼠睾丸组织中SOD、T-NOS、iNOS活性和MDA含量比较 (n=5,±s)±s)Table 5 Comparison of testis SOD,T-NOS,iNOS activities,and MDA content among groups after having been fed for 180 days(n=5,

表5 180 d后各组大鼠睾丸组织中SOD、T-NOS、iNOS活性和MDA含量比较 (n=5,±s)±s)Table 5 Comparison of testis SOD,T-NOS,iNOS activities,and MDA content among groups after having been fed for 180 days(n=5,
与对照组比较,aP<0.05,bP<0.01;与低氟组比较,cP<0.01;与中氟组比较,dP<0.05,eP<0.01aP<0.05,bP<0.01 compared with the control group;cP<0.01 compared with the low fluororsis group;dP<0.05,eP<0.01 compared with the middle fluororsis group
分组Group SOD(U/mgprot)MDA(nmol/mgprot)T-NOS(U/mgprot)iNOS(U/mgprot)对照组 Control group 153.0±8.01 3.34±0.18 2.10±0.04 0.86±0.06低氟组 Low fluororsis group 136.4±6.81b 3.90±0.20b 2.45±0.14a 1.16±0.07b中氟组 Middle fluororsis group 102.2±8.08bc 4.50±0.14bc 3.07±0.28bc 1.44±0.06bc高氟组 High fluororsis group 88.5±10.47bcd 5.01±0.11bce 3.69±0.25bce 1.67±0.08bce
在正常生理条件下,男性生殖系统中活性氧的产生和清除维持在平衡状态,如果活性氧产生超过临界水平就会引起氧化应激状态,损害生精细胞,导致精子产生和成熟障碍,从而导致不育[12]。本研究结果表明,染氟剂量与睾丸氟含量、睾丸组织病理学损伤程度和氧化活力升高程度呈正相关,而与抗氧化能力的降低呈负相关,说明燃煤型氟中毒可引起大鼠睾丸组织中氧化系统与抗氧化系统失衡,损害睾丸生殖细胞的结构。
综上,燃煤型氟中毒可导致大鼠睾丸内氧化系统与抗氧化系统失衡,生殖细胞受损,氧化应激损伤在燃煤型氟中毒所致的雄性大鼠生殖毒性中可能发挥重要作用。
[1]孙玉富,于光前.燃煤污染型地方性氟中毒防治研究进展 [J].中华预防医学杂志,2007,41(3):227-229.
[2]Dvoráková-Hortová K,Sandera M,Jursová M,et al.The influence of fluorides on mouse sperm capacitation[J].Anim Reprod Sci,2008,108(1-2):157-170.
[3]Hassan HA,Abdel-Aziz AF.Evaluation of free radical-scavenging and anti-oxidant properties of black berry against fluoride toxicity in rats [J].Food Chem Toxicol,2010,48(8-9):1999-2004.
[4]潘萍,要路明.两种氟斑牙分类法比较 [J].中国地方病防治杂志,2002,17(1):17.
[5]黄文耀,李阳,李明健,等.三种不同方法测定砖茶中氟含量的比较 [J].中国地方病防治杂志,2002,21(1):61-62.
[6]Ghosh D,Das Sarkar S,Maiti R,et al.Testicular toxicity in sodium fluoride treated rats:association with oxidative stress [J].Reprod Toxicol,2002,16(4):385-390.
[7]刚亚栋,王俊玲,王平贵,等.慢性氟中毒对大鼠精子活动度的影响 [J].中国地方病学杂志,2010,29(2),139-141.
[8]陈树君,孙玉敏,孙秀义,等.慢性氟中毒对雄性大鼠睾丸损伤及牛磺酸锌保护作用的观察[J].环境与健康杂志,2008,25(1):51-52.
[9]梁刚,孙贵范,李影奕,等.氟对大鼠脂质过氧化和抗氧化能力的影响 [J].中国地方病学杂志,2001,20(2):109-110.
[10]安丽,张志瑜,张莹,等.VE和氟化物对小鼠睾丸脂质过氧化的联合作用 [J].中国公共卫生,2004,20(6):724-725.
[11]李积胜,汪超,王静,等.氟中毒大鼠睾丸细胞一氧化氮合酶活性变化的形态计量学研究 [J].武警医学,2001,12(3):143-145.
[12]Shiraishi K, Naito K.Effects of 4-hudroxy-2nonenal, a marker of oxidative stress,on spermatogenesis and expression of p53 protein in male infertility [J].J Urol,2007,178(3Pt1):1012-1017.
