银杏提取物对自身免疫性脑脊髓炎小鼠脱髓鞘免疫炎性病变的影响
2011-11-15张卫国杨桂姣山西医科大学解剖教研室太原030001通讯作者mailygjshanyi163com
陆 利,张卫国,杨桂姣 (山西医科大学解剖教研室,太原 030001;通讯作者,E-mail:ygjshanyi@163.com)
银杏提取物(ginkgo biloba extract,GBE)是以银杏为原料,分离纯化提取的物质,其主要活性成分是黄酮类和萜内酯类。以往研究显示,GBE具有消除自由基、扩张冠状血管和改善微循环的功效[1]。近期的研究证实GBE能够抑制炎症细胞因子的释放,对免疫炎性疾病具有良好的预防和治疗作用[2]。多发性硬化(multiple sclerosis,MS)是以神经纤维髓鞘脱失和轴突溃变为主要病理特征的一种慢性炎性疾病,目前临床治疗尚无肯定而有效的措施。本研究应用MS经典动物模型—实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)小鼠,观察 GBE对 EAE小鼠的影响,探讨GBE延缓脱髓鞘病变的可能及作用机制,以期为GBE的临床应用提供实验依据。
1 材料和方法
1.1 实验动物、主要试剂及仪器 雄性C57BL/6小鼠40只,8周龄,体重18-20 g,由北京维通利华实验动物技术有限公司提供。髓鞘少突胶质细胞糖蛋白33-55(MOG33-55,纯度 HPLC >96%)由北京奥科生物技术有限公司合成,完全弗氏佐剂(CFA)和百日咳毒素(PTX)购自Sigma公司,GBE由石家庄神威药业有限公司提供,CD4一抗购自美国Chemicon公司,生物素标记羊抗小鼠二抗和SABC试剂盒购自北京中杉金桥生物技术有限公司。恒冷箱切片机德国Leica公司,光学显微镜日本Olympus公司,酶标仪美国Bio-rad公司。
1.2 动物模型制备与分组 将实验动物分为GBE组和EAE组:GBE组(n=20)于造模前7 d开始每日腹腔注射GBE 70 mg/kg,连续40 d;EAE组(n=20)于造模前7 d开始每日腹腔注射等体积0.9%生理盐水,连续40 d。EAE模型制备参照文献[3],小鼠背部中线两侧皮下4点注射MOG33-55与CFA混合乳化抗原制剂,免疫当天及第2天给予小鼠腹腔注射PTX,诱导小鼠产生EAE。
1.3 神经功能评分 免疫后每日观察动物进行神经功能评分,评分标准按照参考文献[4]:0分,正常,未发病;1分,鼠尾张力障碍;2分,部分后肢瘫痪或步态不稳;3分,完全后肢瘫痪;4分,部分或完全前肢瘫痪;5分,濒死状态或死亡。
1.4 组织标本制备与免疫组化染色 选取免疫21 d后EAE组和GBE组小鼠各5只,经水合氯醛过度麻醉后,从心脏灌注生理盐水和4%多聚甲醛固定液,随后断头取脑室温后固定2 h,移置30%蔗糖溶液4℃保存。Leica恒冷箱切片机进行连续矢状切片、片厚16 μm,裱片于多聚赖氨酸包被的清洁载玻片上。免疫组化染色按照试剂盒说明操作。脑组织切片经0.3%H2O2孵育5 min灭活内源性过氧化物酶,CD4一抗稀释液4℃孵育过夜,次日依次加入生物素化羊抗小鼠二抗以及SABC复合物作用1 h,DAB显色10 min,酒精梯度脱水、二甲苯透明后封片。
1.5 酶联免疫吸附实验(ELISA) 选取免疫后第21天EAE组和GBE组小鼠各5只,断头处死动物,切取大脑前极至视交叉处脑组织约100 mg,加入预冷的裂解液冰上研磨,10 000×g离心15 min收集上清液,应用BCA法测定蛋白浓度。按照ELISA试剂盒说明书进行操作,检测TNF-α和IL-2含量。
2 结果
2.1 神经功能评分 小鼠免疫后第8-15天相继发病,第21-26天发病达到高峰。患病小鼠表现为活动减少,进食量下降,弓背、尾部拖垂,步态蹒跚,后肢无力,严重者肢体完全瘫痪。GBE组小鼠发病潜伏期为(12.5 ±0.64)d,较 EAE 组的(10.7 ±0.47)d显著延长(P<0.05)。GBE组小鼠各时间段神经功能评分均低于EAE组,其中发病高峰期(免疫后第21天)二者神经功能评分差异具有统计学意义(图1)。GBE组小鼠未出现肢体完全瘫痪的严重症状,表明GBE能够缓解EAE小鼠临床症状。
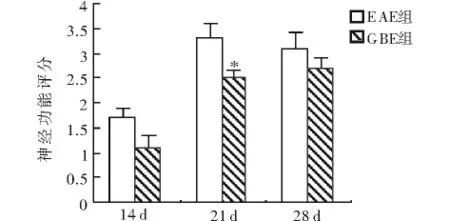
图1 不同时间段小鼠神经功能评分Fig 1 The mean clinical scores of mice at each time point
2.2 海马伞CD4免疫组化染色结果 海马伞由传出和传入海马的纤维组成,属于中枢神经系统白质。选取同一矢状切面海马伞标本,进行CD4免疫组化染色,观察GBE对EAE小鼠T淋巴细胞增殖反应的影响(图 2)。结果显示 EAE组CD4+T淋巴细胞较多,免疫阳性细胞聚集成簇,而GBE组CD4+T淋巴细胞较EAE组明显减少,仅可见CD4+T淋巴细胞散在分布,提示GBE能够抑制CD4+T淋巴细胞激活和增殖。
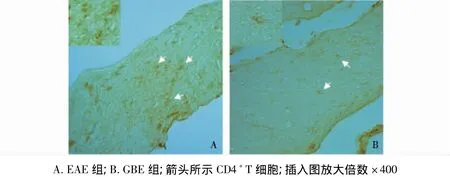
图2 海马伞CD4免疫组化染色(×200)Fig 2 The immunohistochemistry staining of CD4 in the fimbria of hippocampus(×200)
2.3 ELISA检测TNF-α和IL-2 ELISA定量分析结果显示,GBE组发病高峰期脑组织中TNF-α含量较EAE组明显减少(P<0.05),但是IL-2的含量两组之间的差异无统计学意义。提示GBE治疗后能够抑制中枢神经系统TNF-α的释放。
表1脑组织中TNF-α和IL-2含量比较(ng/mg,±s¯x)Tab1 Comparison of the level of TNF-α and IL-2 in the brain(ng/mg,±s¯x)
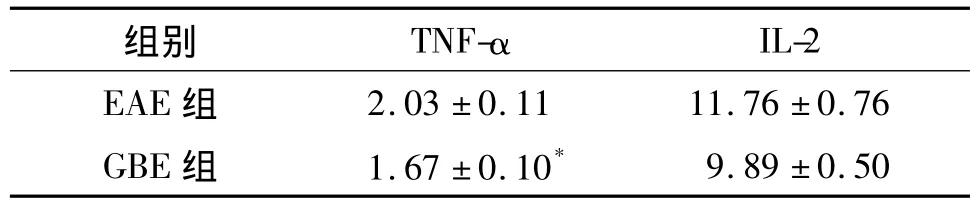
表1脑组织中TNF-α和IL-2含量比较(ng/mg,±s¯x)Tab1 Comparison of the level of TNF-α and IL-2 in the brain(ng/mg,±s¯x)
与 EAE 组比较,*P <0.05
组别 TNF-αIL-2 EAE组2.03 ±0.11 11.76 ±0.76 GBE 组 1.67 ±0.10*9.89 ±0.50
3 讨论
GBE是从银杏叶中分离纯化的物质,含银合内酯和银合黄酮甙等成分,具有清除氧自由基、抗脂质过氧化和保护血管内皮细胞等作用。近年来有报道证实GBE能够调解免疫细胞的功能状态,并能抑制各种细胞因子和炎性介质的过度释放,预防和治疗自身免疫炎性疾病[5]。EAE是研究炎性脱髓鞘MS免疫发病机制的经典模型,梁战华等[6]观察了GBE对豚鼠EAE模型的影响,发现与模型组相比GBE治疗组EAE发病推迟、病情减缓。我们的研究结果也显示GBE组小鼠发病潜伏期较EAE组显著延长约2 d,发病高峰期GBE组小鼠神经功能评分显著降低,并且GBE组小鼠未出现肢体完全瘫痪的严重症状,表明GBE对EAE小鼠具有保护作用,能够缓解EAE小鼠临床症状。
MS是中枢神经系统脱髓鞘疾病,免疫调节异常在其发生和发展过程中发挥着重要作用。淋巴细胞尤其是T淋巴细胞是MS发病过程中的主要效应细胞,MS患者急性期和复发期,脑和脊髓实质中出现大量T淋巴细胞局灶性浸润,活化的T淋巴细胞聚集于脱髓鞘病灶血管周围,转移活化T淋巴细胞至动物体内能够诱导产生EAE[7]。此外,MS患者体内T淋巴细胞亚群失衡,主要表现为外周血及脑脊液中CD4+T淋巴细胞升高,CD8+T淋巴细胞降低,CD4+/CD8+比值升高。激活的CD4+T细胞在外周血不断增生并表达各种细胞表面黏附因子,穿越血脑屏障进入中枢神经系统对髓鞘碱性蛋白或脂蛋白产生攻击,若阻断或抑制CD4+T细胞能够防止疾病复发和进展[8]。本研究结果显示 EAE组CD4+T淋巴细胞数量较多、细胞聚集成簇,而GBE治疗组仅可见 CD4+T淋巴细胞散在分布,提示GBE可能通过抑制CD4+T淋巴细胞激活和增殖从而下调免疫炎症反应,保护髓鞘结构。
既往的研究结果显示激活的CD4+T淋巴细胞进入中枢神经系统与脑内抗原呈递细胞相互作用,分泌TNF-α、IL-2、IL-6和NO等一系列炎性细胞因子和细胞毒性物质,启动或促进MS进程[9]。TNF-α在EAE炎性脱髓鞘发病机制中扮演重要角色,TNF-α不但能够刺激单核巨噬细胞产生炎性介质,而且还能直接杀伤少突胶质细胞,使髓鞘形成障碍。另外,TNF-α还可以诱导内皮细胞产生黏附分子,促进外周血单个核细胞穿过血脑屏障,加重EAE的病情,TNF-α的生物活性与EAE病情严重程度相平行[10]。本研究结果显示,GBE组脑组织 TNF-α含量较EAE组显著降低,表明GBE可能通过减少TNF-α的释放,抑制炎症反应,从而减轻免疫系统对自身组织的攻击,保护少突胶质细胞。本次研究未检测出GBE对IL-2含量的影响,有关GBE对其他细胞因子的作用及其潜在的作用机制尚待进一步研究。
[1] Singh B,Kaur P,Gopichand,et al.Biology and chemistry of Ginkgo biloba[J].Fitoterapia,2008,79(6):401-418.
[2] Lee YW,Lin JA,Chang CC,et al.Ginkgo biloba extract suppresses endotoxin-mediated monocyte activation by inhibiting nitric oxide-and tristetraprolin-mediated toll-like receptor 4 expression[J].J Nutr Biochem,2011,22(4):351-359.
[3] 徐全刚,王晓辉,黄德晖,等.MOG33-55诱发实验性自身免疫性脑脊髓炎小鼠模型[J].中华神经医学杂志,2006,5(2):141-145.
[4] Kono RH,Urban JL,Horvath SJ,et al.Two minor determinants of myelin basic protein induce experimental allergic encephalomyelitis in SJL/J mice[J].J Exp Med,1988,168(1):213-227.
[5] 黄其春,何玉琴,李焰,等.银杏叶提取物的免疫调节作用研究进展[J].中国药理学通报,2010,26(2):278-280.
[6] 梁战华,贾玉杰,姜妙娜,等.银杏叶提取物EGb761对实验性变态反应性脑脊髓炎的影响[J].中医康复研究,2004,8(19):3834-3836.
[7] Takenaka A,Itoyama Y.Adoptive transfer of experimental allergic encephalomyelitis with lectin activated spleen cells[J].J Neurol Sci,1984,66(2-3):255-261.
[8] Goverman JM.Immune tolerance in multiple sclerosis[J].Immunol Rev,2011,241(1):228-240.
[9] Stadelmann C.Multiple sclerosis as a neurodegenerative disease:pathology,mechanisms and therapeutic implications[J].Curr Opin Neurol,2011,24(3):224-229.
[10] Shi N,Kawano Y,Matsuoka T,et al.Increase of CD4+TNF{alpha}+IL-2-T cells in cerebrospinal fluid of multiple sclerosis patients[J].Mult Scler,2009,15(1):120-123.
