普罗布考联合辛伐他汀对急性冠脉综合征患者氧化应激及内皮功能的影响
2011-11-15李永辉李焕明天津市第四中心医院心内科天津300140
李永辉,张 寰,何 峰,李焕明 (天津市第四中心医院心内科,天津 300140)
氧化应激可导致血管内皮功能紊乱,在动脉粥样硬化的发生和发展过程中起重要作用[1],以普罗布考为代表的合成抗氧化剂具有一定的抗动脉粥样硬化作用,但其对患者氧化应激及内皮功能的影响尚少有报道。本研究通过对ACS患者早期联合应用普罗布考和辛伐他汀,研究其对氧化应激及血管内皮功能的影响,为ACS发病机制研究以及治疗策略制定提供新思路。
1 对象与方法
1.1 研究对象 选取2009-08~2010-08我院收治的ACS患者60例,将研究对象按照随机数字表分为两组:辛伐他汀组(A组,30例)和辛伐他汀联合普罗布考组(B组,30例)。A组中急性心肌梗死(AMI)16例,男10例,女6例,年龄47-79岁,平均(60.5±5.3)岁;不稳定性心绞痛(UAP)14 例,男10例,女4例,年龄 49-80岁,平均(62.7±4.9)岁。B组中急性心肌梗死(AMI)15例,男11例,女4例,年龄46-77 岁,平均(59.6 ±4.8)岁;不稳定性心绞痛(UAP)15例,男10例,女5例,年龄51-78 岁,平均(60.2 ±5.3)岁。
1.2 方法 在常规予以肠溶阿司匹林、氯吡格雷、硝酸酯类、钙离子拮抗剂、血管紧张素转换酶抑制剂、β受体阻滞剂等治疗基础上,A组常规予以辛伐他汀40 mg,1次/晚,B组在和A组同样治疗的基础上,加以普罗布考每次0.5 g,2次/d。
1.3 检测指标 用药前及用药后检查以下指标:①应用ELISA方法检测ox-LDL,试剂盒购自美国ADL公司。②应用硝酸还原酶法检测NO,采用分光比色法测定血清抗超氧阴离子自由基活力、脂质过氧化物(MDA)、一氧化氮合酶总活力(tNOS)、诱导型一氧化氮合酶(iNOS)活力,试剂盒购自南京建成生物工程研究所。③按照Celemajer等[2]的方法行超声检查,测定肱动脉内皮依赖血管舒张功能,此前需停用血管活性药物12 h。测定由固定专人操作。
1.4 统计学方法 所有数据用SPSS13.0软件分析,计量资料数据以±s表示,用药前后比较采用配对t检验,两组比较采用成组t检验,计数资料用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组间患者基本临床资料比较 2组患者在年龄、性别构成、体质指数(BMI)及高血压、糖尿病、高脂血症发生率方面差异无统计学意义,见表1。

表1 2组患者临床资料比较Tab 1 Clinical data of patients in 2 groups
2.2 外周血脂质过氧化物(MDA)、一氧化氮合酶总活力(tNOS)、诱导型一氧化氮合酶(iNOS)活力、NO变化 A组和 B组 MDA、tNOS、iNOS活力、NO水平治疗前、后均有统计学差异(P<0.05),而治疗后两组间脂质过氧化物(MDA)、一氧化氮合酶总活力(tNOS)、诱导型一氧化氮合酶(iNOS)活力、NO变化也有统计学差异(P<0.05),见表2。
表22组治疗前后外周血氧化应激指标的比较(n=30,±s)Tab 2Changes of MDA,NO,tNOS,iNOS in 2 groups before and after treatment(n=30,±s)
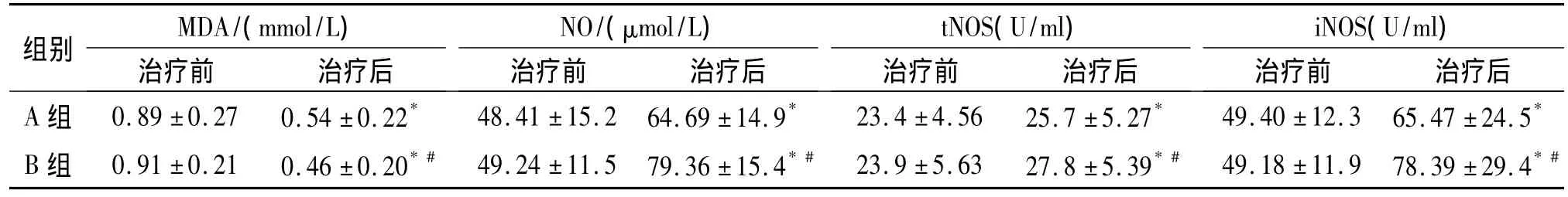
表22组治疗前后外周血氧化应激指标的比较(n=30,±s)Tab 2Changes of MDA,NO,tNOS,iNOS in 2 groups before and after treatment(n=30,±s)
与治疗前比较,*P <0.01;与 A 组比较,#P <0.05
组别MDA/(mmol/L)治疗前 治疗后NO/(μmol/L)治疗前 治疗后tNOS(U/ml)治疗前 治疗后iNOS(U/ml)治疗前 治疗后A 组 0.89 ±0.27 0.54 ±0.22* 48.41 ±15.2 64.69 ±14.9* 23.4 ±4.56 25.7 ±5.27* 49.40 ±12.3 65.47 ±24.5*B 组 0.91 ±0.21 0.46 ±0.20*# 49.24 ±11.5 79.36 ±15.4*# 23.9 ±5.63 27.8 ±5.39*# 49.18 ±11.9 78.39 ±29.4*#
2.3 治疗前后肱动脉内皮依赖血管舒张功能指标变化比较 A组和B组反应性充血内径变化率治疗前、后比较差异有统计学意义(P<0.05);治疗后A组与B组间反应性充血内径变化率差异也有统计学意义(P<0.05)。两组组间及治疗前、后肱动脉基础内径、反应性充血时内径、含硝甘后内径、含硝甘后内径变化率差异均无统计学意义(P>0.05),见表 3。
表32组治疗前后内皮依赖血管舒张功能指标变化(n=30,±s)Teb 3Changes of endothelial function before and after treatment in two groups(n=30,±s)
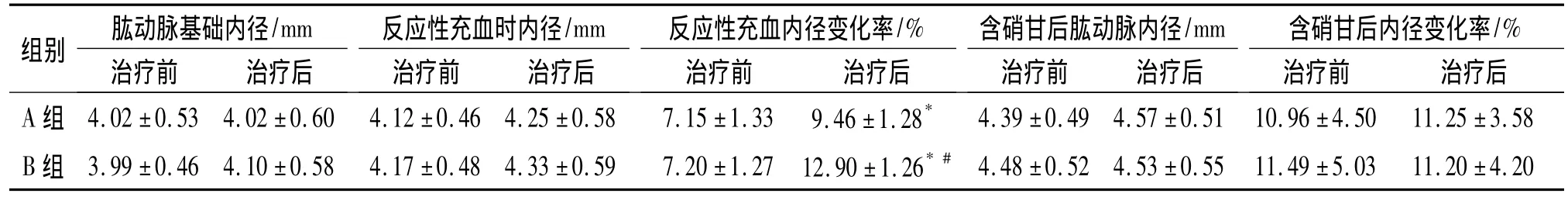
表32组治疗前后内皮依赖血管舒张功能指标变化(n=30,±s)Teb 3Changes of endothelial function before and after treatment in two groups(n=30,±s)
与治疗前比较,*P <0.01;与 A 组比较,#P <0.05
组别 肱动脉基础内径/mm治疗前 治疗后反应性充血时内径/mm治疗前 治疗后反应性充血内径变化率/%治疗前 治疗后含硝甘后肱动脉内径/mm治疗前 治疗后含硝甘后内径变化率/%治疗前 治疗后A 组 4.02 ±0.53 4.02 ±0.60 4.12 ±0.46 4.25 ±0.58 7.15 ±1.33 9.46 ±1.28*4.39 ±0.49 4.57 ±0.51 10.96 ±4.50 11.25 ±3.58 B 组 3.99 ±0.46 4.10 ±0.58 4.17 ±0.48 4.33 ±0.59 7.20 ±1.27 12.90 ±1.26*#4.48 ±0.52 4.53 ±0.55 11.49 ±5.03 11.20 ±4.20
2.4 不良反应 两组患者治疗3月后复查血清谷丙转氨酶、血肌酐、肌酸激酶,与治疗前相比,未发现明显肝肾功能损害,复查心电图,未发现QT间期延长等不良反应。
3 讨论
本研究通过测定外周血氧化应激指标,以及肱动脉内皮依赖舒张功能,并观察患者服用普罗布考3个月后相关指标的改变,探讨抗氧化药物普罗布考干预对ACS患者氧化应激的作用及临床治疗意义。
氧化应激是指机体或细胞内氧自由基的产生与清除失衡,导致活性氧(ROS)在体内或细胞内蓄积而引起的氧化损伤过程。其主要通过氧化作用,诱导血管基因表达,促进局部炎症反应和细胞增殖,多方面参与AS的发生和发展。大量研究揭示,血管壁内可产生多种ROS,它们独自或联合参与了动脉粥样硬化的发生与发展过程。氧化应激与动脉粥样硬化的发病关系密切。研究发现普罗布考在体内外可抑制由Gu2+诱导的巨噬细胞脂质氧化,抑制丙二醛的生成,还通过抑制还原型烟酰胺腺嘌呤二核苷酸氧化酶的活性、清除自由基达到抗氧化作用[3]。
本研究结果显示,ACS患者经过辛伐他汀治疗后,脂质过氧化物(MDA)、一氧化氮合酶总活力(tNOS)、诱导型一氧化氮合酶(iNOS)活力、NO水平变化均有统计学差异(P<0.05),而普罗布考联合辛伐他汀与单用辛伐他汀治疗使tNOS、iNOS活力、NO均有明显的升高(P<0.05),脂质过氧化物(MDA)有明显的降低(P<0.05),且超声提示反应性充血内径变化率明显改善,提示普罗布考可能通过抑制ACS患者氧化应激,从而发挥改善内皮功能的作用,且未增加不良反应。
以普罗布考为代表的合成抗氧化剂无论是动物研究还是临床研究,均能证明其具有一定的抗动脉粥样硬化作用[4,5]。普罗布考分子内所含的酚羟基很容易被氧化而发生断链,捕捉氧离子并与之结合后形成稳定的酚氧基,从而有效地降低血浆氧自由基浓度[6]。总之,普罗布考可能通过抑制ACS患者的氧化应激从而改善血管内皮功能的作用。
[1] Schulze PC,Lee RT.Oxidative stress and atherosclerosis[J].Curr Atheroscler Rep,2005:7(3):242-248.
[2] Celermajer DS,Sorensen KE,Gooch VM,et al.Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis[J].Lancet,1992,340(8828):1111-1115.
[3] Umeji K,Umemoto S,Itoh S,et al.Comparative effects of pitavastatin and probucol on oxidative stress,Cu/Zn Superoxide dismutase,PPAR-gamma,and aortic stiffness in hypercholesterolemia[J].Am J Physiol Heart Circ Physiol,2006,291(5):2522-2532.
[4] Itoh S,Umemoto S,Hiromoto M,et al.Importance of NAD(P)H oxidase-mediated oxidative stress and contractile type smooth muscle myosin heavy chain SM2 at the early stage of atherosclerosis[J].Circulation,2002,105(19):2288-2295.
[5] Choy K,Beck K,Pnq FY,et al.Processes involved in the site-specific effect of probucol on atherosclerosis in apolipoprotein E gene knockout mice[J].Arterioscler Thromb Vasc Biol,2005,25(8):1684-1690.
[6] 孟晓萍,王超,孙健,等.急性冠脉综合征患者血清基质金属蛋白酶(MMP2、MMP9)的表达[J].中国动脉硬化杂志,2006,14(4):339-342.
