CD24在大肠癌组织中的表达及其对癌细胞增殖的影响
2011-11-15王伟飞王新颖毛正果陈培生
王伟飞 王新颖 岳 辉 毛正果 陈培生
大肠癌是最常见的恶性肿瘤之一,在全世界范围内,大肠癌的发病率男女均处于恶性肿瘤的第3位[1],在我国,大肠癌的发病呈逐年上升趋势。研究表明,大肠癌的发生发展是一个典型的多基因多步骤的癌变过程[2]。CD24是1种黏蛋白样高度糖基化的膜表面黏附分子,近年研究发现其在多种造血系统肿瘤及实体瘤中呈高表达[3],而且CD24的胞质表达与乳腺癌[4]、胆管癌[5]、胃癌[6]、肾透明细胞癌[7]及前列腺癌[8]等肿瘤的预后密切相关。在大肠癌中,90.7%腺瘤和86.3%腺癌表达CD24[9],这提示在大肠癌的早期阶段已经发生CD24的改变,说明CD24可能参与大肠癌的发生发展过程。因此,本研究检测CD24在大肠癌组织及细胞株中的表达情况,并通过构建CD24真核细胞表达质粒,初步探讨CD24对大肠癌SW480细胞生长增殖的影响。
1 材料与方法
1.1 材料
1.1.1 组织样本 收集我院 2007年7月~2008年12月、手术切除并经病理检查证实的大肠癌及癌旁组织标本106例,所有病例均经病理检查确诊,且排除合并有其它恶性肿瘤和手术前接受化疗或放疗的患者。全部病例中,男性65例,女性41例,年龄26~87岁,中位年龄59岁。按WHO肿瘤分类标准(大肠癌)进行组织学分型:高分化腺癌23例,中分化腺癌70例,低分化腺癌13例。按国际抗癌联盟(UICC)和美国肿瘤联合会(AJCC)联合制定的标准(2003年)进行TNM分期:Ⅰ期16例,Ⅱ期37例,Ⅲ期37例,Ⅳ期16例。
1.1.2 细胞株及试剂 大肠癌细胞株 SW1116、SW480、SW620、HCT8、LoVo及 Colo205 为本实验室储存,RPMI 1640及胰酶购自GIBCO公司,胎牛血清及青链霉素购自杭州四季青生物公司,Trizol、pcDNA3.1(+)空质粒及转染试剂lipofectamine 2000均购自invitrogen公司,RevertAidTMFirst Strand cDNA Synthesis Kit购自立陶宛MBI(Fermentas)公司,PCR反应体系购自北京赛百盛基因技术有限公司,正常肠组织cDNA文库由南方医院消化内科王继徳教授赠送,核酸纯化试剂盒购自德国Macherey-Nagel(MN)公司,内切酶EcoRⅠ和KpnⅠ及连接酶购自美国NEB公司,感受态细胞购自北京天根生化科技有限公司,CD24 Ab-1(Clone SN3)单克隆抗体购美国 Neomarker公司,CD24(C-20)和FITC标记的二抗购自美国Santa cruz公司,HRP标记二抗均购自武汉博士德生物公司,细胞增殖试剂盒CCK8购自上海碧云天生物技术研究所,免疫组化用SP试剂盒、DAB显色试剂盒和防脱玻片购自福州迈新生物公司。
1.2 方法
1.2.1 CD24表达质粒的构建 根据 GenBank中人CD24基因(基因编号:NM 013230)设计引物,以正常肠黏膜cDNA文库为模板扩增cDNA编码区,上下游引物分别是5’-TAGGTACCACTATGGGCAGAGCAATGG-3’(F)和 5’-CCGGAATTCCGTTAAGAGTAGAGATGC-3’(R),PCR反应体系为94℃预变性5 min,94℃变性30 s,54℃退火30 s,72 ℃延伸1 min,36个循环,72℃延伸10 min,4℃终止反应。PCR产物及空质粒按说明书使用EcoRⅠ和kpnⅠ双酶切后纯化连接,之后进行转化,挑单克隆增菌后提取质粒,双酶切及测序鉴定。
1.2.2 细胞培养及瞬时转染 上述大肠癌细胞株使用含100 ml/L胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的RPMI 1640完全培养液培养,置37℃、体积分数为5%的CO2饱和湿度孵箱内孵育。细胞生长至约85%融合时使用胰酶(0.05%,w/v)/EDTA(0.02%,w/v)进行传代。细胞转染操作按Lipofectmine 2000转染试剂说明书进行,在六孔板上转染4 μg质粒,对照组转染空载体pcDNA3.1(+),实验组转染pcDNA3.1(+)-CD24。转染后48 h处理细胞,应用RT-PCR和流式细胞术进行鉴定。
1.2.3 RT-PCR分析 收集的细胞用冰预冷的PBS缓冲液冲洗3遍后,按Trizol的说明书提取总RNA,采用分光光度计进行定量,按逆转录试剂盒说明书合成cDNA后进行PCR扩增,PCR反应体系为94℃预变性5 min,94℃变性 30 s,56℃退火 30 s,72℃延伸 1 min,36个循环,72℃延伸10 min,4℃终止反应。CD24的上下游引物分别为5’-GACATGG GCAGAGCAATGGTGGC-3’(F)和 5’-GAGTGAGACCACGAAGAGACTGGC-3’(R)[10]。实验重复3 次,同时扩增 GADPH 作为内参照。
1.2.4 流式细胞术 0.05%胰酶消化细胞,按2×105个/ml的密度重悬细胞,按1∶100的工作浓度加入CD24 单克隆抗体(Ab-1,Neomarker),冰上孵育 1h,用含有3%FBS的PBS缓冲液洗涤2次后,按1∶200的工作浓度加入FITC标记的二抗,冰上40 min,洗涤重悬后用流式细胞仪分析。同时以同型IgG作为阴性对照。
1.2.5 CCK-8法检测细胞增殖 0.25%胰蛋白酶消化处于对数生长期的SW480细胞、SW480-Vector细胞和SW480-CD24细胞后,用培养基制成单细胞悬液(3×105个/ml),接种于 96 孔培养板中(100 μl/孔),分别在转染0、24、48、72、96 h时进行检测。每组各设 6孔,在检测时更换新鲜培养基,同时加入CCK-8(5 mg/ml)10 μl/孔,37 ℃孵育培养2 h后,应用酶联免疫标记分析仪测定,用只加培养基的空白对照孔进行调零,每孔450 nm波长的吸光度OD值(OD450),记录结果,以时间为横轴、吸光值为纵轴绘制细胞生长曲线,实验重复3次。
1.2.6 免疫组织化学染色及结果判定 上述标本离体后经10%中性福尔马林液固定24~48 h,取材,常规脱水、透明和包埋,切片,厚度为4 μm,组织蜡片置于预先涂有多聚赖氨酸的载玻片烤干备用。采用免疫组化SP方法,按照免疫组织化学常规步骤操作。一抗CD24(C-20)按1∶400稀释后4℃过夜。用已知阳性片作为阳性对照,PBS代替一抗作为阴性对照。
CD24阳性表达者细胞膜和细胞质出现棕黄色颗粒。判定标准:每张切片随机选取5个不同高倍视野(400×)进行观察。染色结果综合染色强度及阳性细胞百分数两个方面进行半定量分析。指标染色强度判定:无染色为0分,浅黄色为1分,黄色为2分,黄褐色为3分。阳性细胞百分数判定:阳性细胞百分数<5%为0分,5% ~25%为1分,26% ~75%为2分,>75%为3分。将染色强度与阳性细胞百分数分值相加即为切片各指标最终得分:0~1分为阴性(-),2分为弱阳性(+),3~4分为阳性(+ +),5~6分为强阳性(+ + +)。所有切片采用双盲法,由两位病理科医师独立阅片评分。
1.3 统计学分析
结果均应用SPSS 13.0软件进行统计分析。流式细胞术实验结果取3次结果的平均值,增殖实验取3次实验结果中的1次作为统计结果,采用析因设计的方差分析;免疫组化中CD24染色强度(等级资料)与患者性别、年龄和肿瘤部位的关系分析采用非参数秩和检验,而表达强度与TNM分期和肿瘤分级的关系分析采用Spearman秩相关检验。
2 结果
2.1 CD24在大肠癌组织中的表达
CD24在大肠癌组织中的染色定位在细胞膜和细胞质,呈棕黄色颗粒样染色,而在癌旁正常黏膜中几乎无染色。CD24膜表达阳性率为34.9%,表达水平与肿瘤分级呈负相关(γ = -0.201,P=0.038),而与患者性别、年龄及肿瘤分期无相关性(表1)。CD24质表达阳性率为89.6%,其表达水平与肿瘤分级(γ=0.235,P=0.015)和肿瘤分期(γ =0.269,P=0.005)呈正相关性,与患者性别、年龄及肿瘤部位无相关性(表2)。
2.2 CD24在大肠癌细胞株中的表达
采用 RT-PCR法检测发现,CD24在 SW620和Colo205细胞中呈高表达,在SW1116细胞中呈中度表达,而在SW480、HCT8和LoVo细胞中几乎无表达。进一步应用流式细胞术从蛋白质水平检测CD24的表达,其结果与采用RT-PCR法检测的结果一致。
2.3 构建CD24表达质粒并瞬时转染SW480细胞
对重组质粒进行双酶切(EcoRI和KpnI),得到265 bp的片段,与预计片段大小一致,而空载体没有相应条带(图1A);质粒测序证实重组质粒插入片段与Genebank的序列完全一致。上述结果提示CD24在SW480细胞中呈低表达,故选择转染SW480细胞使其过表达CD24,同时转染空载体作为阴性对照。如图1B所示,RT-PCR检测结果提示,CD24在重组质粒转染组中呈高表达,而在空白对照组和空载体组中呈低表达。应用流式细胞术检测结果显示,CD24重组质粒转染组在蛋白质水平也呈明显的高表达(图1C)。

表1 CD24膜表达与大肠癌临床病理参数的关系(例,%)

表2 CD24质表达与大肠癌临床病理参数的关系(例,%)

图1 构建pcDNA3.1(+)-CD24表达质粒并瞬时转染SW480细胞
2.4 CCK-8法检测大肠癌细胞的增殖情况
增殖实验分为转染重组质粒组、转染空载体组(阴性对照组)和试剂组(空白对照组),分别于转染后24、48、72、96 h应用 CCK-8法测定细胞活性情况。结果提示,转染重组质粒组细胞在转染48、72和96 h时,活性均较阴性对照组和空白对照组明显增强(P<0.001)(图2),提示CD24促进大肠癌SW480细胞的增殖。
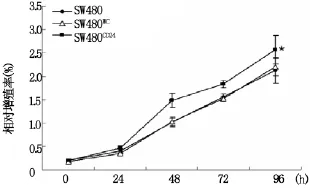
图2 CD24促进大肠癌细胞的增殖曲线图
3 讨论
CD24通过糖基磷脂酰肌醇(GPI)锚定在细胞膜上,具有多个N-或O-连接的糖基化位点。而且,CD24分子在进化中获得了更多的丝氨酸和苏氨酸残基,使其成为更典型的黏蛋白样膜表面黏附分子[3]。P-选择素是CD24已经被识别的唯一配体[11],它主要表达在激活的内皮细胞和血小板上[12]。在生理状态下,CD24通过和P-选择素结合促进肿瘤细胞黏附在血管内皮细胞上[13],并促进肿瘤细胞在肺部形成转移灶[14]。因此,CD24的结构决定其与肿瘤细胞的迁移和转移密切相关。
在本研究中,我们应用免疫组化方法,检测大肠癌及癌旁正常组织中CD24的表达情况,结果表明,CD24在大肠癌组织中呈高表达,质表达和膜表达阳性率分别为89.6%和34.9%,而在癌旁正常黏膜中几乎没有表达。而且,CD24的质表达水平与肿瘤分级分期呈正相关关系。这表明CD24在大肠癌的发生发展中起重要的作用。
Baumann等[15]发现高表达CD24不仅促进乳腺癌和胰腺癌细胞与细胞外基质的黏附、迁移和侵袭,而且,体内和体外实验都显示其促进癌细胞的生长和增殖。Smith等[16]应用siRNA干扰技术降低CD24的表达后,膀胱癌、前列腺癌和乳腺癌细胞的增殖明显受到抑制。在本研究中,为了进一步验证CD24对大肠癌细胞生物学行为的影响,我们构建了CD24的表达质粒 pcDNA3.1(+)-CD24,并选择 CD24低表达的SW480细胞作为转染对象。结果表明,过表达CD24后SW480细胞在体外的生长和增殖明显加快,这说明CD24不仅与肿瘤的迁移和黏附有关,而且,与肿瘤细胞的增殖也密切相关。但是,CD24促进癌细胞增殖的机制并不清楚。Kim等[17]发现CD24对乳腺癌细胞的增殖作用可能与CyclinD1和p27有关。连续切片的免疫组化染色表明,在胆管癌组织中CD24表达与p-MAPK呈明显的负相关关系[5]。这些研究说明CD24可能通过细胞内的某些信号分子促进肿瘤细胞的增殖作用。
总之,本研究表明CD24在大肠癌的组织中呈高表达,而且可促进大肠癌细胞在体外的增殖作用,这说明CD24在大肠癌的发生发展中起重要的作用。但是,其发生作用的具体机制并不清楚,包括相互作用的分子、结构以及与细胞内信号通路的关系,因此,需要进一步深入研究。
[1]Peto J.Cancer epidemiology in the last century and the next decade〔J〕.Nature,2001,411(6835):390.
[2]Arnold C,Goel A,Blum H,et al.Molecular pathogenesis of colorectal cancer:implications for molecular diagnosis〔J〕.Cancer,2005,104(10):2035.
[3]Kristiansenl G,Sammar M,Altevogt P.Tumour biological aspects of CD24,a mucin-like adhesion molecule〔J〕.J Mol Histo,2004,35(3):255.
[4]Kristiansen G,Winzer K,Mayordomo E,et al.CD24 expression is a new prognostic marker in breast cancer〔J〕.Clin Cancer Res,2003,9(13):4906.
[5]Agrawal S,Kuvshinoff B,Khoury T,et al.CD24 expression is an independent prognostic marker in cholangiocarcinoma〔J〕.J Gastrointest Surg,2007,11(4):445.
[6]Chou Y,Jeng Y,Lee T,et al.Cytoplasmic CD24 expression is a novel prognostic factor in difuse-type gastric adenocarcinoma〔J〕.Ann Surg Oncol,2007,14(10):2748.
[7]Lee H,Kim D,Kwak C,et al.Expression of CD24 in clear cell renal cell carcinoma and its prognostic significance〔J〕.Urology,2008,72(3):603.
[8]Kristiansen G,Pilarsky C,Pervan J,et al.CD24 Expression is a significant predictor of PSA relapse and poor prognosis in low grade or organ confined prostate cancer〔J〕.Prostate,2004,58(2):183.
[9]Sagiv E,Memeo L,Karin A,et al.CD24 is a new oncogene,early at the multistep process of colorectal cancer carcinogenesis〔J〕.Gastroenterology,2006,131(2):630.
[10]Tsuyoshi F,Tomoaki T,Takeshi S,et al.Silencing of insulin-like growth factor-binding protein-2 in human glioblastoma cells reduces both invasiveness and expression of progression-associated gene CD24〔J〕.J Biol Chem,2007,282(25):18634.
[11]Aigner B,Sthoeger Z,Fogel M,et al.CD24,a mucin-type glycoprotein,is a ligand for P-selectin on human tumor cells〔J〕.Blood,1997,89(9):3385.
[12]Walz G,Aruffo A,Kolanus W,et al.Recognition by ELAM-1 of the sialyl-Lex determinant on myeloid and tumor cells〔J〕.Science,1990,250(4984):1132.
[13]Aigner S,Ramos C,Hafezi-Moghadam A,et al.CD24 mediates rolling of breast carcinoma cells on P-selectin〔J〕.FASEB J,1998,12(12):1241.
[14]Friederichs J,Zeller Y,Hafezi-Moghadam A,et al.The CD-24/P-selectin binding pathway initiates lung arrest of human A125 adenocarcinoma cells〔J〕.Cancer Res,2000,60(12):6714.
[15]Baumann P,Cremers N,Kroese F,et al.CD24 expression causes the acquisition of multiple cellular properties associated with tumor growth and metastasis〔J〕.Cancer Res,2005,65(23):10783.
[16]Smith S,Oxford G,Wu Z,et al.The metastasis-associated gene CD24 is regulated by Ral GTPase and is a mediator of cell proliferation and survival in human cancer〔J〕.Cancer Res,2006,66(4):1917.
[17]Kim H,Kim J,Lee K,et al.Isolation of CD24(high)and CD24(low/-)cells from MCF-7:CD24 expression is positively related with proliferation,adhesion and invasion in MCF-7〔J〕.Cancer Lett,2007,258(1):98.
