术前活检在胃粘膜病变内镜粘膜下剥离术治疗中的价值分析
2011-11-12张游令狐恩强卢忠生杜红王向东孟江云王红斌
张游 令狐恩强 卢忠生 杜红 王向东 孟江云 王红斌
中国人民解放军总医院消化内科
内镜粘膜下剥离术(endoscopic submucosal dissection,ESD)是近几年发展起来的一项能够完整切除早期肿瘤的微创技术,与传统的外科手术相比,ESD具有创伤小以及患者痛苦少、恢复快等优点。目前,对于要采用ESD治疗的胃粘膜病变术前是否都应该常规活检,国内外尚无统一的定论。日本学者认为术前窄带成像内镜(NBI)+放大内镜就可以确定病变严重程度[1-2],以此为依据就可以进行ESD操作。还有的学者认为根据内镜下的病变形态即可确定是否进行ESD。而更多的学者认为术前活检结果是确定是否行ESD的唯一标准。那么,术前活检病理到底有多大价值,是否一定要依靠活检病理的结果进行ESD的操作?为此,我们对2006年以来我院行ESD治疗的胃粘膜病变患者的临床资料进行回顾性总结,旨在评价术前活检在该类患者ESD治疗中的应用价值。
1 资料与方法
1.1 研究对象
收集2006年10月至2011年11月间我院消化内镜中心行ESD治疗的胃粘膜病变患者作为研究对象。纳入标准:术前活检确诊有胃上皮内瘤变或癌变(贲门除外),ESD操作过程顺利,术后病理结果完整。最终195例符合标准纳入本次回顾性研究,其中男144例、女51例,年龄27~84岁,平均62岁。
1.2 病理分类标准
参照2000年国际癌症研究机构出版的WHO肿瘤新分类[3]。将轻度、轻-中度和中度不典型增生判定为低级别上皮内瘤变;将中-重度、重度不典型增生和原位癌判定为高级别上皮内瘤变。
1.3 ESD切除标准
依照我院自行制定的ESD切除标准,主要针对胃粘膜病变。(1)术前活检病理提示高级别瘤变,EUS或CT或PET-CT未发现胃周淋巴结及远处转移灶;(2)术前活检提示为原位癌,EUS或CT或PET-CT未发现胃周淋巴结及远处转移灶,EUS粘膜下层完整或鼠齿钳提示粘膜游离度良好;(3)术前活检病理提示低级别瘤变,反复复查不能消失;(4)活检病理提示胃粘膜腺瘤或扁平息肉;(5)术前病理虽然未取到粘膜高级别瘤变,但NBI+放大内镜高度怀疑病变为高级别瘤变病变;(6)未分化肿瘤不行ESD治疗;(7)病变直径在1 cm以上。
1.4 方法
对纳入研究的195例患者的临床资料进行总结,以ESD术后病理结果为最终诊断结果,统计术前活检诊断的总符合率(ESD术后病理提示为瘤变和癌变的例数之和占总例数的百分比,而不管瘤变或癌变的严重程度)和完全一致率(指活检病理与ESD术后病理诊断完全相同的例数占总例数的百分比,包括瘤变和癌变的严重程度都要完全相同),相关数据行χ2检验以及Scheffé可信区间法进行率的多重比较,P<0.05为差异有统计学意义。
2 结果
2.1 一般结果
本组病变部位以胃窦为主(92例),其次是胃角(42例)、胃体(27例)、胃底(20例)、窦体交界(11例)和底体交界(3例)。术前活检提示低级别上皮内瘤变85例,高级别上皮内瘤变79例,早癌31例;术后病理提示炎性组织12例,低级别上皮内瘤变56例,高级别上皮内瘤变56例,早癌71例。活检病理与ESD切除间隔时间大多数在4周以内,其中有60例为外院活检病理结果。
2.2 术前活检与术后病理对比
术前活检诊断与术后病理诊断符(表1)。从表1中可以看出,术前活检与术后病理总符合率达93.8%(183/195),完全一致率为50.8%(99/195),其中低级别上皮内瘤变完全一致率为49.4%(42/85),高级别上皮内瘤变完全一致率为38.0%(30/79),早癌完全一致率为87.1%(27/31),3种级别病变术前活检与术后病理一致率两两比较结果显示,早癌诊断一致率明显高于低级别上皮内瘤变和高级别上皮内瘤变(P<0.05),而低级别上皮内瘤变诊断一致率与高级别上皮内瘤变比较差异无统计学意义(P>0.05)。本组有66例(33.8%,66/195)术后病理较术前活检病理程度加重,其中低级别上皮内瘤变有36例(42.4%,36/85),高级别上皮内瘤变有30例(38.0%,30/79);有18例(9.2%,18/195)术后病理较术前活检病理程度减轻,其中高别上皮内瘤变有14例(17.7%,17/79),早癌有4例(12.9%,4/31);术后病理证实为炎性组织12例(6.2%,12/195),其中低级别上皮内瘤变有7例(8.2%,7/85),高级别上皮内瘤变有5例(6.3%,5/79)。
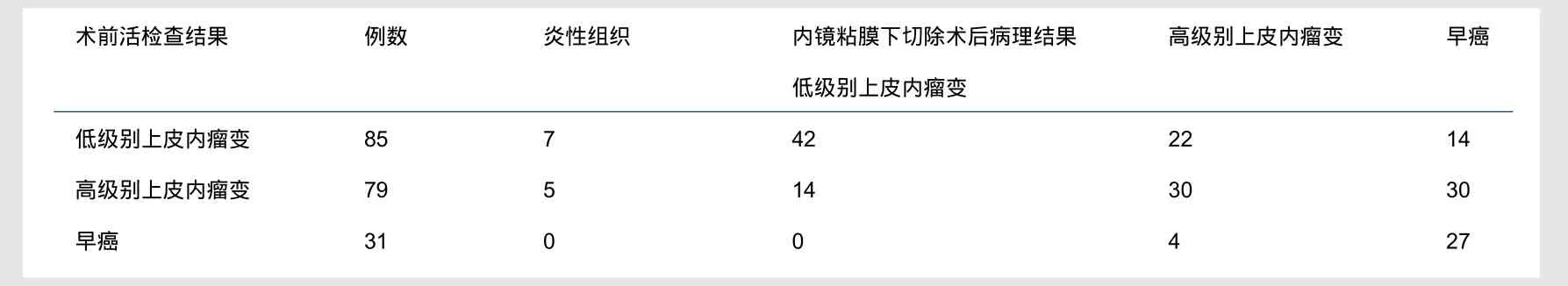
表1 195例胃粘膜病变患者术前活检结果与内镜粘膜下切除术后病理结果对比
3 讨论
一直以来,普遍的观点认为活检是确定病变性质的金标准,通过活检病理可以确定患者的治疗方案,决定患者的未来。但我们的研究结果显示活检病理与最终病理具有一定的差距,本组术前活检与ESD术后病理诊断的完全一致率仅为50.8%,有33.8%的患者术后病理程度加重,有9.2%的患者术后病理程度减轻,还有6.2%的患者术后病理结果为炎性组织的;并且我们还发现早癌诊断一致率明显高于低级别上皮内瘤变和高级别上皮内瘤变,而低级别上皮内瘤变诊断一致率与高级别上皮内瘤变比较差异无统计学意义。日本学者报道的468例胃非浸润癌的术前活检与ESD术后病理的对比研究中,术前活检的低估率为44%,ESD治疗前后病理诊断一致率为56%[4]。另外,国外一项397例胃粘膜上皮瘤患者ESD术后病理与术前活检病理的对比研究显示,ESD治疗前后病理诊断的一致率为59.9%,术后病理程度加重占28.7%,术后病理程度减轻占4.3%,7.1%术后病理为炎性组织[5]。虽然我们的研究结果与国外报道的数据有一些出入,但是都说明了同一个问题,即术前活检病理与ESD术后病理存在不同程度的差异。那么为什么术前活检病理与ESD术后病理会产生不同程度的差异呢?我们认为可能存在以下几个问题。
首先内镜活检是一种抽样取材过程,这其中抽样位置相当关键。胃癌的发展模式是胃炎-肠化-异性增生-粘膜内癌-浸润癌[6],病变区域内同时存在有胃炎、异性增生和癌组织。因此造成ESD术后病理较术前活检病理程度加重的因素可能有以下几点:(1)活检位置不准,医师对病变严重程度的内镜下表现认识不够或内镜清晰度不足均能造成活检位置不准;(2)活检深度不够,一般活检的深度只包括粘膜层和粘膜固有层,而取材要求包括粘膜肌层为宜,因为ESD可以提供完整的粘膜上皮层、固有层和粘膜肌层,这就要求在活检时应选择同一个位置进行深部活检,尽量确保术前活检病理的完整性,否则就只能得到表浅组织的病理诊断,从而可能增加活检低估率;(3)某些病变位置活检比较困难,活检钳不易夹到病变组织,例如胃角体侧、胃底近贲门等。
其次内镜活检对于部分病变而言是一种治疗方法。本组中有18例(9.2%)术后病理程度较术前活检减轻,造成这种情况的原因可能有以下几点:(1)活检时可能已经钳除了存在于病灶中病变程度最严重的成分,由于病变区域的面积比较小相对增加了活检取材的准确性,或者由于病变最严重成分的比例小且内镜操作者对病变主题观察全面、活检点把握精准;(2)术前反复活检造成病灶粘连影响ESD操作,反复对同一个病灶多次活检会破坏病灶的完整性甚至造成粘连,从而增加ESD操作难度,如果病灶有粘连,会导致内镜下不能完整剥离整个病灶,进而影响术后病理诊断,可能导致部分病变的术后病理较活检减轻,本组因术中发现有粘连而不能整块剥离的有22例,其中有6例术后病理诊断较术前级别降低,并且这6例术前活检均诊断为高级别上皮内瘤变;(3)可能在活检时就已经完全钳除存在于病灶中的一点癌,国外学者Kim等[7]报道633例胃粘膜病变患者经内镜切除术后病理诊断为炎性组织的有20例(3.2%),经过分析后他们认为术前活检可以完全钳除小胃癌病灶,虽然在临床实践中这种情况不常见,但是我们应该充分认识到活检可以钳除病灶中小的不典型增生或癌变病灶的重要性。
另外,和活检与ESD治疗间隔时间的长短有关。活检与ESD治疗间隔时间不宜太长,因为上皮内瘤变既能够向前发展同时也存在可逆性[8],如果活检与ESD间隔时间太长,就有可能导致ESD治疗前后病理结果的不一致。有文献报道显示,低级别上皮内瘤变患者中38%~75%的患者可以消退,19%~50%的患者持续存在,而高级别上皮内瘤变患者中不到16%的患者可消退,持续存在者占14%~58%[9-10]。低级别上皮内瘤变进展为癌的时间在10个月到4年,高级别上皮内瘤变患者中60%~85%的患者4~48个月可进展为癌,而3个月内诊断者很可能是事先未能明确诊断为癌[11-12]。我们的研究中,大多数患者是在活检后4周内接受ESD治疗,ESD术后病理较术前活检病理程度加重的66例中有11例在活检后4~8周内接受ESD治疗,还有12例在活检后8周至1年内接受ESD治疗,更有1例超过1年才接受ESD治疗;ESD术后病理较术前活检病理程度减轻的18例中有2例在活检后4~8周内接受ESD治疗,还有1例在活检后4个月接受ESD治疗;术后诊断为炎性组织的11例中有2例在活检后4~8周内接受ESD治疗。
综上所述,目前术前活检病理还不能完全代表胃粘膜病变的性质,但术前活检病理对ESD切除胃粘膜病变具有良好的提示作用,另外部分患者通过活检可能同时起到治疗作用。如何更加准确地对胃粘膜病变的最严重部位进行术前活检并提高ESD治疗前后病理诊断的完全一致率仍有待进一步研究。
[1] Tajiri H, Doi T, Endo H, et al.Routine endoscopy using a magnifying endoscope for gastric cancer diagnosis[J].Endoscopy,2002, 34:772-777.
[2] Sumiyama K, Kaise M, Nakayoshi T, et al.Combined use of a magnifying endoscope with a narrow band imaging system and a multibending endoscope for en bloc EMR of early stage gastric cancer s[J].Gastrointest Endosc, 2004, 60:79-84.
[3] Hamilton SR, Aaltonen LA.World Health Organization classification of tumours.Pathology and genetics of tumors of digestive system.Lyon:IARC Press, 2000:105-118.
[4] Kato M, Nishida T,Tsutsui S,et al.Endoscopic submucosal dissection as a treatment for gastric noninvasive neoplasia:a multicenter study by Osaka University ESD Study Groups[J].J Gastroenterol, 2011, 46:325-331.
[5] Lee CK, Chung IK, Lee SH, et al.Is endoscopic forceps biopsy enough for a definitive diagnosis of gastric epithelial neoplasia[J].Gastroenterol Hepatol, 2010,25:1507-1513.
[6] Correa P.A human model of gastric carcinogenesis[J].Cancer Res,1988, 48:3554-3560.
[7] Kim ES, Jeon SW, Park SY, et al.Where has the tumor gone? The characteristics of cases of negative pathologic diagnosis after endoscopic mucosal resection[J].Endoscopy, 2009, 41:739-745.
[8] 吴蓓, 令狐恩强, 杨杰, 等.胃粘膜低级别上皮内瘤变的临床病理及转归.军医进修学院学报, 2011, 32:598-600.
[9] Bearzi I, Brancorsini D, Santinelli A, et al.Gastric dysplasia: a ten-year follow-up study[J].Pathol Res Pract, 1994, 190:61-68.
[10] Lansdown M, Quirke P, Dixon MF, et al.High grade dysplasia of the gastric mucosa: a marker for gastric carcinoma[J].Gut, 1990, 31:977-983.
[11] Kokkola A, Haapiainen R, Laxén F, et al.Risk of gastric carcinoma in patients with mucosal dysplasia associated with atrophic gastritis: a follow up study[J].J Clin Pathol, 1996, 49:979-984.
[12] Yamada H, Ikegami M, Shimoda T, et al.Long-term follow-up study of gastric adenoma/dysplasia[J].Endoscopy, 2004, 36:390-396.
