胃上皮内瘤变与早癌内镜下粘膜切除术(EMR)后复发率的调查研究
2011-11-12连元令狐恩强王志强卢忠生孟江云王向东杜红王红斌中国人民解放军总医院消化内科南开大学医学院
连元 令狐恩强 王志强 卢忠生 孟江云 王向东 杜红 王红斌 中国人民解放军总医院消化内科 2 南开大学医学院
内镜下治疗早期胃癌因其微创,并发症较少而成为治疗的主要方法,且易被患者接受。内镜下治疗早期胃癌的主要方法是内镜下粘膜切除术和内镜下粘膜剥离术。相较于内镜下粘膜剥离术,内镜下粘膜切除术更易于操作且所需手术时间更短,但是对于直径>20 mm的病变,应用内镜下粘膜切除术较困难[1],存在应用的局限性。ESD用于治疗大块早期胃癌病变,能够提供精确的病理诊断而且病变的复发率低[1],所以此技术正逐渐取代EMR,但内镜下粘膜剥离术对术者的技术有较高要求,且并发症出现率较高,所以EMR仍被应用于临床治疗早期胃癌。但对EMR缺少长期的随访和生存数据调查,因此有必要进行EMR治疗早期胃癌的术后复发率的研究,以为临床提供依据。
1 资料与方法
1.1 临床资料
病例选择须符合下列要求:内镜或活检病理诊断为早期胃癌的病变。通过计算机检索301医院内镜中心数据库中的数据,筛选出2000年8月至2011年8月11年间行EMR治疗早期胃癌的38例病人、54例次临床资料,进行随访调查研究,其中男28人,女10人,年龄50~94岁,平均67.9岁,1例病例失访,失访率为2.6%。将临床资料按术后病理类型分为:低级别上皮内瘤变、高级别上皮内瘤变和癌。
1.2 器械
Olympus GIF-Q240Z电子胃镜,富士能 EG-530UT超声内镜, Olympus GF-UE260、GF-UCT240放大内镜,INJ1-A1-07-5-23-180注射针,FD-410LR热活检钳,HX-610-90和HX-600-135金属止血夹,ERBE ICC-200高频电切装置和APC300氩离子凝固器。圈套缩。
1.3 方法
行胃镜检查发现病灶所在位置后,根据镜下观察情况,判断是否在术前行超声内镜和放大内镜检查。用内镜注射针在病灶粘膜下层注射含有美蓝1:30000的肾上腺素生理盐水,注射至整个病灶明显隆起,约需5~30 ml,注射后若病变抬举征阳性,用圈套器将病变组织切下,观察创面有无出血、穿孔及病变组织残留,如术中和切除病灶后有渗血,视情况选择注射1:10000肾上腺素、APC或止血荚封闭创面止血。EMR操作医生和病理分析医生均为我院有经验的内镜操作医生和病理科医生。
1.4 切除后处理
将切除组织送病理科进行分析,确定病变的组织学类型,判断是否将病变完全切除,注意切除边缘及底部是否残留。若病理结果示有病变组织,则视患者情况行再次EMR术或行外科手术治疗。患者术后给予禁食水、补液、止血、抑酸、粘膜保护等处理,密切观察患者术后病情变化。
1.5 内镜随访
所有患者在术后1、3、6、12月进行复查,并取活检,如无异常则之后每年进行复查。如有复发视患者情况再次行内镜下治疗或行外科手术。

表1 术后组织学类型及病灶分布
2 结果
2.1 切除病灶情况
切除病灶38个,病灶直径0.6~2.5 cm。29个病灶单次完整切除,9个病灶分次分割切除。2例首次未完全切除病灶行再次EMR术。完全切除率为94.7%。
2.2 随访
全部病例内镜随访1~72个月,平均28个月。38例次中有1例失访,失访率为2.6%,研究结果可靠。
2.3 病灶的分布及组织学类型(表1)
2.4 术后复发情况(表2)
3 讨论:
根据术后复发情况,总复发率为22.2%,复发率较高,尤其高级别上皮内瘤变组,达到32%,且术后复发经历时间较短。对于无淋巴结转移及血行转移的小病灶(≤10 mm)EMR常能一次性根治切除,但较大病灶(>20 mm)由于EMR术的技术限制,常需多次分片切除,切除后的标本破碎,无法提供详细、准确的病理组织学评估,病灶残遗、复发率较高[2]。Chizu Yokoi 等曾进行粘膜大块病变EMR分次切除与ESD整块切除后复发率的对照研究,其数据显示EMR术后复发率为17%,ESD术后复发率为0%[3]。有很多研究报道相较于EMR术,ESD提高了早期胃癌整块病灶切除率[4-7]。因此EMR术后复发率较高,增加了患者行再次治疗的风险,因此如患者有行内镜下粘膜剥离术(ESD)适应征且患者经济情况允许则应建议行内镜下粘膜剥离术(ESD)治疗。对早期胃癌的治疗EMR有其适应征,但有研究提出在早期胃癌治疗方式的选择时,即使在病变很小可以使用EMRC的情况下仍应选用ESD术[8]。2010年第一版的《肿瘤学临床实践指南》(中国版)对于Tis或Tla期肿瘤治疗方式的选择规定为为:身体状况良好初始治疗选择EMR或手术治疗,身体状况差选用EMR或ESD[9],由于EMR治疗的高复发率性,根据本调查研究可考虑在条件允许的情况无论患者身体状况如何下直接应用ESD治疗。Oyama[10]等人统计EMR治疗早期食管癌的复发率为7.8%~20%,复发率仍较高,所以可研究探讨在其他器官或组织的早期癌治疗的方式选择时首选ESD治疗。
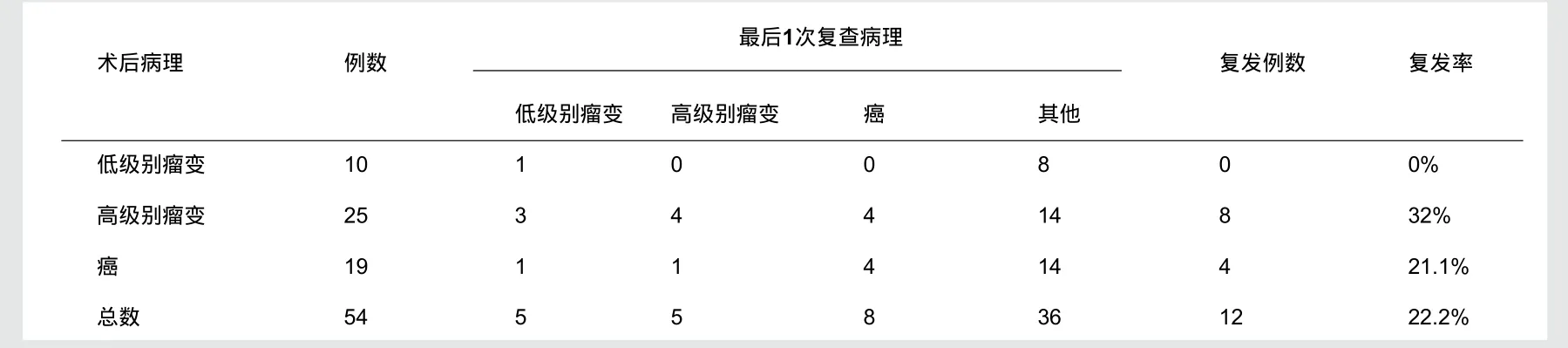
表2 术后复发情况
研究结果中低级别上皮内瘤变复发率为0%,但该组中病例较少,使数据可靠性降低。病人术后复查行活检检查,不能完全确定所取部位即原发灶,可能出现再发病灶病理类型与原发病灶相同或级别更高,使数据的可靠性降低。
在搜集数据过程中发现术前活检病理结果与术后病理结果不符的情况,同样的情况也出现在他人的研究中,如欧希龙[11]等人在胃镜下粘膜切除术治疗胃、食管早期癌和癌前病变的研究中,9个术前与术后病理结果不相符的病灶中8个术前病理诊断等级低,1例术前诊断等级高。SHIMIZU[12]研究的51例术前病理诊断为重度不典型增生的食管病变中,经内镜下EMR治疗后送检标本,其中19例为食管早癌,术后病理级别高于术前的病理占30%。HULL[13]一项研究中,总结的EMR治疗31个胃和10个食管病变的资料中,16个病例术前与术后病理不相符,其中14个术前病理诊断等级低,占39%。以上可见内镜下治疗在疾病诊断中的重要性,但由于EMR术在切除较大病变时需分割切除,导致标本不完整影响了病理诊断的准确性。
由于ESD术对病灶的根除率明显高于EMR而被迅速广泛应用于日本和其他几个亚洲国家[14],但ESD技术难于掌握及操作,且引起大出血和穿孔的风险较高,阻碍了ESD的广泛应用。所以应不断改进ESD术式、提高临床医生的操作水平,使其更广泛的应用于临床,促进内镜治疗的发展。
[1] Keiichiro Kume.Endoscopic mucosal resection and endoscopic submucosal dissection for early gastric cancer: Current and original devices[J].World J Gastrointest Endosc, 2009, 1(1):21-31.
[2] 令狐恩强, 冯佳.癌前病变与早癌内镜下切除术的演变与发展[J].中国消化内镜杂志, 2008, 25(11):27-29
[3] Chizu Yokoi, MD, Taku ji Gotoda, et al.Endoscopic submucosal dissection allows curative resection of locally recurrent early gastric cancer after prior endoscopic[J].Gastrointest Endosc, 2006, 64:212-218.[4] Kakushima N, Fujishiro M.Endoscopic submucosal dissection for gastrointestima neoplasms[J].World J Gastroenterol,2008,14:2962-2967.
[5] Onozato Y, Ishihara H Iizuka H, Sohara N, et al.Endoscopic submucosal dissection for early gastric cancers and large flat ademomas[J].Endoscopy, 2006, 38:980-986.
[6] Isomoto H, Shikuwa S, Yamaguchi N, et al.Endoscopic submucosal dissection for early gastric cancer:a large-scale feasibility study[J].Gut,2009, 58:331-336.
[7] Imagawa A, Okada H, KawaharaY, et al.Endoscopic submucosal dissection for early gastric cancer:results and degrees of technical difficulty as well as success.Endouscopy, 2006, 38:987-990.
[8] Andreas Probst, Helmut Messmann.Endoscopic Therapy for Early Gastric Cancers-from EMR to ESD, from Guideline Criteria to Expnded Criteria.Digestion, 2009, 80:170-172.
[9] 肿瘤学临床实践指南(中国版)2012年, 第一版.
[10] OYAMA T, TOMORI A, HOTTA K, et al.Endoscopic submucosal dissection of early esophageal cancer[J].Clincal Gastroenterology and Hepatologe,2005,3:s67-s70.
[11] 欧希龙, 孙为豪, 曹大中, 等.胃镜下粘膜切除术治疗胃、食管早期癌和癌前病变[A].中国内镜杂志, 2008, 14(5):461-464.
[12] SHI IM IZU Y ,KATO M , YAMAMOTO J, et al.Histologic results of EMR for esophageal lesions diagnosed as high-grade intraepithelial squamous neoplasia by endoscopic biopsy[J].Gastrointest Endosc,2006, 63(1):16-21.
[13] HUL MJ, MINO-KENUDSON M, NISH IOKA NS, et al.Endoscopic mucosal resection:An improved diagnostic procedure for early gastroesophageal epithelial neoplasm s[J].Am J Surg Pathol, 2006,30(1):114-118.
[14] Kazuya Akahoshi, Hidefumi Akahane.A new breakthrough:ESD using a newly developed grasping type scissor forceps for early gastrointestinal tract neoplasms[J].World J Gastrointest Endosc, 2010, 16, 2(3):90.
