内镜粘膜剥离术对食管动力和食管扩张度的影响
2011-11-12卜保国令狐恩强王向东王红斌杜红郭荣斌
卜保国 令狐恩强 王向东 王红斌 杜红 郭荣斌
中国人民解放军总医院消化内科
内镜下粘膜剥离术(ESD)已广泛用于胃肠上内肿瘤的治疗[1-4]。ESD治疗食管上皮内肿瘤与传统外科食管切除术相比具有创伤小,术后并发症少等优点,与内镜下粘膜切除术相比,能够整块地完全切除大的上皮内肿瘤[2]。随着内镜技术的进展及内镜器械的改进,ESD的一些手术并发症如出血、穿孔均明显减少, 但由于切除范围的增加术后狭窄的发生率和吞咽困难的发生率逐渐升高,这严重影响患者术后生存质量。尽管ESD术后狭窄发生的确切概率尚不清楚,但研究发现与管腔环周切除范围有关,一些研究报道食管环周3/4以上粘膜切除,尤其是食管全周ESD是术后狭窄的危险因素[1,5]。
我们内镜中心在行食管ESD中发现一些患者术后尽管无明显的食管狭窄,但也有偶发的吞咽困难,尤其在吞咽较大食团时。这一现象说明患者这些患者吞咽困难可能和食管ESD术后医源性溃疡愈合过程中瘢痕形成和收缩引起扩张度轻度受限有关。而分析食管ESD切除范围与食管扩张受限的关系有助于阐明食管ESD术后狭窄及吞咽困难的形成因素。另外,吞咽困难并不总是与食管狭窄狭窄相关,动力异常可能在一些吞咽困难的原因[6-7]。并且,ESD过程中可能对食管固有肌层造成一些损伤,溃疡愈合过程中也会造成固有肌层的炎性损伤及纤维化[8],这些均有可能对食管动力造成影响。食管ESD术后动力改变的研究尚无报道。
本研究的目的是评估ESD切除对食管动力和食管扩张度的影响。
1 材料和方法
1.1 研究对象
6例患者(男5例,女1例,年龄53~64岁,平均58岁)均为因胸段食管上皮内肿瘤行ESD治疗后3月至8月来我院复查患者。临床病例资料和ESD切除资料(表1)。
1.2 ESD操作程序及切除范围的判定
食管ESD在静脉麻醉及气管插管呼吸机通气的状态下进行。使用内镜型号为Olympus GIF、Q260、14260及1T240,相关附件包括注射针、针型刀、IT刀、Dual刀和圈套器等。具体操作方法具体方法[9]:用针式切开刀或氩气在距离病变边缘0.3 cm处点状环绕标记,给予足够粘膜下注射,使病变完全抬起。距离标记点约0.5 cm处用针刀及Dua刀环行切开粘膜至粘膜下层,用IT刀、Dua刀逐渐将粘膜剥离或用圈套器将病变粘膜圈套电凝电切。
食管ESD切除范围占食管周径的判定 将内镜置于管腔中央,将视野内的范围分为4个象限,根据病变所占象限数判定切除范围。
1.3 吞咽困难症状分级
吞咽困难症状按照5级分法[10]:0级无症状;1级不能进固体食物;2级不能进软食,3级不能进流食;4级完全吞咽困难;连水也难以下咽。
1.4 食管动力检测
食管动力检测采用高清测压系统(美国Serria Scentific Instruments公司)。食管测压在空腹6小时以上进行。测压程序包括5分钟基础压力测定和仰卧位10次5 ml水的吞咽[11]。所有吞咽和压力测量被分析由Gasto Trac Appliction 软件执行。
1.5 一种新的食管腔直径和扩张度的评估方法
食管直径测量采用自制的双腔球囊导管。该球囊导管由一个双腔管和一个乳胶材料的顺应性较好的长10 cm,直径32 mm侧球囊组成。首先内镜检查证实ESD术后瘢痕位置,再将球囊导管沿导丝经口送入瘢痕位置处,球囊内注入60 ml碘海醇,再次插入内镜至球囊上端,在内镜吸引状态下进行X线摄影。对ESD瘢痕处及紧邻的食管腔的直径及瘢痕的狭窄段长度进行测量。
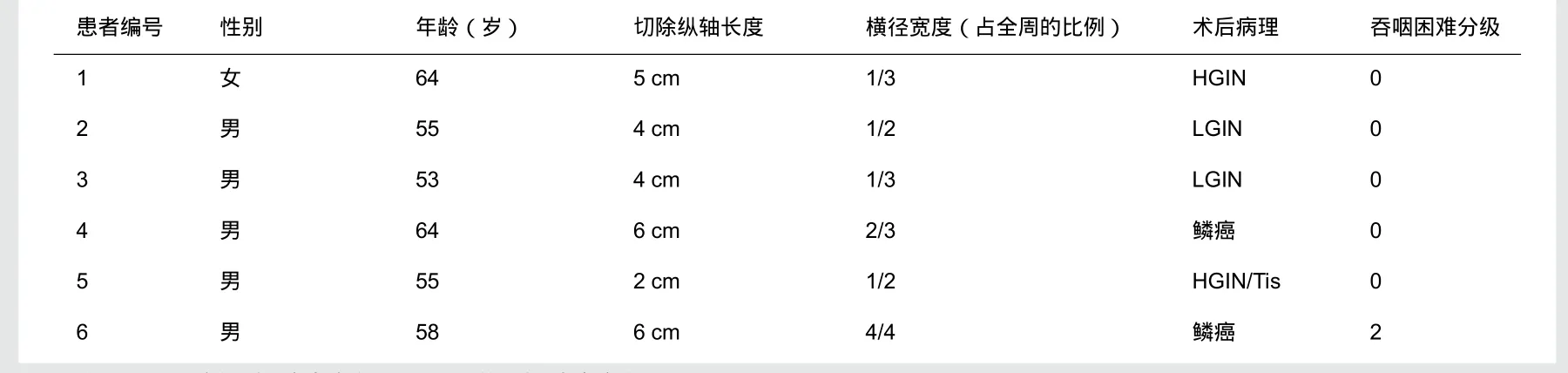
表1 食管ESD患者临床病理资料
食管扩张度=ESD瘢痕处的食管直径×2/(瘢痕以上食管的直径+瘢痕以下正常食管的直径)。
2 结果
2.1 吞咽困难评级
6例患者中有一例患者吞咽困难评分为2,该例切除范围为环周,其余5例评分为0,切除范围从1/2到2/3。而5例评分为0的患者中,1例进食固体食物偶发性吞咽困难,其切除范围占管腔环周1/3。
2.2 食管动力测定

图1 病例6的侧卧位食管X线球囊导管造影
3例患者表现出低的食管体部的压力和廓清能力,10次吞咽中无效吞咽占20%~40%,这3例的切除范围占环周比例分别是1/3、1/2和4/4。2例患者测压表现为出现胡桃夹食管,切除范围为占环周比例分别是2/3和1/2,患者无胸痛胡桃夹食管症状及吞咽困难(表2,图1)。
2.3 食管扩张度测定
ESD瘢痕处及相邻正常食管的管腔直径及狭窄度(表2)。在内镜下见一例患者有食管狭窄,食管扩张度在每个患者中均有不同程度的受限1例食管环周切除的患者ESD瘢痕处的食管扩张度仅为43%(表2,图2)。
3 讨论
ESD是对食管早癌治疗的一种可行办法,能够完成对病变的整块和完整切除,能够进行术后标本切缘及基底层组织学精确评估,减少病变残留及局部复发[1-3]。
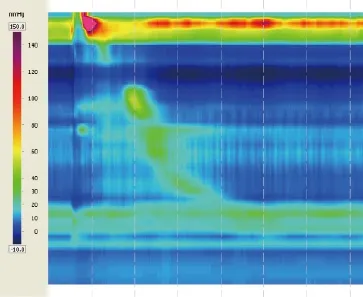
图2 a 病例5的动力显示食管体蠕动幅度下降
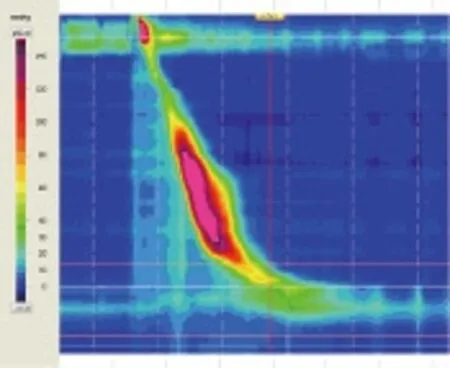
图2 b 病例4食管中段高压,胡桃夹食管样改变
ESD的并发症主要包括出血、穿孔和术后狭窄。随着内镜技术的进展和内镜器械的改进,出血和穿孔的发生率明显减少,术后食管狭窄和吞咽困难成为ESD的主要并发症,一些患者出现食管狭窄后常需要反复的食管扩张,严重影响患者的生存质量。一些研究指出超过 3/4环周切除是食管狭窄的主要危险因素。对于术后狭窄的形成也有研究进行了一些尝试,有研究用定期预防性球囊扩张防止狭窄的形成,口服肾上腺素的预防术后狭窄的形成。取得一定效果。对于ESD切除范围多大需预防性处理上存在争议。
本研究采用一种新的高顺应性的球囊导管测量食管腔的直径。球囊内注入造影剂后能很好的与食管壁贴合,这个球囊能对管壁施加一定的压力,避免了测量时的食管生理性狭窄的影响。这种方法能准确反映食管的形态及管腔直径,可用于食管腔直径的精确测量及对食管扩张度的判断。结果显示食管直径狭窄(直径0.9 cm)1例,本研究中内镜下食管狭窄出现在1例环周切除的患者,而在X线下观察到5例内镜下食管ESD瘢痕处的管腔均较其上下相邻的正常食管的直径小,说明ESD瘢痕形成能够引起食管的扩张受限。与食管狭窄相比,食管扩张度能准确反映ESD对食管功能的影响。但食管扩张度首先到那种程度会引起食管狭窄或吞咽困难,尚需进一步大规模研究证实。
光动力治疗Barrett食管伴食管腺癌或高级别瘤变的研究发现光动力治疗后出现吞咽困难的患者的部分患者没有出现食管狭窄,而仅表现为食管的动力障碍。食管碱烧伤引起的吞咽困难患者也有部分出现食管动力障碍,而无食管狭窄狭窄形成。这些说明吞咽困难并非总是与食管狭窄有关,而是由于食管肌层的损伤引起的动力障碍引起。食管ESD术后溃疡愈合也引起纤维增生和固有肌层的破坏[8,12]。但食管ESD对动力动力的影响尚未见报道。
本研究中,6例患者中有3例出现食管体部动力减弱及10次吞咽中的部分无效吞咽,发生率50%。这3例患者的ESD切除范围分别为4/4、1/3和1/2,分别有2级吞咽困难,偶发性固体性食物吞咽困难及无吞咽困难症状。这说明食管ESD后可能出现食管动力的减弱,这种影响可能是由于食管ESD术后溃疡愈合过程中的纤维组织增生及瘢痕形成有关,而非仅与狭窄有关。本研究显示食管ESD可能导致食管体部的动力减弱,但无食管腔扩张明显受限的动力减弱不会影响ESD术后患者的吞咽功能。另外两例患者表现为食管中段高压,类似胡桃夹一样食管动力改变,但患者无任何吞咽困难及胸痛症状。食管ESD术后食管压力增高的形成及临床需进一步研究。由于本研究病例数少,且缺少术前、术后的对照,其结论需大规模ESD术前、术后食管动力对照进一步验证。
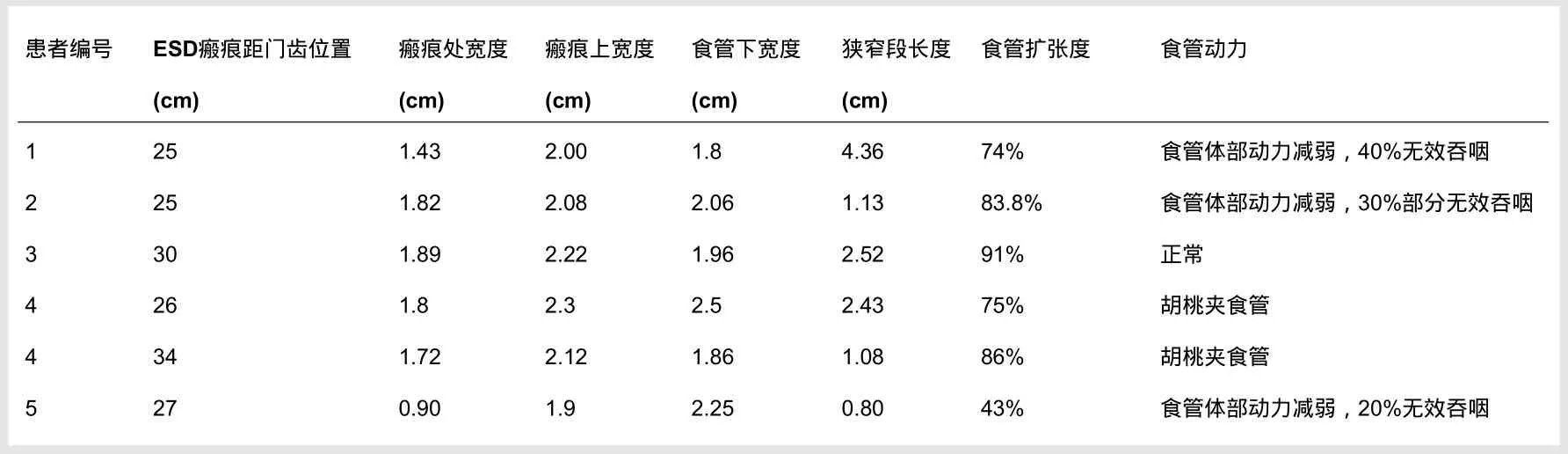
表2 食管ESD后管腔直径及食管动力学监测结果
[1] Hirasaki S, Tanimizu M, Moriwaki T, et al.Efficacy of clinical pathway for the management of mucosal gastric carcinoma treated with endoscopic submucosal dissection using an insulated-tip diathermic knife[J].Intern Med, 2004, V43N12 :1120-5
[2] Oyama T, Tomon A, Hotta K, et al.Endoscopic submucosal dissection of early esophageal cancer[J].Clin Gastroenterol Hepatol, 2005,3:S67-S70
[3] Kakushima N, Yahagi N, Fujishiro M, et al.Efficacy and safety of endoscopic submucosal dissection for tumors of the esophagogastric junction[J].Endoscopy, 2006, V38N2:170-4
[4] Yamamoto H, Yahagi N, Oyama T.Mucosectomy in the colon with endoscopic submucosal dissection[J].Endoscopy, 2005, V37N8:764-8
[5] Ono S, Fujishiro M, Niimi K, et al.Predictors of postoperative stricture after esophageal endoscopic submucosal dissection for superficial squmous cell neoplasms[J].Endoscopy, 2009;41:661-5
[6] Bautista A, Varela R, Villanueva A, et al.Motor function of the esophagus after caustic burn[J].Eur J Pediatr Surg,1996, V6N4:204-7
[7] Malhi-Chowla N, Wolfsen HC, DeVault KR.Esophageal dysmotility in patients undergoing photodynamic therapy[J].Mayo Clin Proc, 2001,V76N10:987-9
[8] Masaho Ota, Takeshi Ohki, Tsutomu Nakamura, et al.Investigation of ulcer healing after esophageal EMR/ESD[J].Esophagus, 2010,7:101–104
[9] 令狐恩强, 卢忠生, 冯佳, 等.内镜下粘膜剥离术治疗消化道早癌及癌前病变24例临床分析[J].中国实用内科杂志, 2008, 11:964-966
[10] Mellow MH, Pinknas H.Endoscopic therapy for esophageal carcinoma with Nd:YAG laser: prospective evaluation of efficacy, complications, and survival[J].Gastrointest Endosc, 1984, 30:334-339
[11] Pandolfino JE, Ghosh SK, Zhang Q, et al.Quantifying EGJ morphology and relaxation with high-resolution manometry: a study of 75 asymptomatic volunteers[J].Am J Physiol Gastrointest Liver Physiol,2006V290N5 :G1033-1040
[12] Honda M, Nakamura T, Hori Y.Process of healing of mucosal defects in the esophagus after endoscopic mucosal resection: histological evaluation in a dog model[J].Endoscopy, 2010, 42(12): 1092-1095
