过度训练动物模型制备的研究进展
2011-11-09李丽,常波
李 丽,常 波
(1.嘉应学院体育学院,广东梅州 514015;2.沈阳体育学院运动人体科学学院,辽宁沈阳 110102)
过度训练动物模型制备的研究进展
李 丽1,常 波2
(1.嘉应学院体育学院,广东梅州 514015;2.沈阳体育学院运动人体科学学院,辽宁沈阳 110102)
通过整理与分析过度训练动物模型、模型制备的注意事项及评价指标,探讨过度训练动物模型存在的问题,为过度训练的深入研究提供参考。
过度训练;实验动物;模型
运动员长时间训练导致的身体疲劳和机能下降不能在短时间内恢复,使其疲劳症状不断增加或积累且运动成绩下降,这种训练称为过度训练(overtraining)。由于过度训练对运动员的不利影响较大,研究者积极探索其机理、如何早期诊断、如何合理防治等,但这些深层次、创伤性的研究很难直接在人体上进行,所以人们常借助各种实验动物实现这样的实验研究。但查阅国内外相关文献,人们在建模中所采用的实验对象、实验条件、判断标准均有较大差异,影响了有关研究的开展与深入。因此,笔者对相关动物模型进行综述,以期为研究过度训练提供基础性参考。
1 模型制备方法
1.1 大鼠力竭性跑台训练
1.1.1 跑台速度控制法
(1)选用雄性SD大鼠,体重(142.72±5.76)g。室温(25±3)℃,湿度55%±15%。适应性饲养1周后,进行跑台训练,跑台坡度为10度,周日休息。第1周每天适应性训练10m/min×30min。第2至7周进行正式训练,每次从15m/ min开始,每5min速度增加5m/min,直至40m/min,保持此强度至力竭。力竭标准:连续予大鼠施加声、光、机械刺激后,大鼠不能跑动,下跑台后连续喘息,暂时无逃避反应。造模后,大鼠血清睾酮浓度明显降低,血清皮质酮浓度显著升高,T/C比值显著下降,尿液中TP、Alb和β2-MG的含量显著增高。同时,大鼠体重明显减少,且逐渐出现懒惰、无力、易受惊吓、目光呆滞黯淡等一系列过度训练反应症状[1]。此模型强度较大,与体育运动中由从事短时间、大强度运动的速度、爆发性项目(如100米跑、跳高、跳远以及投掷等项目)引起的人体过度训练效果相当。
(2)选用雄性Wistar大鼠,60天,体重200~280g。室温22~24°C。大鼠在水平跑台上(坡度为0%)适应性训练3天,跑速为12m/min,每天进行10min。剔除拒绝运动及运动能力低于平均水平的大鼠。合格大鼠按照表1进行训练,每周训练5天,休息2天。

表1 大鼠跑台运动方案
实验控制:跑台底端安有可产生微弱电流(2,0mA)的电栅来保证大鼠维持跑速。造模后,大鼠运动能力下降,血睾酮浓度显著减少,皮质醇浓度显著增多,睾酮/皮质醇显著下降[2]。此强度大致为80%~85%最大摄氧量,与体育运动中,由从事长时间、中等强度的项目(如800m跑、200m游泳等项目)引起的人体运动性疲劳的效果相当。
1.1.2 步频与跑台速度对照控制法
选用雄性SD大鼠,120~123天,体重220~260g。在改建的大鼠多道跑台上进行大负荷量的反复长时间跑台训练(吸氧量51.1ml/kg)。采用单位时间内步频数与记录器上显示的数据对照控制的方法,即大鼠每10s内跑动步频为25次左右,记录器上的速度为 15m~22m/min。上午训练150min,下午训练150min,坡度均为5%(注:90°=100%)。造模15天,大鼠神态倦怠、眼睛变得暗淡无光,皮毛有少许脱落,进食量与大小便均减少,饮水量增加,大鼠出现体重明显下降(超过1/30),可观察到四肢足指有轻度肿胀,肌肉明显萎缩等体征。末次运动12h后处死大鼠,可观察到大鼠心肌的病理性损害和肝组织的组织学变化等[3]。此模型特点:采用不遵循序渐进原则的不合理的大运动量,在较短的时间内引起了大鼠过度训练的产生。
1.2 大鼠力竭性游泳训练
1.2.1 静水条件下游泳训练
1.2.1.1 无负重游泳训练 选用雄性SD大鼠,体重280~300g左右。饲养温度21~24℃。在150 cm×60 cm×70 cm,水深60cm,水温31~32℃的水池中进行无负重游泳。每周训练6天,休息1天。第一周:前3天进行30min/d适应性游泳,并在1周内延长时间至120min;第二周:120min/d;第三至六周:进行每天1次的力竭性训练,力竭标准:游泳动作明显失调,沉入水底3s不能回到水面。发现上述情况及时捞起,用吸水纸擦干,放回鼠笼休息;第七至八周:每天早晚各1次力竭性训练,在短时间内力竭的大鼠,捞出休息5min后,再进行游泳训练使游泳时间不少于2h。造模后血红蛋白和红细胞数显著下降,睾酮/皮质醇比值显著下降,其下降幅度可达到71.6%[4]。
1.2.1.2 负重游泳训练 (1)选用雄性Wistar雄性大鼠,体重200g左右。饲养温度(23±3)℃,相对湿度为70% ~80%。大鼠在水温(34±2)℃、水深50cm、100cm×60cm× 70cm的玻璃缸中游泳,每周训练6天,每天训练1次,训练6周。在大鼠游泳过程中出现力竭时(力竭标准为大鼠从水面下沉,经10s后仍不能返回水面),将其捞出,休息5min左右后,放入泳缸中继续完成游泳负荷[5-7]。具体方案见表2。
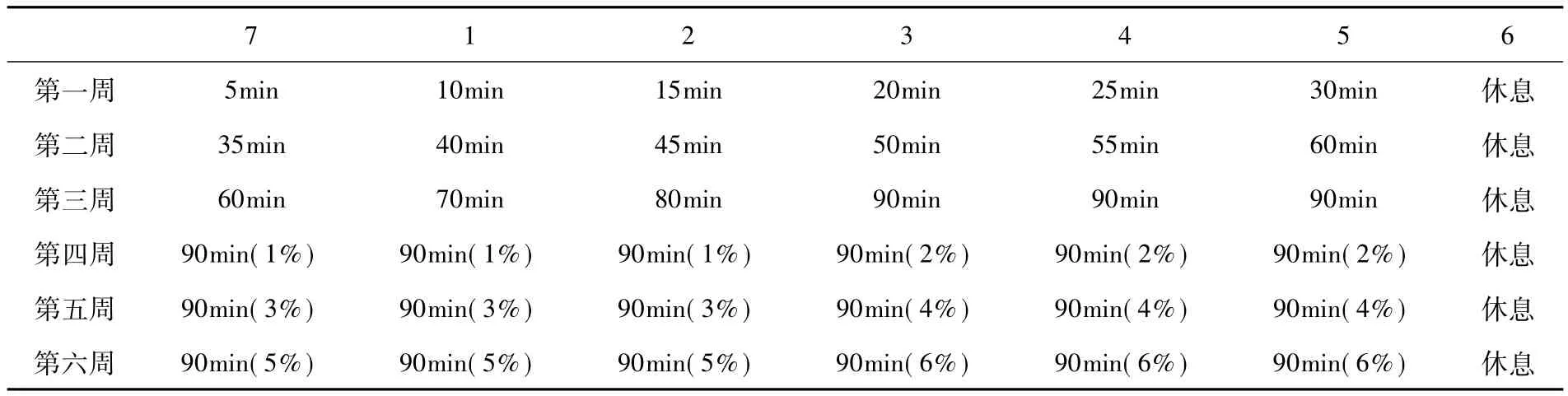
表2 大鼠负重游泳运动方案
(2)选用SD雄性大鼠,体重180~220g。饲养温度22~28℃,相对湿度50% ~55%。游泳池为100cm×60cm× 60cm,水温控制在(30±1)℃,水深50cm。每周训练7次,共训练6周,开始前3天进行适应性训练30~60min,第一周每次持续训练180min,第二至四周起尾部负体重的4%~5%,时间延长至200min,第五~六周减量(观察大鼠游泳能力的变化,当下沉水下无能力浮上时,立刻托起减量至3%)。造模后大鼠运动能力下降,食量大减,体重降低(20%),体毛不洁,精神倦怠,心电图异常(12例窦性,节律整齐;2例房室传导阻滞;2例充血性心衰),血红蛋白、血睾酮和睾酮/皮质醇比值下降(17.4%、16.8%和53.3%),尿蛋白、皮质醇和血乳酸升高(分别为704.6%、86.5%和55.3%)[8-10]。
1.2.2 流动水条件下游泳训练
选用Wistar雄性大鼠,体重(209±20)g。先适应性喂养3天,同时每天在流动水游泳水槽里进行20min适应性游泳训练1次,将游泳时间少于20min的大鼠筛除,之后开始正式训练,训练时间为7周。如在游泳期间发现有力竭表现(大鼠游泳力竭标准为:在水下10s不能上浮),捞出水面休息5min后继续游泳至游满规定时间,具体训练时间和负荷见表3。造模后,大鼠血清总睾酮水平及睾丸AQP9 mRNA表达均降低[11]。
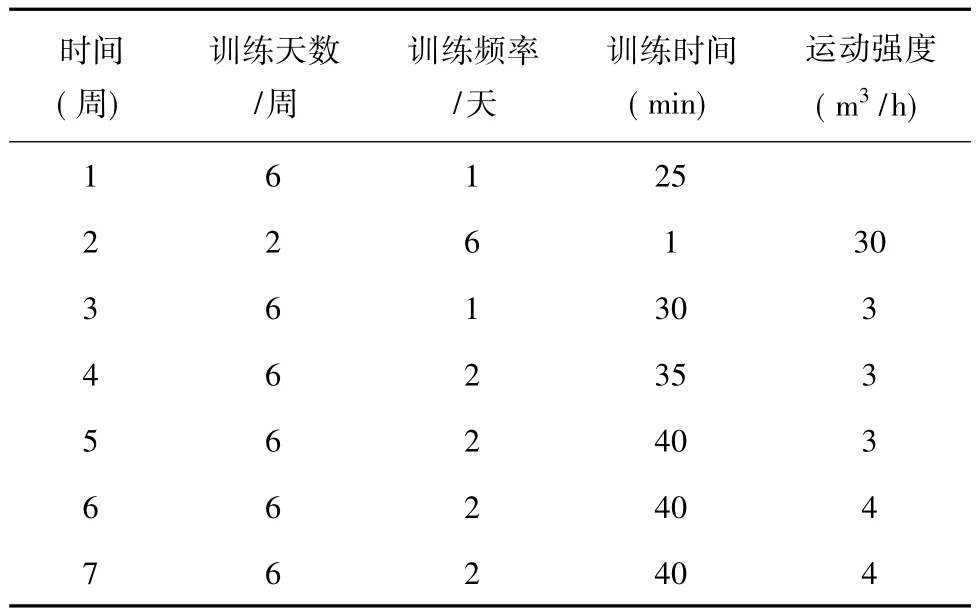
表3 流动水槽中大鼠游泳训练方案
1.3 小鼠游泳训练
1.3.1 负重力竭性训练
选用雄性昆明种小鼠,18~22g。在直径50cm的圆桶状游泳池中进行训练。水深50cm,内壁光滑,每周训练5天,每天1次。第一次下水游10min,此后逐日累加,第一周末每天游半小时;第二周末每天游1h;第三周末每天游2h。第四周负1%体重,每天游2h;第五周末增加到2%,且上、下午各训练一次,每次训练2h。如发现力竭表现(在水下10s不能上游),捞出水面休息5min后继续训练满2h。第六周于夜间再加训练1次,负3% ~7%体重,反复游至力竭,训练2h。训练中不能达到预定强度的小鼠予以淘汰。造模后,小鼠神态疲惫,毛发稀疏,眼神暗淡无光,食量大幅减少,体重显著下降(超过1/30),血红蛋白浓度降低(14%),尿蛋白排泄量显著增加(322%)[12]。
1.3.2 无负重长期训练
选用2月龄C57BL/6雌性小鼠,在高40cm、直径45cm的游泳池中游泳,水温(32士2)℃。第一天训练15min,以后每天增加5min,至120min后恒定运动时间,每周6次,每天下午2-4点进行。每天训练后均立即用清洁毛巾擦干小鼠。对照组置有铁栅网的相同温度水中30min,小鼠不运动,以尽可能减少水温和捉拿刺激对小鼠免疫功能的影响。3个月后各组静休72h后,处死大鼠。测定各项指标。结果表明:小鼠体重显著下降(超过1/30)、脾细胞数显著下降(P<0.001)[13]。
2 制备模型注意事项
2.1 模型要尽可能再现所要求的过度训练状态
复制运动员在训练过程中出现的过度训练状态,应注意其与运动性疲劳造模的区别:运动员过度训练时机体疲劳和机能下降不能在短时间内恢复。其中,短则不适症状在1~2周内恢复,长则不适症状在2周内仍不能恢复[5]。目前的研究主要是侧重于造模过程中血液指标的连续性变化(断尾或部分处死)[14-16]和运动后24h的恢复情况,缺乏更长恢复时间的生理、生化指标对照。
2.2 模型动物的选择
在进行过度训练模型的制备时要求实验动物进行较长时间的疲劳训练,而大鼠的身体素质好、生命力强、适应能力强,在过度训练的造模过程中存活率相对较高,同时大鼠体液、血液和器官组织等资源相对充足,易于取材,因此大多数学者选用大鼠进行实验。而小鼠死亡耗损率较高、资源相对有限(在数量上要予以保证),所以采用小鼠进行过度训练造模的实验很少。
2.3 训练方法的选择
2.3.1 跑台
跑台运动的强度主要由跑速和坡度决定,较容易控制。但为了使实验动物能够按照预定好的强度进行训练,一般需采取电击、声音刺激、毛刷刺激或强气流等来驱使动物进行奔跑,其产生的是非主动性运动,这是动物跑台应用中的一个局限性因素。运动时当大鼠的跑速低于跑台速度,会受到较强的刺激来强迫它以规定的强度和时间完成运动,这种刺激严格地说是一种伤害性刺激,使大鼠产生了防御性反射应激,这不是运动应激,过度应激有时会导致动物死亡[17]。有研究表明:仅仅刺激尾部的皮肤,就会引起大鼠生理上的改变,如引起去甲肾上腺素和肾上腺素的升高。而且并非所有大鼠都能学会在跑台上奔跑。易造成尾部和足部的机械性损伤,引起出血和继发感染,影响实验结果[18]。另外,不同运动时间、强度运动,对大鼠造成的过度训练程度亦有所不同。相同的运动强度下,不同的刺激方式对大鼠机体的影响也不一样。因此,研究结果进行比较与交流时,要统一刺激方法、频率等实验条件。
2.3.2 游泳
游泳所需实验设备大多简便易得。由于游泳是大鼠和小鼠的本能,采用游泳方式训练时大鼠和小鼠不会产生强烈的抵触情绪,在使用流动水或不停搅动水使动物不停运动时,实验动物承受体力外的不良刺激少,是一种卷入“情感因素”最少的训练方式[19],而且易维持运动强度在较高水平[4]。另外,游泳对心脏的影响比较显著[20]。但也存在不足:①需水量较大:为避免实验动物尾巴撑在池底休息,要求静水深要超过实验动物身长的2倍,一般大鼠游泳水深50cm以上,小鼠游泳水深20cm以上;每只实验动物占用的水面积大多在300cm2以上。②时刻监控水温,无特殊需求一般应控制在28~36℃之间,一般上下波动幅度为1~2℃。③工作量大。有的动物可游数小时而不疲劳,这就需要加大强度,如负重。常用的负重方法有尾部负重、腋下胸前负重和背后负重,不同的负重部位对动物的疲劳时间、疲劳强度是否有影响,目前还不清楚。同时,不论大鼠还是小鼠在游泳时都会排便、排尿,并释放某种“警戒物质”[21]。同批次游泳要不断地清除粪便、杂草、锯末等杂质。不同批次实验动物进行游泳时,要保证游泳水的清洁,最好是换水。另外,实验动物运动完要进行擦拭、吹风等干燥处理。不难看出从负重、准备游泳用水、清除杂质、保证水温、驱赶动物或搅动水、换水到干燥,制备游泳模型的实验工作量很大。④在大鼠游泳训练中,游泳时间越长,呼吸道感染的发生率就越高,故需对保健问题予以足够的重视[22]。
2.4 注意环境因素对模型动物的影响
造模的成败往往与环境的改变有密切关系。拥挤、饮食改变、过度光照、噪音,温度、湿度(小鼠对温度和湿度均比较敏感)、通风情况的破坏等,任何一项被忽视都可能给模型动物带来严重影响。另外,在实验过程中,对照组动物与实验组动物应保持在同一环境中,例如实验组动物游泳,对照组动物应在同温度的浅水中不进行游泳,以排除水温因素对实验的干扰[23]。实验动物在跑道上跑步,对照组动物应放在同规格跑道上,以排除环境的影响。
3 判断模型成功的典型的形态、生化指标
目前对于过度训练的诊断主要从既往病史、运动员的主观感觉、一些生理生化指标的变化以及运动实验的结果而综合判断。对动物过度训练的确定由于缺乏主述只能建立在观察其形态指标、训练史及生理、生化指标的变化等方面。
3.1 一般状况指标
3.1.1 形态的观察、运动姿势和运动能力的观察
过度训练造模过程中,实验动物的形态、运动姿势与运动性疲劳的一般状况指标大体相一致(参见本课题组关于运动性疲劳动物模型制备的报道)。但其运动能力下降更为明显:在运动训练后期实验动物易发生抽搐,运动期间需多次休息,运动至力竭的时间明显缩短。死亡率明显上升:运动训练过程中因疲劳衰竭而死亡动物明显增多,死亡率可高达50%以上[4]。
3.1.2 体重(weight)
体重的下降常常提示存在过度训练的可能,特别是体重下降超过1/30时,常被作为判断运动员过度训练的依据之一。在过度训练动物模型的制备中,也认为动物体重负增长大于1/30时,发生了过度训练[16]。这种负增长指体重的增长为负数,是自身前后变化的一种比较。一般情况下,在训练的最初阶段训练组大鼠体重与对照组均呈相似的正性增长趋势,而在训练后期大鼠体重出现明显不同的变化,对照组呈正性增长,训练组则呈负性增长。
3.2 典型的生化指标
3.2.1 血红蛋白(hemoglobin,Hb)
血红蛋白常被用作判断过度训练的指标之一。许多研究报道,无论是运动员或是动物发生过度训练时均表现出血红蛋白水平显著下降。人类过度训练时血红蛋白的诊断标准为下降20%以上[24]。以往过度训练动物模型制备中常见的比例为10%以上[4,18,25]。目前,对实验动物血红蛋白基础值的研究并不多。有学者报道:6~8周的Wistar大鼠的正常参考值[26]:雌性100~155g/L,雄性100~160g/L。而SD大鼠的血红蛋白值主要集中在140~170g/L,小鼠的血红蛋白值主要集中在100~160g/L,两者均缺乏更为科学的研究。
3.2.2 血睾酮(testosterone,T)和皮质醇(cortisol,C)
血睾酮和皮质醇作为运动员机能评定的重要指标也常应用于动物模型的评定。人类过度训练时的诊断标准为:血睾酮下降25%~30%以上,皮质醇下降20%左右或在原安静值水平上下降[24]。以往过度训练动物模型制备中常见的比例为血睾酮下降40%以上,皮质醇下降90%以上[5,27,28]。睾酮/皮质醇常被作为了解运动员身体合成代谢与分解代谢平衡状态,进而判断疲劳和竞技状态的重要指标。人类过度训练时血清游离睾酮/皮质醇的诊断标准为持续下降、下降30%以上[24]。以往过度训练动物模型制备中常见的比例为40% ~100%[5,27,28,29]。文献中睾酮/皮质醇比值主要集中在0.01~0.60之间。
3.2.3 血尿素(blood urea nitrogen,BUN)
血尿素水平可反应机体对运动负荷的适应及训练后的恢复状况。人类过度训练时血尿素连续几天晨>7~8mmol/ L[24]。以往过度训练动物模型制备中常见的比例为:次日晨升高45%以上[5,30]。有学者报道:6-8周的Wistar大鼠的正常参考值[31]:雌性 5.1~21.7mmol/L,雄性 5.8~21.4mmol/L。
3.2.4 血清肌酸激酶(creatine kinase,CK)
肌酸激酶是骨骼肌细胞中能量代谢的关键酶之一,血清肌酸激酶活性变化可作为评定肌肉承受刺激、骨骼肌微细胞损伤及其适应与恢复的一个敏感指标。人类过度训练时血清肌酸激酶的诊断标准为持续几天>200~300IU/L,升高40%[24]。以往过度训练动物模型制备中常见的比例为:次日晨升高50%以上[32-34]。由于血清酸激酶活性水平的个体差异较大,更适用于个体自身的纵向比较[35],这里不做介绍。
3.2.5 尿蛋白(urine protein)
运动后尿中蛋白质排出的数量,可以作为评定运动员身体机能状态、运动强度和量度的指标。人类过度训练时尿蛋白连续几天在训练后增加3~4倍,次日晨尿蛋白,恢复慢。以往过度训练动物模型制备中常见的比例为次日晨升高100% ~500%[5,29,36],甚至更高[8]。文献中160~200g左右的大鼠24小时尿蛋白排泄率主要集中在6~20mg/24h。尿蛋白浓度主要集中在10~90mg/L之间。
3.2.6 血乳酸(blood lactic acid)动态变化
乳酸是糖酵解产物,乳酸的堆积是引起短时剧烈运动疲劳的原因,主要通过改变体液的pH值而限制运动能力。有学者报道[37]:训练前期,随着运动时间的增加血乳酸也相应增加,说明该运动是糖酵解供能为主的运动,且由于机体酸碱平衡调节机构尚能适应该运动,乳酸还尚未成为限制运动能力的主要因素。而训练后期,由于继续施加过度负荷,机体调节能力下降,血乳酸相对于前一阶段减少,说明糖酵解供能下降,因而运动能力下降。在以糖酵解供能为主的运动中血乳酸值较前阶段相同运动后减少可视为过度训练的早期反应。
3.2.7 血糖(blood glucose)
血糖是运动中主要的能源物质之一,血糖浓度降低和肌糖原储备的减少是导致运动疲劳的重要原因[38]。反过来,过度训练时也会伴随血糖浓度的下降。人类过度训练时血糖下降7%~12%,且运动强度加大,下降增多。以往过度训练动物模型制备中常见的比例为30%以上[31,39]。文献报道的小白鼠正常血糖值的差别较大,这些差异可能与血糖的测试方法、测试时间、动物禁食与否和禁食时间等因素有关[40],这里不做介绍。
近年来也有学者致力于其他敏感指标的研究,如热休克蛋白(Hsp72),研究发现:骨骼肌中Hsp72表达下调在时间上早于血液激素指标变化和过度训练阶段发展变化过程;与血红蛋白和CK浓度变化同步[41]。
4 典型模型制备的举例
4.1 跑台
选用雄性SD大鼠,2月龄,体重(228±17)g,在BCPT-96型跑台机上进行8周的跑台训练。包括一般训练和力竭性训练各4周。动物跑台坡度为10度,每周训练6天,周日休息。
第1周:每天完成10m/min×10min的跑台运动;第2周:每天完成10m/min×10min跑后,继续加速至15m/min× 10 min;第3周:每天进行10m/min、15m/min、20m/min各10 min的持续跑台训练;第4周:每天分别进行10m/min、15m/ min、20m/min、25 m/min各10min的持续运动;第五至八周进行递增负荷跑台跑,每天以15 m/min、20 m/min、25 m/min各10 min运动后加速至30m/min、35m/min各20 min运动,并不断递增跑速,直到大鼠力竭。力竭标准:连续予大鼠施加声、光、机械刺激后,大鼠不能跑动,下跑台后连续喘息,暂时无逃避反应。末次运动48h处死大鼠,测定各项指标。结果表明:造模组大鼠体重(6%)、血红蛋白(17%)、血尿素氮(5%)、血浆总睾酮(26%)均下降[16]。
4.2 游泳
选用雄性Wistar大鼠,体重150~190g,在直径为45cm的圆形游泳池中进行训练。水深70cm,水温34~36℃。包括一般游泳训练和过度负荷训练。第1周第1次下水游10min,此后逐日累加,第1周末时每天游半小时,第2周末时每天游1h,第3周末时每天游2小时。第4周开始时于大鼠尾部负0.5%体重的重物,每天游2h,第4周末时增加负重量到体重的1%,第5周末增加到2%。第6周起每天上、下午各训练1次,上午负2%体重游2h,下午负3%~7%体重游约2h,如发现有力竭表现(在水下10s不能上浮),捞出水面休息5min后继续训练至满2h,第7至8周时,于夜间再加训1次,负3%~7%体重,反复游至力竭,训练2h。末次运动24处死大鼠,测定各项指标。结果表明:造模组大鼠体重(7%)、血红蛋白(17%)、血尿素氮(5%)、血浆总睾酮(26%)均下降[20]。
5 存在的问题及思考
过度训练动物模型制备的原则是尽量模拟运动员的训练,这就提示我们有些问题值得思考。
首先,如何创造训练条件及环境。游泳训练中,多只实验动物在一个容器内,动物间难免出现互相蹬踩、借力,这可能会引起动物呛水、憋气上串等现象发生。Ishihara K等人[42]利用电流将游泳池分隔为几个泳道从而避免了游泳动物间的物理干扰。但会不会带来其他的干扰因素还有待于进一步研究。运动员在白天训练,符合自身的24h生物节律。鼠类则一般在白天睡觉休息,晚上出来活动,而在白天进行强迫性的运动训练是不是会引起实验动物体力、免疫功能等下降呢?Wax TM等在研究C57BL/6J小鼠24h的跑笼规律时发现,小鼠在暗周期(6pm~6am)时的活动量明显大于明周期,尤以下午6时至午夜的活动量最大[43]。而这在过度训练造模过程中很少强调或体现。
第二,训练方案的制定。运动方式的选择:有学者把运动员过度训练分为交感性和副交感性过度训练。交感性过度训练的特点是兴奋、烦躁,多发于无氧类型的运动项目,如短跑、跳跃等;副交感性过度训练的特点是机体表现抑郁、沮丧,多发于有氧类型的运动项目,如长跑、游泳等[44]。而学者在制备动物模型时多关注于跑步、游泳及其引起的过度训练,对跳跃类项目研究较少。有学者用大耳兔制备了运动性疲劳模型[45],而利用大耳兔进行过度训练的研究还未见报道。而转笼(是一种自主运动无需外界刺激强迫,现阶段该模型主要用于机体适应性生理变化的研究)、举重(属于自主性随意运动,对动物无侵害,易进行调控,适用于重复阻力训练的运动能力和生理学机制等多方面的研究,但为了维持其较大强度的运动有时需要食物刺激)、负重爬(可负重,主要用于骨骼肌肥大的造模,为了维持其较大强度的运动有时需要食物或电刺激等)[46]在过度训练的模型中应用亦少见。运动强度的确定:在现有的动物模型中,对运动负荷的描述多为定性描述,如“耐力训练”、“大负荷训练”、“中等强度运动”“递增负荷运动”等,而无法做到对大鼠运动负荷的定量描述。有学者尝试用摄氧量[47]、血乳酸[48-49]等指标对强度进行监测,但其在国内应用的并不多。运动时间:在以往模型中,训练时间从15天到3个月不等,属于短期过度训练还是长期过度训练亦没有一定的界定标准。
第三,对造模成功与否的评价或诊断。对运动员过度训练的诊断往往参照所选指标的正常参考范围,如所测值高于或低于正常范围的上下线,则说明运动员某方面出现了异常。各种实验动物是否也有这样的正常参考值呢?王玉良等人曾对小鼠、Wistar大白鼠血清尿素氮、血红蛋白、血糖等指标进行了抽样测试与统计分析,但对其他实验动物及部分常见血尿指标还没有测试、对比,还缺乏更为系统的研究。(从整体上看,实验动物血尿指标的正常参考值较难确定,这与实验动物的所在地区、种属、受试动物的日龄、饲养管理条件、测试方法、测试时间等因素有关,因此系统研究的工作量将会很大。)再者,参照运动员训练前后的生理生化指标变化幅度,实验动物是不是和人类的变化幅度一致呢?目前,研究者报道的模型动物的指标变化幅度均大于人类的变化幅度,但程度不一。如果实验动物过度训练后各指标变化幅度本身就大于人类的变化幅度,那又该如何呢?末次运动后指标测试时间的确定:运动员发生过度训练时恢复较慢、时间较长,实验动物也应该如此。现阶段各指标的测试时间主要是末次运动后24h、48h,偶见72h,缺乏更为系统的、动态的参照。
[1]唐智明,邓玉强,金其贯.补充谷氨酰胺对过度训练大鼠肾脏滤过屏障形态结构和尿液成分的影响[J].西安体育学院学报,2009,26(1):77-80.
[2]Fábio S Lira,José C Rosa,Gustavo D Pimentel,et al.Inflammation and adipose tissue:effects of progressive load training in rats[J].Lipids in Health and Disease,2010,9:109-118.
[3]步 斌,肖邦良,步 宏,等.模拟过度训练对肝组织病理和酶组织化学影响的实验研究[J].成都体育学院学报,1995,21 (3):59-64.
[4]李宁川,金其贯,孙新荣.力竭性游泳训练对建立过度训练动物模型的作用[J].体育与科学,2000,21(1):53-55.
[5]李 丽,常 波.辽东楤木对过度训练大鼠肾功能损伤预防作用的研究[J].北京体育大学学报,2009,32(4):64-66.
[6]李素萍,常 波.微量全血单细胞凝胶电泳评定过度训练大鼠淋巴细胞DNA损伤[J].中国组织工程研究与临床康复,2008,12(38):7547-7550.
[7]刘建华,常 波.辽东楤木对过度训练大鼠心肌线粒体游离钙的影响[J].天津体育学院学报,2006,21(5):423-425.
[8]田振军,熊正英,郭 进,等.大鼠游泳过度训练模型的建立及心室构型改建研究[J].陕西师范大学学报(自然科学版),1996,24(3):104-109.
[9]田振军.过度训练对心肌间质胶原、心肌舒缩性能和AngⅡ变化的研究[J].中国应用生理学杂志,2002,18(1):63-67.
[10]田振军,熊正英.过度训练对大鼠心肌钙细胞化学及EDAX能谱分析和心肌收缩性能变化的研究[J].体育科学,1997,17 (3):57-60.
[11]张忠芳,赵 丹,赵雪俭,等.过度训练对大鼠睾丸AQP9表达的影响[J].北华大学学报(自然科学版),2006,7(5):407-410.
[12]李骁君,王广峰,余俊明,等.过度训练对小鼠NK细胞、单核吞噬细胞系统活性的影响[J].山东体育学院学报,2001,17(1): 30-31.
[13]姚毓才,张宝慧.运动训练对小鼠NK细胞杀伤功能和脾细胞IL-2产生能力的影响[J].中国运动医学杂志,1995,14(1): 17-20.
[14]冯小东,秦 香.过度训练状态下大鼠肠黏膜超微结构和免疫病理性变化研究[J].天津体育学院学报,2008,23(1):71-73.
[15]刘铁民,吴衍忠.过度训练状态下大鼠心肌线粒体病理性变化的研究[J].北京体育大学学报,2004,27(2):219-221.
[16]郑 陆,隋 波,潘力平,等.过度训练动物模型的建立[J].中国运动医学杂志,2000,19(2):179-181.
[17]杨晓红,王 震,徐国琴.过度训练动物模型分析[J].广州体育学院学报,2010,30(3):88-91.
[18]朱 全,浦钧宗.大鼠游泳训练在运动实验中的应用方法[J].中国运动医学杂志,1996,15(2):125-129.
[19]Kramer K,Dijkstra H,Bast A.Control of physical exercise of rats in a swimming basin[J].Physiol Behav,1993,53(2):271-276.
[20]朱 全,浦钧宗,张 敏.游泳方法建立大鼠模拟过度训练模型[J].中国运动医学杂志,1997,20(2):137-140.
[21]Abel EL,Bilitzke PJ.Adrenal activity does not mediate alarm substance reaction in the forced swim test[J].Psychoneuroendocrinology,1992,17(2-3):255-259.
[22]毛 杰.大白鼠游泳训练的实验方法和运动模型[J].武汉体育学院学报,2004(3):32-34,41.
[23]田振军,张志琪.小鼠运动性疲劳相关基因筛选的初步研究[J].中国运动医学杂,2002,21(1):4-6.
[24]冯炜权.运动疲劳及过度训练的生化诊断-运动生物化学动态之三[J].北京体育大学学报,2000,23(4):498-502.
[25]杨建昌,王 军,陈乐琴,等.过度训练对大鼠胃肠道组织形态及功能的影响[J].中国体育科技,2005,41(5):123-126.
[26]李显华,张 宏,向绍杰,等.Wistar大白鼠血红蛋白的抽样测试与统计分析[J].动物学杂志,2000,35(1):24-26.
[27]王海军.过度训练对大鼠肠道免疫功能的影响及谷氨酰胺-大豆多肽的干预作用[D].扬州:扬州大学,2008.
[28]刘志二,赵大林,李进华,等.人参茎叶提取物对过度训练大鼠肝组织氧化损伤的预防作用[J].沈阳体育学院学报,2009,28 (5):59-61,70.
[29]律海涛,何 叙.补充谷氨酰胺和大豆多肽对过度训练大鼠血清睾酮和皮质酮水平影响的研究[J].中国体育科技,2008,44 (5):126-129.
[30]常波,衣雪洁,于莹.过度训练和补糖对大鼠骨骼GLUT4和PKb活性的影响[J].武汉体育学院学报,2010,44(1):68-72.
[31]向绍杰,杜佳林,张 宏,等.6~8周龄Wistar大白鼠血清尿素氮的抽样测试与统计分析[J].动物学杂志,1999,34(3):25-27.
[32]伊木清,周丽丽,许葆华,等.过度游泳训练及力竭降低大鼠骨骼肌肌浆网Ca2+相对释放能力[J].中国运动医学杂志,2005,24(6):668-675.
[33]庞立杰.大鼠过度训练后血清cTnI、CK-MB和TNF-α的变化及复方丹参的干预效应[D].太原:山西大学,2007.
[34]王 沛.过度训练对大鼠血清心肌酶活性的影响[J].西安体育学院学报,2001,18(2):35-37.
[35]华 冰,董 柔,苏全生.大强度离心运动大鼠不同时相骨骼肌结构及血白细胞介素6、肌酸激酶、肌酸激酶同工酶的变化[J].中国组织工程研究与临床康复,2009,13(28):5534-5538.
[36]徐 昕,岑浩望,尤春英,等,模拟过度训练对大鼠肾脏细胞内钙稳态的影响[J].中国运动医学杂志,1999,18(3):233-235.
[37]陈协芳,程旭光.大鼠过度训练时间与血乳酸值变化的关系探讨[J].四川体育科学,1997(1):21-22.
[38]李世成,方子龙,王启荣,等.个体化补充抗疲劳促恢复饮料对运动人体血糖应答及体能恢复的影响[J].西安体育学院学报,2010,27(3):325-330.
[39]衣雪洁,张庆荣,于 莹.健脾补糖对过度训练脾虚大鼠骨骼肌GLUT4和P38活性的影响[J].北京体育大学学报,2007,30 (9):1212-1215.
[40]王玉良,李显华,张 宏,等.沈阳地区小白鼠血糖值的测试与分析[J].动物学杂志,1994,29(2):33-36,53.
[41]张学林.热休克蛋白72(Hsp72)作为过度训练监测指标的研究[D].石家庄:河北师范大学,2004.
[42]Ishihara K,Yamada A,Mita Y,et al.Improved swimming pool achieves higher reproducibility and sensitivity to effect of food components as ergogenic AIDS[J].J Nutr Sci Vitaminol(Tokyo),2009,55(3):301-308.
[43]陈运才,姚志彬,顾耀铭,等.长期运动对小鼠运动功能年龄变化的影响-1.旷场试验[J].中国运动医学杂志,1996,15(1):2-6.
[44]任昭君,孙 丹,殷 红.分析过度训练的产生与诊断[J].吉林体育学院学报,2004,20(2):79-80.
[45]刘 波,邹 明,马 建,等.运动性形体疲劳“肝肾亏虚”动物模型的实验研究[J].中国中医骨伤科杂志,2001,9(4):20-23.
[46]李俊平,徐玉明,王瑞元.常用动物运动模型的方式与发展[J].北京体育大学学报,2006,29(12):1669-1671.
[47]严 翊,谢敏豪.大鼠游泳运动的最大乳酸稳态负荷的确定——乳酸最小试验[J].北京体育大学学报,2010,33(9):43-45,51.
[48]张 勇,文 立,时庆德,等.大鼠运动状态下摄氧量测定方法的初步研究——小动物密闭跑台结合气相色谱分析法测定[J].中国运动医学杂志,1998,17(4):339-341.
[49]Leandro CG,Levada AC,Hirabara SM,et al.program of moderate physical training for Wistar rats based on maximal oxygen consumption[J].J Strength Cond Res,2007,21(3):751-756.
A Summarizing Study on Preparation of Overtraining Animal Model
LI Li1,CHANG Bo2
(1.PE Department of Jiaying University,Meizhou 514015,Guangdong,China;
2.School of Sports Human Science,Shenyang Sport University,Shenyang 110102,Liaoning,China)
This paper consolidated and analyzed overtraining animal model,its cautions and assessment,problem in overtraining animal model.It provided reference for in-depth research on overtraining.
overtraining;experimental animal;model
G804.7
A
1004-0560(2011)05-0077-06
2011-05-22;
2011-06-25
国家自然科学基金课题面上项目(编号:30971414);辽宁省高等学校优秀人才支持计划(2011年)。
李 丽(1979-),女,讲师,硕士,主要研究方向为运动人体科学、体育人文社会学。
责任编辑:乔艳春
◂体育教育训练学
