门静脉高压静脉曲张破裂出血的诊断和处理
2011-11-08WilliamCAREY
William CAREY
Cleveland Clinic Lerner College of Medicine,Cleveland,Ohio,USA
肝硬化门静脉高压患者伴有特殊的危险因素,包括消化道(肠腔内)出血、腹水、肝性脑病,其中出血是最危险的致死性并发症,亦是本文论述的重点。门静脉高压指门静脉压力的持续增高(正常值为2~5 mm Hg)(1 mm Hg=0.133 kPa),轻度门静脉压力增高(6~10 mm Hg)不会造成食管静脉曲张,但压力进一步增高时,则有食管静脉曲张的可能。当门静脉压力>12 mm Hg 时,可能发生静脉曲张破裂出血。肝窦通常作为门静脉高压分型的参考指标(见表1),并可明确门静脉高压相关情况。
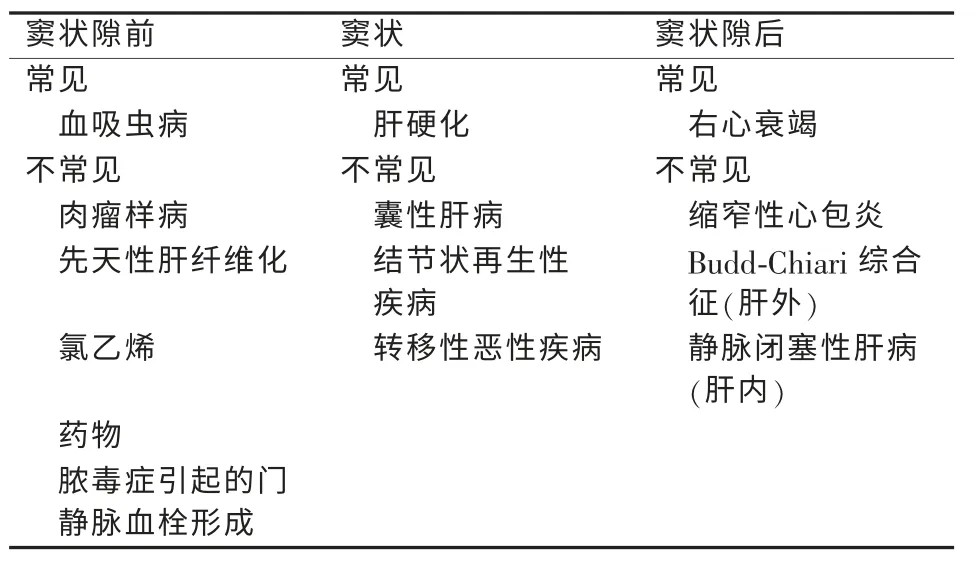
表1 门静脉高压的原因
流行病学和危险因素
在全球多数地区,肝硬化是造成门静脉高压的最常见原因;在血吸虫流行地区,血吸虫病是门静脉高压的常见原因。肝硬化相关发病率和死亡率的主要原因为发生静脉曲张破裂出血,其是门静脉高压的直接结局。过去30年中,虽然有效的干预措施使静脉曲张破裂出血的死亡率降低了3 倍,但其仍为致死性疾病。有研究显示,1980~2000年期间Child-Pugh A 级患者的死亡率由9%降至0,B 级患者由46%降至0,C 级患者由70%降至30%,这主要得益于出血前、出血期间和出血后的有效干预措施。
食管静脉曲张的病理生理和自然病程
门静脉压力取决于门静脉血流量和门静脉血管阻力。病理生理过程间的相互影响导致门静脉压力改变。可逆性因素进一步促进肝纤维化和再生结节形成,从而加重肝组织结构变形,导致肝血管消失。活化的星状细胞位于窦周间隙,具有收缩性。发生肝硬化时,肝星状细胞的增殖、胶原分泌和收缩性明显增加,并对多种血管活性物质产生反应。血管扩张剂产生增加及其反应增强以及血管收缩剂如作用于肝星状细胞的一氧化氮产生减少及其反应减弱,导致肝硬化血管张力增加。此外,肝硬化高血流动力学状态或使用全身性血管扩张剂,致门静脉循环血流量增加,亦是影响门静脉压力的可逆性因素之一。因此,门静脉压力增高可能由门静脉血流阻力增加和门静脉血流量增加共同造成。
门体静脉吻合术的主要部位
门静脉压力增高导致上游血管扩张,通常这种情况不会引起临床问题。但当曲张静脉位于食管或胃时,易致出血。其他重要的临床静脉曲张部位包括肛直肠连接处、前腹壁和腹膜后,此处不予进一步讨论。物理因素如血管弹性、曲张静脉内或肠腔内压力是静脉曲张破裂出血的重要因素。其中曲张静脉壁张力(T)是决定静脉曲张破裂的主要因素,根据La Place 定律,其可由跨膜压(TP)、血管半径(r)和血管壁厚度(w)计算得出。计算公式:T=(Tp×r)×w-1。
静脉曲张可发生扩张、迂曲、壁薄,因此其破裂出血的危险增加。Child-Pugh 评分系统对确定肝病严重程度的价值较高,可评估肝硬化静脉曲张风险(见表2)。肝硬化患者的静脉曲张年发生率为8%,小静脉曲张进展为大静脉曲张的年发生率为8%,这种进展与肝硬化分级(如Child-Pugh B 级和C级)、酒精性肝硬化、基线内镜检查示红色征相关。
肝硬化静脉曲张破裂出血的年发生率为5%~15%,预测首次出血的重要因素为:①曲张静脉的大小;②内镜下红色征及其严重程度;③肝功能异常程度(Child-Pugh 评分较高)。一项前瞻性多中心研究评估了首诊为肝硬化静脉曲张且未接受任何干预的患者1年内的出血可能,发现危险因素相互作用,参与静脉曲张破裂出血的发生(见表3)。

表2 Child-Pugh 评分
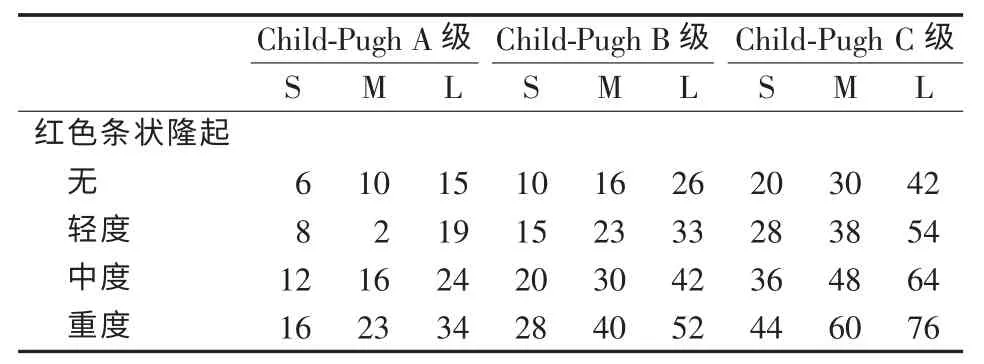
表3 红色条状隆起以及Child-Pugh A、B和C 级评估肝硬化食管静脉曲张患者1年内初次出血风险的可能性(%)
食管静脉曲张的处理
虽然静脉曲张本身并不会产生任何症状,但仍需采取各项措施以检出静脉曲张,即所有肝硬化患者在首诊或随后的出血间期均需筛查食管静脉曲张。严重肝功能异常和内镜下见红色征者需每年随访。内镜仍是检出静脉曲张的最有效方式,且能在发现静脉曲张时予以及时处理。筛查食管静脉曲张的新技术如经鼻内镜和胶囊内镜,可能在未来有一定的应用前景。超声或MRI 影像学检查示肝脏僵硬可有效避免部分患者行内镜检查,肝脏僵硬度较低与肝静脉压力梯度(HVPG)<10 mm Hg 的相关性较高。
食管静脉曲张的处理
预防
迄今仍难以确定肝硬化静脉曲张的初级预防措施。有限证据尚不足以证实β 受体阻滞剂可有效预防肝硬化食管静脉曲张的形成,其他新型疗法仍在研发中。
食管静脉曲张破裂出血的初级预防
食管静脉曲张的初级预防是指预防首次静脉曲张破裂出血的措施。预防性措施如β 受体阻滞剂和内镜静脉曲张结扎(EVL)可明显降低首次静脉曲张破裂出血率。近期研究证实筛查和预防性措施可有效降低肝硬化出血风险。
非选择性β 受体阻滞剂(普萘洛尔、纳多洛尔)可协同β 受体阻滞剂和β2 受体阻滞剂来降低门静脉压力,前者可降低心输出量,后者可收缩内脏血管而减少门静脉血流量。HVPG 下降可降低出血风险,HVPG<12 mm Hg 不存在出血风险,且患者生存率提高。普萘洛尔的经典起始剂量为20 mg bid,纳多洛尔为40 mg/d,目前推荐的调整剂量可使心率较基线水平下降25%,并维持55~60次/min。β 受体阻滞剂的常见不良反应包括轻度头晕、疲劳、肢端发冷、支气管收缩和阳痿。对哮喘、胰岛素依赖性糖尿病、周围血管病患者,应谨慎使用。停用β 受体阻滞剂后有再出血风险,因此推荐长期预防性治疗。其他药物的相关资料有限。卡维地洛降低门静脉压力的作用可能较普萘洛尔更强,近期一项随机对照试验结果显示卡维地洛6.25~12.5 mg/d 的疗效明显优于EVL,但目前有限的资料并不推荐将卡维地洛作为静脉曲张破裂出血的一线预防治疗措施。
EVL 的目的是根除静脉曲张,其安全性较高,在很大程度上已取代了硬化剂注射治疗。多数研究证实EVL 预防首次出血的疗效等同或优于β 受体阻滞剂。但套扎具有诱导大静脉曲张破裂出血致并发症的风险,因此需谨慎使用。EVL 的其他局限性包括需内镜专家参与和常规随访。
有研究对手术或采取放射学措施建立分流以降低门静脉压力作为出血的初级预防措施进行了评估,但目前暂不推荐。与传统治疗方法相比,分流术的死亡率较高,且TIPS 有致肝性脑病的可能。
对出血风险明显增加的静脉曲张患者,包括中等或大静脉曲张、存在特征性红色征(此类征象提示出血风险增加)以及肝硬化Child-Pugh B 级或C级患者,需积极采取干预措施以降低出血可能,可使用β 受体阻滞剂或EVL。
活动性食管静脉曲张破裂出血的处理
血管活性药物治疗:活动性静脉曲张破裂出血属紧急情况,需立即予静脉补液或输血、血管活性药物、抗生素治疗和内镜处理。急性上消化道出血的处理包括:①快速复苏、维持循环稳定;②评估出血的发生及其严重程度;③局部定位出血点;④控制活动性出血的发作。
初始复苏需周围静脉大量输入,患者应评估直立位的血压变化,其可提示大量失血。输血前需行配型和交叉配型,并检测血红蛋白、血细胞比容、血小板计数和凝血酶原时间。
予患者输注类晶体或胶体溶液以使血压和尿排出量恢复正常值。快速扩充血容量以维持血流动力学稳定,并保证血细胞比容不高于25%。需警惕过量补液致容量负荷增加,从而导致门静脉高压反弹和诱发再出血的风险。对有明显凝血病和(或)血小板减少的患者,可考虑行新鲜冰冻血浆和血小板输注。
内镜检查前需行紧急插管,以防止吸入的并发症,尤其是肝性脑病患者。此外,应持续监测患者的血压和心率。
疑似静脉曲张破裂出血,即使未经内镜检查证实,亦需接受血管收缩剂如生长抑素(或其类似物奥曲肽)治疗。药理剂量的奥曲肽可收缩血管,在美国其是治疗静脉曲张破裂出血的选择之一,而特利加压素目前暂未被美国食品与药品管理局(FDA)批准用于治疗。奥曲肽的优势在于无严重不良反应和无需监测。以50 μg 快速注射后予50 μg/h 持续静滴2~5 d,同时亦可考虑使用相同剂量的伐普肽。
特利加压素是血管加压素的合成类似物,但因生物活性延长、不良反应减少而优于其母体血管加压素。两者均可致血管强力收缩,因此可引起缺血和坏死,故需在监测下谨慎使用(如重症监护室)。有研究采用特利加压素单独用于控制初始静脉曲张破裂出血,结果显示控制出血的同时,可改善患者的生存率。
抗生素治疗:短期抗生素治疗急性静脉曲张破裂出血可降低细菌感染率、降低再出血率以及改善生存率。肝硬化患者发生静脉曲张破裂出血时应给予抗生素治疗。常用的抗生素包括喹诺酮类如氧氟沙星、诺氟沙星、环丙沙星和头孢菌素类。可用于预防肝硬化合并胃肠出血患者细菌感染的抗生素疗法见表4。
一旦患者的血液动力学稳定,应行内镜检查以明确出血的原因并治疗食管静脉曲张。EVL 是目前最常用的方法,其可将曲张静脉抽吸至内镜的抽吸管,并在基底部放置橡皮圈。一次内镜治疗可放置多个橡皮圈。EVL 可使80%的患者停止出血,且每个月可重复行EVL 直至静脉曲张消失。治疗后,常规推荐随访6~12个月。EVL 对静脉曲张的疗效较直接注射硬化剂更佳,且食管破裂和再出血的发生率更低。EVL 技术上不可行时,可行硬化疗法。
内镜下治疗严重活动性出血存在一定难度时,可采用食管气囊填塞术,需应用特殊设计的导管。但一旦将球囊放气,该疗法的再出血率很高,且并发症较多,如吸入和食管破裂。食管气囊填塞术常用于TIPS 内镜或X 线下调控的过渡。
TIPS 是一种放射学步骤,经位于门静脉和肝静脉之间的颈内静脉放置支架,从而降低门静脉压力。最有效的控制食管或胃静脉曲张破裂出血的方法为控制出血和预防并发出血。TIPS 有两个主要缺点,即高技术特征限制了其应用以及分流术有导致肝性脑病的倾向,但其可有效控制药物和内镜方法不能控制的急性静脉曲张破裂出血。下文将对TIPS 的作用作一探讨。

表4 对急性食管静脉曲张破裂出血有益的抗生素疗法
食管静脉曲张破裂出血的二级预防
二级预防指降低出血可能性和指数出血发生后预防并发出血的干预措施。指数出血后的最初6周内再出血风险最高,随后逐渐降低;出血后第6个月,再出血风险与未发生出血的肝硬化患者相当。二级预防的干预包括以下一种或以上措施:内镜下治疗静脉曲张;药物治疗降低门静脉压力;X线下放置支架的介入治疗降低门静脉压力。如患者的肝功能严重受损,有肝移植的适应证,应行肝移植术。
β 受体阻滞剂和EVL 仍是降低再出血风险的两种最常用的方法,疗效均优于未接受治疗者。虽然部分研究认为β 受体阻滞剂的疗效更佳,但EVL 预防出血的疗效常等同或优于β 受体阻滞剂。一项研究证实EVL 对降低再出血率具有一定优势,但β 受体阻滞剂(联合单硝酸异山梨酯)的生存率更佳,推测其疗效并不依赖出血机制。
如EVL和β 受体阻滞剂均能有效预防再出血,两者联合可能是最佳止血策略。一项纳入多项随机试验的荟萃分析比较了内镜联合β 受体阻滞剂与两者单独应用的疗效,该荟萃分析的研究设计和检索词见表5,其主要局限之一为多数研究采用的内镜治疗为硬化疗法而非圈套结扎。实践指南推荐β 受体阻滞剂(联合或不联合血管扩张剂如硝酸甘油)或内镜下重复圈套结扎(至少在静脉曲张消失前,常应联合β 受体阻滞剂)。每种止血方法均有相应的研究证据支持。关于二级出血预防的最优方案的争论仍将持续。最近一项随机对照试验认为EVL 对二级出血预防的疗效并不优于单用β 受体阻滞剂。
TIPS和门体分流术可降低再出血率,但增加了肝性脑病的发生风险。虽然有研究证实TIPS和门体分流术的疗效、生存期、门体脑病发生率和费用相当,但目前更多采用TIPS 而非门体分流术。最近一项多中心随机临床试验显示,接受远侧脾肾分流术患者的5年再出血率为5.5%,TIPS 为10.5%。
如上所述,由于脑病并发症,现已将TIPS 列为食管静脉曲张处理的二级预防。一项里程碑式的随机对照试验从一个全新的角度阐述了早期TIPS 在进展期肝病(6<Child-Pugh<14)患者静脉曲张破裂出血中的应用。该研究中,所有患者均接受内镜治疗、血管活性药物治疗和抗生素治疗。静脉曲张破裂出血不超过24 h 的患者随机接受TIPS(聚四氟乙烯覆膜支架)或持续血管活性治疗,3~5 d 后接受长期β 受体阻滞剂或内镜下结扎(现有护理标准)。随访期间,早期TIPS组的出血率更低(P<0.001),生存率更高(P=0.01)。早期TIPS组和传统治疗组的1年无出血率分别为97%和50%,实际1年生存率分别为81%和61%(P<0.001),而肝性脑病的发生率无明显差异。
本文对预防继发性出血的建议:食管静脉曲张破裂出血患者应给予干预措施,从而降低再出血的危险。对Child-Pugh 评分为5 或6 分者,最好的治疗方法为联合EVL和β 受体阻滞剂。对Child-Pugh评分为7~13 分者,早期放置聚四氟乙烯覆膜支架的疗效最佳。对Child-Pugh 评分较高者,推荐EVL治疗。此外,有适应证的患者应接受肝移植术。
胃静脉曲张
胃静脉曲张根据其与食管静脉曲张的关系及其在胃内的位置分为:
1.胃食管静脉曲张(GOV)是食管静脉曲张的延伸,分为GOV1和GOV2。GOV1 为食管静脉曲张的延续,沿胃小弯走行,而GOV2 沿胃底走行。
2.孤立性胃静脉曲张(IGV)不伴有食管静脉曲张。IGV1 位于胃底,迂曲复杂;IGV2 位于胃体、胃窦或围绕幽门。发生IGV1 说明可能形成脾静脉血栓。
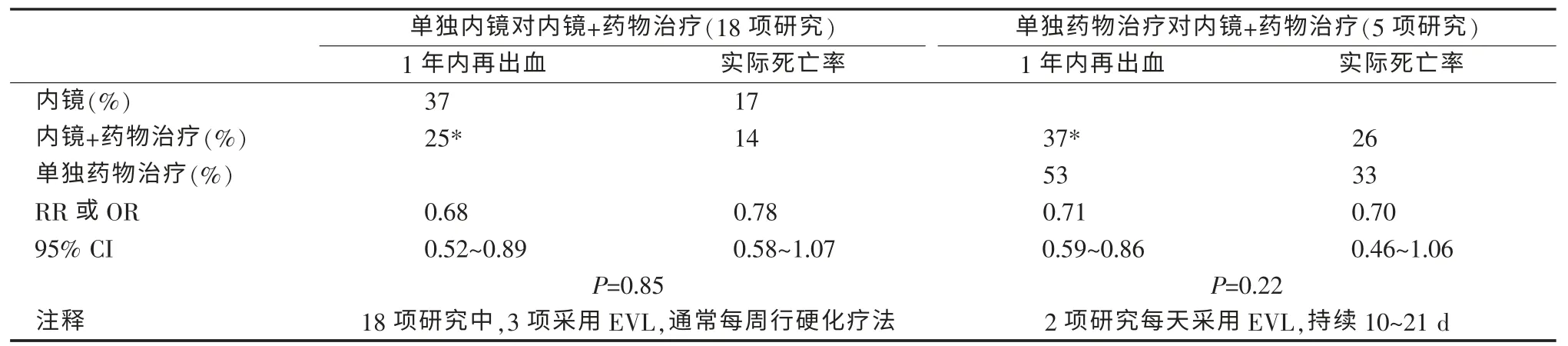
表5 单独和联合疗法对降低食管静脉曲张再出血死亡风险的比较
胃静脉曲张的处理
胃静脉曲张的急性出血
胃静脉曲张破裂的出血量通常较大,并伴有大量呕血。对胃底静脉曲张破裂出血者,应采用组织黏合剂如N-丁基-氰基丙烯酸盐、异丁基-2-氰基丙烯酸盐或凝血酶先行内镜下静脉曲张填塞术,其对首次出血的控制效果更好,且再出血率更低。然而,由于该疗法与菌血症发生有关,因此对进展期肝病和严重出血的高危患者,应考虑给予抗生素预防。对内镜治疗失败者或伴有早期再出血的胃底静脉曲患者,可考虑行TIPS。
胃静脉曲张的二级预防
首次出血痊愈者发生再出血和死亡的危险性很高,故应接受预防出血复发的治疗。用于胃静脉曲张二级预防的方法为非选择性β 受体阻滞剂、硝酸盐类和TIPS、分流术。非选择性β 受体阻滞剂可单独应用或与硝酸盐类联用,但联合应用的不良反应发生率较高。有限的数据推荐以内镜治疗胃静脉曲张。TIPS 适用于静脉曲张破裂出血复发的患者。如有相关专家,建议行分流术,其肝性脑病的发生率较低。如上述治疗均失败,考虑行肝移植术。
门静脉高压性胃病
门静脉高压患者约30%~50%的出血源自非静脉曲张,而多数非静脉曲张破裂出血由门静脉高压性胃病引起,内镜下表现为条纹状红斑。这些红斑可发生无痛的少量出血,导致缺铁性贫血。
应采取治疗措施直接控制症状,主要为缺铁性贫血。若出血严重且持续,应采取局部治疗如氩离子凝固术或其他黏膜切除术。TIPS 可降低门静脉高压性胃病的出血。与门静脉高压出血潜在相关的另一种胃黏膜病变为胃窦血管扩张。上述病变以及门静脉高压性胃病对TIPS 的反应欠佳,通常采用氩离子凝固术治疗。
(略)
