溃疡性结肠炎患者炎症黏膜中IL-6、IL-23的表达及其临床意义
2011-05-15曲海霞卫红军王
厉 洁* 曲海霞卫红军王 青#
青岛市市立医院消化科1(266071) 病理科2
溃疡性结肠炎(UC)是一种病因和发病机制不明的结直肠慢性非特异性炎症性疾病,相关研究证实一些促炎细胞因子,如白细胞介素-6(IL-6)、IL-8、IL-17、肿瘤坏死因子-α(TNF-α)等在 UC 的发病机制中起重要作用[1,2],而IL-23可使记忆T细胞活化并产生IL-17和IL-6,引起慢性肠道炎症[3]。本研究旨在探讨UC患者结直肠炎症黏膜中IL-6、IL-23的表达情况及其临床意义,为UC的临床诊断和治疗提供新的思路。
对象与方法
一、研究对象
青岛市市立医院2008年1月~2010年5月门诊和住院UC患者42例纳入研究,其中男16例,女 26 例,年龄 18~75 岁,平均(47.69±16.61)岁,发病时间0.3~5.2个月,平均(2.10±1.14)个月。所有患者均参照《对我国炎症性肠病诊断治疗规范的共识意见》[4],根据病史、临床表现、结肠镜和病理检查结果确诊为UC,并排除各种致病菌引起的急性感染性肠炎、肠道寄生虫病、肠结核、缺血性肠病、放射性肠炎、结直肠肿瘤等疾病以及全身性疾病引起的肠道病变。根据Sutherland疾病活动指数,缓解期患者10例,轻、中、重度活动期患者分别为9例、10例和 13例[4]。
随机选取18名同期于青岛市市立医院行健康体检、入组前两个月内无胃肠道疾病史且未接受过任何药物治疗者作为正常对照,其中男8例,女10例,年龄 20~65 岁,平均(44.61±15.52)岁。
两组间性别构成、年龄差异无统计学意义。标本获取经研究对象知情同意。
二、方法
1.标本采集:全部研究对象行电子结肠镜检查,UC患者取炎症病变较明显处结肠或直肠黏膜3~5块,健康体检者取正常结肠黏膜3~5块。活检标本4%甲醛溶液固定,石蜡包埋,3μm厚连续切片,用于免疫组化染色。
2.免疫组化染色:即用型非生物素免疫组化EliVisionTMplus检测试剂盒和DAB显色剂为福州迈新生物技术开发有限公司产品,兔抗人IL-6多克隆抗体、兔抗人IL-23多克隆抗体为北京博奥森生物技术有限公司产品,操作按试剂盒说明书进行。以已知IL-6/IL-23染色阳性的切片作为阳性对照,以PBS代替一抗作为阴性对照。
结果判断:IL-6、IL-23阳性染色呈棕黄色,IL-6主要表达于细胞膜和(或)细胞质,IL-23主要表达于细胞质。先作定性观察,再于高倍镜下(×400)随机选取5个互不重叠的视野,以Image-Pro Plus 6.0软件测定每一视野中阳性染色物质的累积光密度值,取均值作为该切片中IL-6/IL-23的相对表达量。
三、统计学分析
结 果
UC患者结直肠炎症黏膜中的IL-6、IL-23相对表达量显著高于正常对照组。按疾病活动度分组分析,轻、中、重度活动期患者两者表达量依次增高,组间两两比较差异均有统计学意义,且均显著高于缓解期患者和正常对照组;缓解期患者仅IL-23表达量显著高于正常对照组,IL-6表达量与正常对照组无明显差异(见表1)。
表1 各组肠黏膜IL-6、IL-23相对表达量比较( )
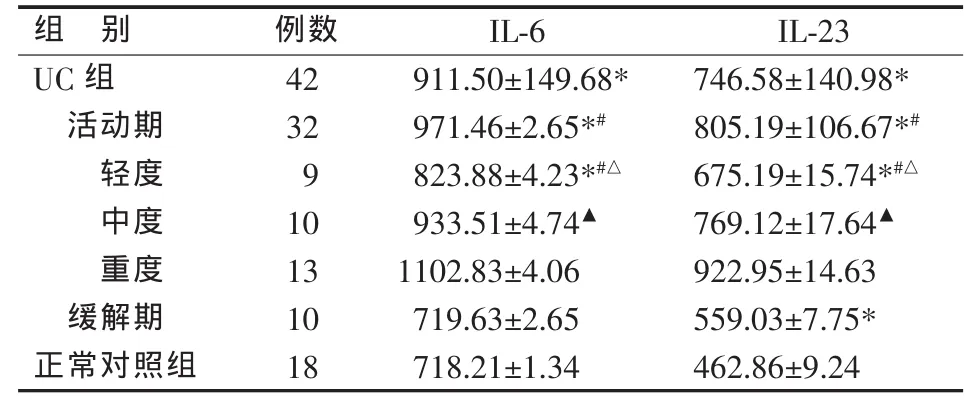
表1 各组肠黏膜IL-6、IL-23相对表达量比较( )
*与正常对照组比较,P<0.05;#与缓解期比较,P<0.05;△与中度活动期比较,P<0.05;▲与重度活动期比较,P<0.05
组 别 例数 IL-6 IL-23 UC 组 42 911.50±149.68* 746.58±140.98*活动期 32 971.46±2.65*# 805.19±106.67*#轻度 9 823.88±4.23*#△ 675.19±15.74*#△中度 10 933.51±4.74▲ 769.12±17.64▲重度 13 1102.83±4.06 922.95±14.63缓解期 10 719.63±2.65 559.03±7.75*正常对照组 18 718.21±1.34 462.86±9.24
讨 论
近年来炎症性肠病(IBD)的患病率呈上升趋势,然而其病因和发病机制至今未明,目前观点认为可能与环境、遗传、免疫、黏膜屏障功能等多种因素有关,免疫因素在IBD发病机制中的作用日益受到关注,免疫调节异常和细胞信号转导通路成为IBD研究中最活跃的领域。细胞因子是一类由免疫细胞或非免疫细胞产生,能在细胞间传递信息,具有免疫调节和效应功能的蛋白质或小分子多肽,可广泛调控机体免疫应答和造血功能,并参与炎症、损伤等病理过程。在遗传易感宿主中,抗原呈递细胞与局部肠道菌群之间的相互作用导致肠黏膜中的CD4+T细胞异常活化,持续释放TNF-α、IL-6、IL-12、IL-23、IL-27、IL-17 等促炎细胞因子,参与了IBD的发生。
IL-6可由活化的T细胞、单核细胞或巨噬细胞以及成纤维细胞、内皮细胞等多种细胞产生,是一种多功能细胞因子,可作用于多种效应细胞,参与包括造血功能调节、免疫反应、急性期反应等在内的多个病理生理过程。IL-6抗凋亡信号在IBD的免疫发病机制中起关键作用。IBD时,IL-6诱导转录因子STAT3活化,STAT3继而诱导抗凋亡因子bcl-2和bcl-xL,使T细胞对细胞凋亡产生抵抗,引起炎症部位T细胞积聚,最终导致慢性肠道炎症[5]。研究发现活动期UC患者结肠黏膜组织中的IL-6水平显著高于非IBD结肠炎患者,并与内镜下炎症严重程度相关[1],UC患者的血清IL-6水平可反映疾病活动度[6]。
IL-12在T细胞介导的自身免疫和炎症反应中起重要作用。IL-23为IL-12家族成员之一,为一由p40和p19两个亚基组成的异二聚体,其中p19为IL-23所特有,p40则为IL-23与IL-12所共有。IL-23主要由抗原呈递细胞如树突细胞和巨噬细胞产生,通过与靶细胞膜上的IL-23受体(IL-23R)结合,激活一系列胞内信号分子,主要效应细胞为记忆T细胞、自然杀伤细胞、巨噬细胞和部分树突细胞[7]。研究[3]显示IL-23而非IL-12为维持慢性肠道炎症所必需。具有组织归巢特性的记忆CD4+T细胞可特异性地为IL-23所激活,产生促炎细胞因子IL-17和IL-6,引起慢性肠道炎症以及其他自身免疫炎症性疾病。
Th17是一类不同于Th1和Th2细胞的独立的CD4+T细胞亚群,因特异性分泌IL-17而得名,而IL-17对自身免疫炎症性疾病、过敏性疾病的发生、发展具有关键意义[8]。传统观点认为克罗恩病(CD)与 IL-12、干扰素-γ(IFN-γ)、TNF-α 细胞因子轴介导的Th1型反应相关,而UC则与IL-4、IL-5、IL-13轴介导的Th2型反应关系密切,但近年研究发现IL-23/IL-17轴在IBD的发病机制中可能居关键地位[9]。研究[2,10]显示UC患者炎症黏膜中的IL-17表达显著高于非炎症黏膜和正常结肠黏膜,血清IL-17水平亦显著升高,活动期UC患者炎症黏膜中的IL-17阳性细胞数显著高于缓解期患者。IL-23可诱导幼稚CD4+T细胞分化为高致病性Th17细胞,产生 IL-17、IL-17F、IL-6、TNF-α 等细胞因子,发挥促炎作用;阻断IL-23或其下游细胞因子IL-17和IL-6可显著抑制IBD动物模型的病情进展[11]。另有研究[12]发现,在感染或炎症状态下,IL-6可诱导幼稚CD4+T细胞分化为Th17细胞。上述研究结果提示,IL-6、IL-23通过IL-23/IL-17轴相互联系,共同参与了UC慢性肠道炎症的发生和维持。本研究中,活动期UC患者结直肠炎症黏膜中的IL-23表达量显著高于缓解期患者和正常对照组,并随疾病活动度的进展依次增高,IL-6表达的变化趋势与IL-23一致,证实两者在UC的发生、发展中起重要作用,而且其黏膜表达水平可反映UC疾病活动度。此外,本研究发现缓解期UC患者仅IL-23表达量显著高于正常对照组,IL-6表达量与正常对照组无明显差异,推测可能与IL-6在急性期反应中发挥关键作用,而IL-23在慢性炎症的维持方面起重要作用有关。关于两者间相互作用的具体机制,尚有待进一步研究。随着分子生物学及其相关技术的发展,人们将会对细胞因子尤其是IL类细胞因子在UC免疫发病机制中的作用有更深入的认识,从而为UC的临床诊断和有效靶向治疗提供依据。
1 Ishiguro Y.Mucosal proinflammatory cytokine production correlates with endoscopic activity of ulcerative colitis.J Gastroenterol,1999,34(1):66-74.
2 Fujino S,Andoh A,Bamba S,et al.Increased expression of interleukin 17 in inflammatory bowel disease.Gut,2003,52(1):65-70.
3 Yen D,Cheung J,Scheerens H,et al.IL-23 is essential for T cell-mediated colitis and promotes inflammation via IL-17 and IL-6.J Clin Invest,2006,116(5):1310-1316.
4 欧阳钦,胡品津,钱家鸣,等.中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见.胃肠病学,2007,12(8):488-495.
5 Mudter J,Neurath MF.Il-6 signaling in inflammatory boweldisease:pathophysiologicalrole and clinical relevance.Inflamm Bowel Dis,2007,13(8):1016-1023.
6 UmeharaY,KudoM,NakaokaR,etal.Serum proinflammatory cytokines and adhesion molecules in ulcerative colitis.Hepatogastroenterology,2006,53(72):879-882.
7 Kreymborg K,Böhlmann U,Becher B.IL-23:changing the verdict on IL-12 function in inflammation and autoimmunity.Expert Opin Ther Targets,2005,9(6):1123-1136.
8 Park H,Li Z,Yang XO,et al.A distinct lineage of CD4 T cellsregulatestissueinflammation by producing interleukin 17.Nat Immunol,2005,6(11):1133-1141.
9 肖南平,欧阳钦.IL-23/IL-17轴与炎症性肠病.国际消化病杂志,2008,28(3):234-236.
10 Rovedatti L,Kudo T,Biancheri P,et al.Differential regulation ofinterleukin 17 and interferon gamma production in inflammatory bowel disease.Gut,2009,58(12):1629-1636.
11 Iwakura Y,Ishigame H.The IL-23/IL-17 axisin inflammation.J Clin Invest,2006,116(5):1218-1222.
12 BettelliE,CarrierY,Gao W,etal.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells.Nature,2006,441(7090):235-238.
