温郁金中二萜类化合物C抑制结肠腺癌细胞增殖并诱导凋亡的实验研究*
2011-05-15雁吕烁马忠俊
沈 雁吕 宾# 张 烁马忠俊
浙江中医药大学附属第一医院消化内科1(310006) 浙江大学药学院现代中药研究所2
结肠癌是临床上常见的消化系恶性肿瘤,其发病率和死亡率在所有癌症中均位居前列,5年生存率低,且治疗费用高昂[1,2]。Fearon等[3]提出了结肠癌的多步骤发生理论,即正常黏膜→增生黏膜→腺瘤→原位癌→浸润癌的发生途径。推测该过程或许与体内结肠腺上皮细胞表型恶性转化、增殖与凋亡行为失衡有关。
温郁金是姜科姜黄属植物温郁金(Curcuma wenyujinY.H.Chen et C.Ling)的干燥块根,其药性寒,味辛、苦,归心、肝、胆经,具有活血止痛、行气解郁、清心凉血、利胆退黄等功效[4]。从传统中药中提取活性成分为开发新型抗肿瘤药物开辟了广阔的道路。研究[5]发现,温郁金提取物在体外能明显抑制胃癌的发生和发展。二萜类化合物C为温郁金醚提物中的活性单体。本实验通过观察二萜类化合物C对结肠腺癌SW620细胞增殖、凋亡和细胞周期的影响,旨在探讨其抗肿瘤作用的分子机制,从而为结肠癌的药物研发以及临床治疗提供新选择。
材料与方法
一、药物制备、细胞株、主要试剂和仪器
温郁金干燥根茎 10 kg,以 8倍量(80 L)95%乙醇回流提取4次,回收溶剂得粗提物247 g。总浸膏以500 ml水分散均匀,依次用1倍量(500 ml)石油醚、二氯甲烷、正丁醇萃取,得二氯甲烷萃取物95.1 g。二氯甲烷部分以石油醚/乙酸乙酯为洗脱剂,硅胶柱层析得10个流分A~J。流分E以乙腈(70%)-水(30%)为流动相,制备色谱进一步分离得8个流分(0~80 min,每 10 min 1个流分),即 E1~E8。 其中 E8 以乙腈(45%)-水(55%)等度洗脱,二次制备得二萜类化合物 C(5.0 mg,tR 43.7 min),分子质量为380,分子式为C22H36O5[6]。
人结肠腺癌细胞株SW620购自中国科学院上海生科院细胞库。Leibovitz’s L-15培养基、0.25%胰酶(杭州吉诺生物医药技术有限公司)、胎牛血清(Gibco公司)、MTT 干粉(Ameresco公司)、Annexin V-FITC/PI凋亡试剂盒(Biouniquer公司)、PI 染液(Sigma 公司)、5-氟尿嘧啶(5-Fu)注射液(天津金耀氨基酸有限公司,分子质量130.08)。
倒置相差显微镜(Olympus公司),CO2培养箱、离心机(Thermo),酶标仪(BioTek),流式细胞仪(BD公司)。
二、方法
1.细胞培养:将SW620细胞加入含10%胎牛血清的L-15培养基中,置于37℃、5%CO2培养箱中常规培养。
2.MTT法检测细胞增殖情况:取对数生长期细胞,用含10%胎牛血清的L-15培养基调整细胞浓度为 5×104/ml,接种于 96 孔培养板,每孔 200μl,培养24 h后吸弃上清液。实验组每孔加入含二萜类化合物C的L-15培养基200μl,使其终浓度分别为10~70μg/ml,共7组;阴性对照组每孔加入200μl培养基;空白对照组加不含细胞的血清培养基;阳性对照组每孔加入含5-Fu的培养基200μl,使其终浓度同二萜类化合物C;每个剂量设3个复孔。培养24、48和72 h后,每孔加5 mg/ml MTT溶液20μl,继续培养4 h,然后用快速翻板法弃上清;每孔加 DMSO 150μl,振荡 10 min,上酶标仪测定吸光度(A)值,检测波长为490 nm。计算细胞生长抑制率,抑制率(%)=[(阴性对照组A值-空白对照组A值)-(实验对照组A值-空白对照组A值)]/(阴性对照组A值-空白对照组A值)×100%。
3.倒置相差显微镜观察细胞形态学变化:取对数生长期细胞,用含10%胎牛血清的L-15培养基调整细胞浓度为2×105/ml,取3 ml加入中号培养皿,培养24 h后吸弃上清液;将含二萜类化合物C的培养基3 ml加入培养皿中,使其终浓度分别为40、55、70μg/ml。 同时以加入等体积培养基的细胞作为阴性对照组,每组重复3次。倒置相差显微镜下观察48 h后细胞生长状态。
4.细胞凋亡和细胞周期变化的检测:取对数生长期细胞,用含10%胎牛血清的L-15培养基调整细胞浓度为2×105/ml,取3 ml加入中号培养皿,培养24 h后吸弃上清液;将含二萜类化合物C的培养基3 ml加入培养皿中,使其终浓度分别为40、55、70μg/ml。同时以加入等体积培养基的细胞作为阴性对照组。分别培养24 h、48 h后,以不含EDTA的胰酶消化细胞,PBS漂洗2次,2000 r/min离心5 min。先加入500μl Binding Buffer悬浮细胞后,再加入5μl Annexin V-FITC混匀,室温避光反应5~15 min后,上机检测细胞凋亡率;加入70%冷乙醇,4℃固定12 h,再加入1 ml PI染液,室温避光孵育20 min后,上机检测细胞周期。激发波长为488 nm,并用相应软件进行数据分析。
三、统计学分析
结 果
一、MTT测定结果
不同浓度的二萜类化合物C和5-Fu对SW620细胞增殖均有不同程度的抑制作用,其中60μg/ml二萜类化合物C作用72 h时的细胞抑制率最高,达95.30%±1.48%。同一时间点二萜类化合物C的抑制能力随其浓度的增加而升高(P<0.05);除70μg/ml组作用48 h和72 h时的抑制率无明显差异外,其余同一浓度二萜类化合物C的抑制能力随其作用时间的延长而升高(P<0.05)。作用24 h、48 h和72 h时,二萜类化合物C对SW620细胞的半数有效抑制浓度分别为 28.31、15.58 和 6.14μg/ml。 此外,二萜类化合物C的抑制能力均显著高于相同时间点和浓度的 5-Fu(P<0.01)(见图1)。
二、倒置相差显微镜结果
不同浓度二萜类化合物C均能诱导SW620细胞凋亡,呈现出特征性形态改变,如胞膜皱缩、细胞逐渐变圆、体积缩小、细胞间隙增宽、细胞从基质上脱离等;且这种改变与药物浓度呈正相关,70μg/ml组多数SW620细胞处于晚期凋亡阶段,培养基中可见较多的细胞碎片漂浮。而阴性对照组SW620细胞呈梭形、簇状生长,并随着时间的延长,细胞数目增多、密度增高(见图2)。
三、细胞凋亡结果
不同浓度二萜类化合物C均能诱导活性SW620细胞进入早期和(或)晚期凋亡阶段。同一时间点其促凋亡能力随浓度的增加而升高(P<0.01),且同一浓度二萜类化合物C作用48 h时的SW620细胞凋亡率(包括早期和晚期)显著高于24 h组(P<0.01)。 70μg/ml二萜类化合物 C 作用 48 h 时的凋亡率最高,达84.97%±0.58%(见图3)。
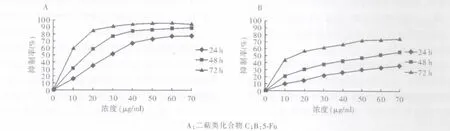
图1 不同浓度二萜类化合物C和5-Fu作用24、48和72 h时对SW620细胞增殖的抑制率
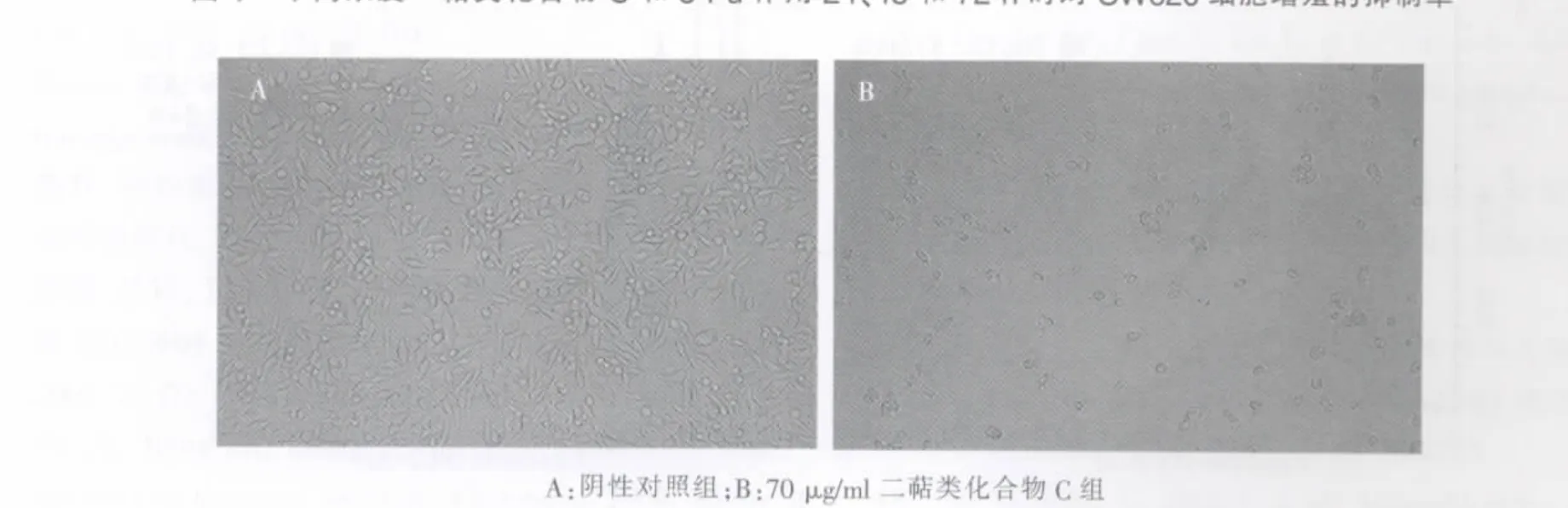
图2 二萜类化合物C作用48 h时SW620细胞的形态学特点
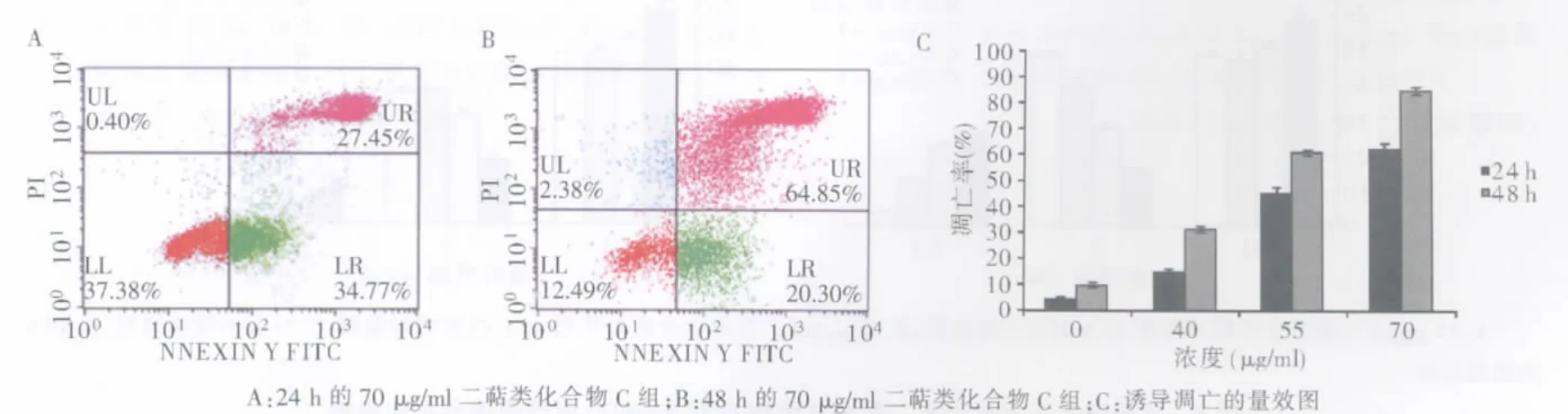
图3 不同浓度不同时间点二萜类化合物C诱导SW620细胞凋亡的比较
作用24或48 h后,各浓度二萜类化合物C组的G2期比例较阴性对照组明显减少,差异均有统计学意义(P<0.01);作用48 h后,同一浓度二萜类化合物C的G2期比例较24 h组减少,差异有统计学意义(P<0.01)。此外,二萜类化合物C作用48 h后,55、70μg/ml组 SW620 细胞周期于 G0/G1期前可见明显的亚二倍体峰(凋亡峰)(见图4)。
讨 论
肿瘤的发生是人类正常细胞增殖与凋亡之间平衡失调导致表型恶性转化的结果:周围环境中各种促癌信号的过度刺激引起细胞内外有序的信号传递网络发生异常,进而导致下游各种基因突变并逐渐累积,最终促使细胞由正常表型发展成为增殖失控、凋亡失能的癌性表型。因此,通过阻滞细胞周期以抑制增殖过程的启动或促进细胞凋亡,均能起到较好的抗癌作用。
温郁金是临床上常用的中药,其抗肿瘤作用正日益受到关注。本课题的前期研究[5]结果显示,温郁金的水提物、醚提物和醇提物在体外均能抑制人胃癌SGC-7901细胞增殖,且后两者尚具有良好的凋亡诱导效应,其作用机制可能与下调血管内皮生长因子(vascular endothelial growth factor,VEGF)、环氧合酶-2(cyclooxygenase-2,COX-2)水平以减少瘤灶内微血管密度(microvessel density,MVD)[7]、提高血浆和组织中生长抑素表达[8]、抑制胰岛素样生长因子(insulin-like growth factor,IGF)Ⅰ和Ⅱ的分泌[9]等有关。近来对温郁金抗癌成分的研究主要集中于姜黄素和榄香烯,而其他活性成分的相关研究较少。国内外大量研究发现,温郁金醇提物的主要成分姜黄素可分别以肿瘤细胞本身[10]、肿瘤相关蛋白[11,12]、相关基因[13]、相关信号转导通路[14,15]为靶标发挥高效的抗癌活性;温郁金醚提物的主要成分榄香烯能通过下调Bcl-2表达[16,17]、抑制端粒酶活性[17]、阻断细胞周期[18]等方式诱导癌细胞凋亡,具有多效性。
在此基础上,本研究从温郁金醚提物中提取了一种新型二萜类化合物C,其化学结构和性质均有别于姜黄素和榄香烯[6]。同时,选择临床上结直肠癌的主要化疗药物5-Fu作为阳性对照,其能通过在体内转化为5-氟尿嘧啶脱氧核苷酸(5F-dUMP)而抑制脱氧胸苷酸合成酶,影响DNA的生物合成,抑制肿瘤细胞的分裂增殖。本研究结果显示二萜类化合物C对SW620细胞增殖具有明显的抑制作用,并呈时间依赖性和浓度依赖性,且二萜类化合物C的抑制作用明显强于相同时间点和浓度的5-Fu。倒置相差显微镜可见二萜类化合物C能引起SW620细胞发生典型的凋亡改变,如细胞皱缩、变圆、体积缩小、脱离基质等。流式细胞术结果提示,二萜类化合物C能随着作用时间的延长和浓度的增高而使处于G2期细胞的比例明显减少,并显著诱导细胞凋亡。
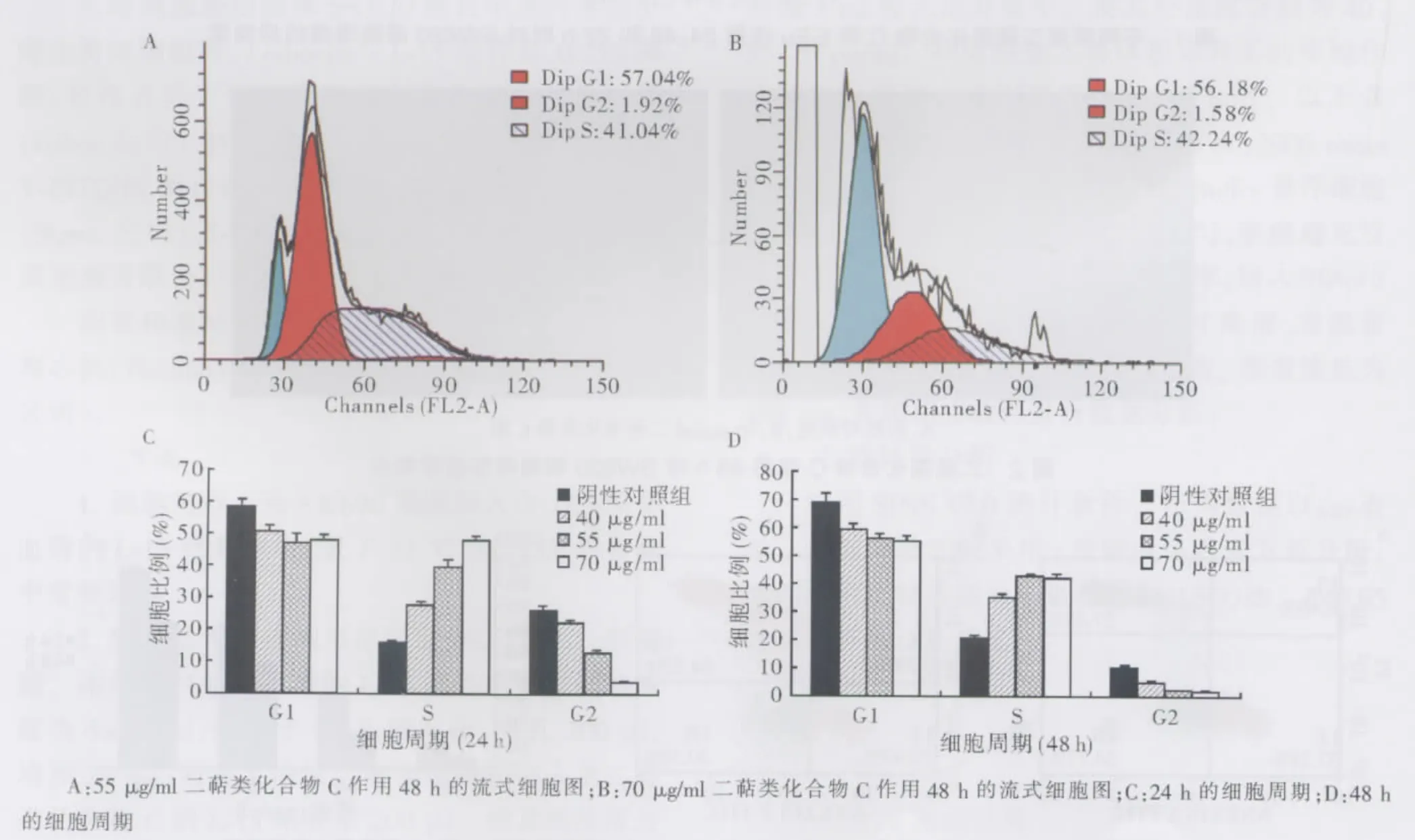
图4 不同浓度不同时间点二萜类化合物C对SW620细胞周期分布的影响
综上所述,温郁金醚提物中二萜类化合物C对人结肠腺癌SW620细胞具有高效的抑制增殖和促进凋亡的作用,可能是其发挥抗肿瘤作用的机制之一。但鉴于人类生命活动调控的复杂性,二萜类化合物C的抗癌效应或许存在更多潜在机制,有待进一步探讨。更为深入的研究将为温郁金抗肿瘤成分的开发及其临床应用产生巨大的推动作用,为结肠癌的药物治疗开拓全新的思路。
1 Jemal A,Tiwari RC,Murray T,et al;American Cancer Society.Cancer statistics,2004.CA Cancer J Clin,2004,54(1):8-29.
2 Maroun J,Ng E,Berthelot JM,et al.Lifetime costs of colon and rectal cancer management in Canada.Chronic Dis Can,2003,24(4):91-101.
3 Fearon ER,Vogelstein B.A genetic model for colorectal tumorigenesis.Cell,1990,61(5):759-767.
4 甑权.药性论.见:高学敏主编.中药学.北京:中国中医药出版社,2002.367-368.
5 徐毅,吕宾,丁志山,等.不同温郁金提取物抑制胃癌细胞SGC-7901增殖和诱导凋亡的实验研究.浙江医学,2004,26(7):503-505.
6 Ma ZJ,Meng ZK,Zhang P.Chemical constituents from the radix of Curcuma wenyujin.Fitoterapia,2009,80(6):374-376.
7 俞林峰,吕宾,徐磊,等.温郁金对饮用MNNG大鼠胃黏膜血管内皮生长因子和环氧合酶-2表达的影响.胃肠病学,2007,12(3):140-143.
8 徐毅,吕宾,项柏康,等.温郁金对鼠血浆和胃组织生长抑素水平的影响.中国中西医结合消化杂志,2004,12(4):222-224.
9 何必立,吕宾,徐毅,等.温郁金对胃癌细胞的抑制作用及其对IGF-Ⅰ、IGF-Ⅱ表达的影响.世界华人消化杂志,2004,12(11):2761-2763.
10 Pae HO,Jeong SO,Jeong GS,et al.Curcumin induces pro-apoptotic endoplasmic reticulum stress in human leukemia HL-60 cells.Biochem Biophys Res Commun,2007,353(4):1040-1045.
11 Mahmmoud YA.Modulation of protein kinase C by curcumin;inhibition and activation switched by calcium ions.Br J Pharmacol,2007,150(2):200-208.
12 Lee SS,Tsai CH,Yang SF,et al.Hypoxia inducible factor-1α expression in areca quid chewing-associated oral squamous cell carcinomas.Oral Dis,2010,16(7):696-701.
13 Chen A,Xu J,Johnson AC.Curcumin inhibits human colon cancer cell growth by suppressing gene expression of epidermal growth factor receptor through reducing the activity of the transcription factor Egr-1.Oncogene,2006,25(2):278-287.
14 Beevers CS,Li F,Liu L,et al.Curcumin inhibits the mammalian target of rapamycin-mediated signaling pathways in cancer cells.Int J Cancer,2006,119(4):757-764.
15 Beevers CS,Chen L,Liu L,et al.Curcumin disrupts the Mammalian target of rapamycin-raptor complex.Cancer Res,2009,69(3):1000-1008.
16 陈浩,师亮,成志勇,等.β-榄香烯对人骨髓瘤细胞RPMI-8226增殖与凋亡的影响.中国实验血液学杂志,2010,18(2):368-371.
17 陈春美,杨卫忠,王春华,等.榄香烯诱导人脑胶质瘤U251细胞凋亡及对端粒酶活性和hTERT表达影响的研究.中国肿瘤临,2006,33(5):280-283.
18 Li X,Wang G,Zhao J,et al.Antiproliferative effect of beta-elemene in chemoresistant ovarian carcinoma cells is mediated through arrest of the cell cycle at the G2-M phase.Cell Mol Life Sci,2005,62(7-8):894-904.
