巴斯德醋酸杆菌AC2005乙醇脱氢酶基因克隆与蛋白序列分析
2011-11-02张科平贾钧辉骆健美
张科平,郑 宇,贾钧辉,骆健美,王 敏
(工业发酵微生物教育部重点实验室(天津科技大学),天津科技大学生物工程学院,天津300457)
巴斯德醋酸杆菌AC2005乙醇脱氢酶基因克隆与蛋白序列分析
张科平,郑 宇,贾钧辉,骆健美,王 敏*
(工业发酵微生物教育部重点实验室(天津科技大学),天津科技大学生物工程学院,天津300457)
以具有优良醋酸发酵性能的巴斯德醋酸杆菌AC2005基因组DNA为模板,利用PCR的方法分别克隆了编码乙醇脱氢酶亚基I和乙醇脱氢酶亚基 II的基因adhA和adhB。序列分析表明,adhA与 GenBank已报道的序列(accession number:D13893.1)具有94%的同源性,氨基酸序列同源性达98%;adhB与 GenBank已报道的序列(accession number:D13893.1)同源性为93%,氨基酸序列同源性达97%。利用TMHMM 2.0软件,对乙醇脱氢酶跨膜结构进行了分析,发现乙醇脱氢酶亚基I和乙醇脱氢酶亚基II均为膜结合蛋白。利用Swiss-Model在线软件模拟了巴斯德醋酸杆菌AC2005乙醇脱氢酶亚基I的三维立体结构。该研究对该酶的结构和功能的进一步分析提供了基础。
巴斯德醋酸杆菌,乙醇脱氢酶,基因克隆,序列分析
醋酸是食醋的主要成分。醋酸发酵是利用醋酸菌(Acetic Acid Bacteria)完成从乙醇到醋酸的氧化反应,醋酸菌中含有多种乙醇氧化酶,其中结合于细胞膜上依赖 PQQ作为辅酶的乙醇脱氢酶(Alcohol Dehydrogenase,ADH)和乙醛脱氢酶 (Aldehyde Dehydrogenase,ALDH)是醋酸发酵过程中起主要作用的酶[1]。醋杆菌属(Acetobacter)由于具有较强的乙醇氧化能力并且能够在发酵过程中积累大量乙酸,而被广泛应用于醋酸发酵中[2-4]。通过比较多株醋酸生产菌中乙醇脱氢酶的性质,发现定位于细胞膜上的乙醇脱氢酶的催化活性和其对高浓度醋酸的耐受性,对醋酸发酵和醋酸菌在高醋酸浓度条件下的生长非常重要[5],并且乙醇脱氢酶的温度稳定性也决定了醋酸菌在较高温度下生长的能力[6]。不同的醋酸菌在不同的生长环境下,其乙醇脱氢酶的表达有很大的区别[7],在醋酸菌中过量表达乙醇脱氢酶可以提高醋酸的生产速率和醋酸浓度[1]。本课题组在前期工作中筛选得到一株醋酸发酵菌株——巴斯德醋酸杆菌(Acetobacter pasteurianus)AC2005(中国普通微生物菌种保藏中心编号:CGMCC 3089)[8]。通过比较发现,巴斯德醋酸杆菌AC2005对酒精和醋酸的耐受性均优于目前工业上常用的醋酸生产菌株恶臭醋酸杆菌(Acetobacter rancens)AS1.41[8]。因此,本论文采用生物信息学的方法对巴斯德醋酸杆菌AC2005膜结合的乙醇脱氢酶进行研究,该研究将为今后对该酶的结构和功能分析提供理论参考。
1 材料与方法
1.1 材料与仪器
巴斯德醋酸杆菌(Acetobactorpasteurianus) AC2005 由本实验室保存;大肠杆菌(Escherichia coli)DH5α感受态、Taq-DNA聚合酶、dNTPs、DNA分子量标准 北京全式金生物技术有限公司;T载体pJET 1.2 Fermentas公司;T4 DNA连接酶 Promega公司;限制性内切酶 宝生物工程(大连)有限公司;凝胶纯化试剂盒(Column DNA back试剂盒) 北京天恩泽基因科技有限公司;引物合成及测序 由上海生工生物工程有限公司完成;其余试剂 为国产分析纯。
PCR仪 德国BIOMETRA公司;全自动凝胶成像仪 美国Bio-Rad公司;电泳仪和电泳槽 北京六一仪器厂。
1.2 实验方法
1.2.1 DNA和质粒的提取 DNA和质粒的提取方法按参考文献[9]所述方法进行。
1.2.2 PCR扩增 根据GenBank报道的巴斯德醋酸杆菌乙醇脱氢酶亚基 I和亚基II的基因 adhA和adhB全序列设计PCR引物,为了便于重组克隆质粒的酶切鉴定,在引物中加入了酶切位点。
1.2.2.1 乙醇脱氢酶亚基I基因adhA的克隆 上游引物P1:5’-CGGGGTACCATGACCCGCCCCGCCTCCGCCAAGA-3’,下划线为Kpn I酶切位点;下游引物P2:5’-ACGCGTCGACTTAGGGGTTAATGCCAAGTGTCG-3’,下划线为Sal I酶切位点。
PCR反应体系:总 DNA模板2μL;引物 P1 (20μmol/L)0.5μL,P2(20μmol/L)0.5μL;dNTPs (2.5mmol/L each)5μL;5×buffer 10μL;FastPfu DNA聚合酶(2.5U/μL)0.5μL,加 ddH2O补足至50μL。PCR反应条件:95℃变性5min,95℃变性50s,50℃退火30s,72℃延伸150s,设置30个循环,最后72℃延伸10min使产物延伸完全。PCR产物4℃保存。
1.2.2.2 乙醇脱氢酶亚基II基因adhB的克隆 上游引物P3:5’-CGGGATCCGATGATGATGAACAGGCTAAAAACTGC-3’,下划线为Bam HⅠ酶切位点;下游引物P4:5’-CCCAAGCTTTTACTGGGCTTCATCCACACCAGCA-3’,下划线为HindⅢ酶切位点。
PCR反应体系:总 DNA模板2μL;引物 P3 (20μmol/L)0.5μL,P4(20μmol/L)0.5μL;dNTPs (2.5mM each)5μL;5×buffer 10μL;FastPfu DNA聚合酶(2.5U/μL)0.5μL,加ddH2O补足至50μL。PCR反应条件:96℃变性5min,96℃变性50s,55℃退火30s,72℃延伸80s,设置3个循环;96℃变性50s,57℃退火30s,72℃延伸80s,设置4个循环;96℃变性50s,59℃退火30s,72℃延伸80s,设置22个循环;总共设置30个循环,最后72℃延伸10min使产物延伸完全。PCR产物4℃保存。
1.2.3 扩增产物的克隆与测序 将纯化后的目的条带,分别与pJET 1.2克隆载体混合,16℃过夜进行连接反应。将连接产物转入大肠杆菌DH5α,双酶切筛选阳性重组质粒,并将鉴定正确的重组质粒pJET-adhA和pJET-adhB委托上海生工生物工程有限公司进行测序。
1.2.4 基因与蛋白序列分析 利用NCBI Blast软件(http://www.ncbi.nlm.nih.gov/)进行序列同源性分析;TMHMM 2.0 软 件 (http://www.cbs.dtu.dk/ services/TMHMM/)进行蛋白跨膜区域分析;Swiss-Model在线软件(http://swissmodel.expasy.org/)进行蛋白三维立体结构预测。
2 结果与讨论
2.1 乙醇脱氢酶亚基I和亚基II编码基因——adhA和adhB的克隆
分别以巴斯德醋酸杆菌AC2005的基因组DNA为模板,用设计好的引物进行PCR扩增,PCR产物经1.0%琼脂糖凝胶电泳检测,结果如图1所示。结果表明,PCR扩增产物条带单一,大小分别约2.2kb和1.4kb,与预期一致,说明PCR扩增结果正确,将回收的目的条带分别命名为adhA和adhB。将回收的目的片段同T载体连接、转化,将鉴定正确的阳性克隆子交由上海生工生物工程有限公司测序。
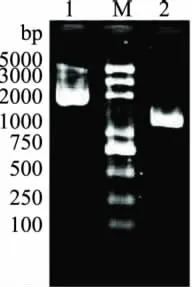
图1 基因adhA和基因adhB的PCR产物
2.2 adhA和adhB的序列分析
根据测序结果,adhA基因和adhB基因全长分别为2229bp和1314bp,起始密码子均为ATG,终止密码子均为TAA,分别编码724个氨基酸残基和472个氨基酸残基。
2.3 基因同源性分析
2.3.1 adhA序列同源性分析 将测序所得adhA序列与GenBank数据库中的序列进行比对,发现与已公布的巴斯德醋酸杆菌乙醇脱氢酶亚基I基因(accession number:D13893.1)同源性最高,为94%,蛋白序列相似度达98%,说明所克隆序列为巴斯德醋酸杆菌乙醇脱氢酶亚基I基因。
2.3.2 adhB序列的同源性分析 将测序所得adhB序列与GenBank数据库中的序列进行Blast,发现与已公布的巴斯德醋酸杆菌乙醇脱氢酶亚基Ⅱ基因(accession number:D13893.1)同源性最高,为93%,蛋白序列相似度达97%,说明所克隆序列为巴斯德醋酸杆菌乙醇脱氢酶亚基Ⅱ基因。
2.4 物理参数和跨膜螺旋及拓扑结构预测
2.4.1 乙醇脱氢酶亚基I的物理参数和跨膜螺旋及拓扑结构预测
2.4.1.1 物理参数分析 如表1所示。
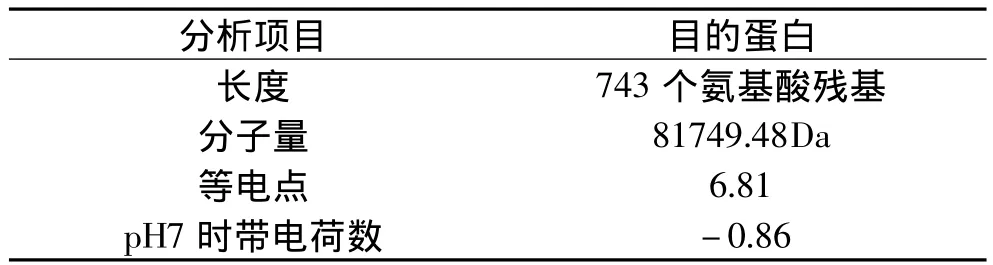
表1 乙醇脱氢酶亚基I物理参数分析
2.4.1.2 跨膜螺旋及拓扑结构预测 利用TMHMM 2.0软件,对乙醇脱氢酶亚基I进行跨膜分析。如图2所示,从第1~20位氨基酸残基位于细胞膜内,从2~43位和527~555位氨基酸残基结合在细胞膜上,其余位氨基酸残基位于细胞膜外。
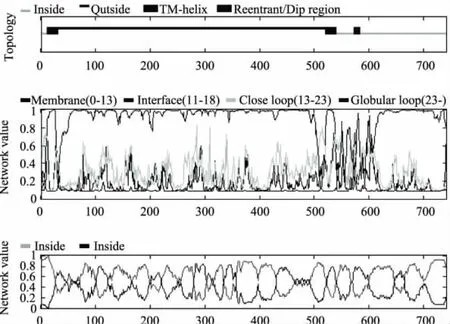
图2 乙醇脱氢酶亚基I的跨膜螺旋及拓扑结构预测
2.4.2 乙醇脱氢酶亚基Ⅱ的物理参数和跨膜螺旋及拓扑结构预测
2.4.2.1 物理参数分析 如表2所示。

表2 乙醇脱氢酶亚基II物理参数分析
2.4.2.2 跨膜螺旋及拓扑结构预测 利用TMHMM 2.0软件,对乙醇脱氢酶亚基II进行跨膜分析。如图3所示,第5~22位氨基酸残基定位在细胞膜上,第23~473位氨基酸残基位于细胞膜外。
2.5 三维立体结构预测
在Swiss-Model蛋白数据库中对乙醇脱氢酶亚基Ⅰ蛋白序列进行分析,以同源性较高的假单胞菌中依赖PQQ作为辅酶的乙醇脱氢酶为模型,模拟出了乙醇脱氢酶亚基Ⅰ的三维立体结构,如图4所示。
通过对克隆得到的巴斯德醋酸杆菌AC2005乙醇脱氢酶的基因序列分析表明,AC2005中的乙醇脱氢酶为膜结合蛋白,该酶是醋酸发酵过程中的关键酶。醋酸菌中膜结合乙醇脱氢酶的活性大小,影响乙醇氧化的速率和菌株对醋酸的耐受性,从而影响醋酸发酵的产物浓度[10-11]。乙醇脱氢酶的活性降低会导致菌体生长缓慢和醋酸发酵浓度降低[11],而在醋酸菌中过量表达乙醇脱氢酶可以提高醋酸发酵的生产速率和产物浓度[1]。乙醇脱氢酶亚基I主要负责同底物乙醇和辅酶PQQ的结合,而亚基II主要负责乙醇脱氢酶在细胞膜上的定位和电子的传递[7]。因此,在今后的研究过程中可以重点研究定位于细胞膜外的氨基酸残基序列对乙醇脱氢酶活性和醋酸生产的影响,即重点研究亚基I从43~527位氨基酸残基序列和亚基II从第23~473位氨基酸残基序列变化对乙醇脱氢酶活性的影响和醋酸发酵的影响。

图3 乙醇脱氢酶亚基Ⅱ的跨膜螺旋及拓扑结构预测

图4 乙醇脱氢酶亚基I三维立体结构预测
3 结论
本研究采用 PCR技术,从巴斯德醋酸杆菌AC2005基因组中成功克隆了分别编码乙醇脱氢酶亚基Ⅰ和亚基II的adhA和adhB基因。利用生物信息学软件分析表明,adhA和adhB所编码的乙醇脱氢酶为膜结合蛋白。乙醇脱氢酶亚基I从第43~527位氨基酸残基序列、亚基Ⅱ从第23~473位氨基酸残基序列定位与细胞膜外,这些氨基酸残基对乙醇脱氢酶的催化活性和电子传递起重要作用,该研究为进一步对该酶的结构和功能进行分析提供了参考。
[1]Hanada T,Kashima Y,Kosugi A,et al.A gene encoding phosphatidylethanolamine N-Methyltransferase from Acetobacter aceti and some properties of its disruptant[J].Bioscience Biotechnology and Biochemistry,2001,65(12):2741-2748.
[2]Matsushita K,Inoue T,Adachi O,et al.Acetobacter aceti possesses a proton motive force-dependent efflux system for acetic acid[J].Journal of Bacteriology,2005,187(13):4346-4352.
[3]Prust C,Hoffmeister M,Liesegang H,et al.Complete genome sequence of the acetic acid bacterium Gluconobacter oxydans[J]. Nature Biotechnology,2005,23:195-200.
[4] Kanchanarach W,Theeragool G,Yakushi T,et al.Characterization ofthermotolerantAcetobacter pasteurianus strains and their quinoprotein alcohol dehydrogenases[J].Applied Microbiology and Biotechnology,2010,85(3):741-751.
[5]Trcek J,Toyama H,Czuba,et al.Correlation between acetic acid resistance and characteristics of PQQ-dependent ADH in acetic acid bacteria[J].Applied Microbiology and Biotechnology,2006,70(3):366-373.
[6]Yakushi T and Matsushita K.Alcohol dehydrogenase of acetic acid bacteria:structure,mode of action,and applications in biotechnology[J].Applied Microbiology and Biotechnology,2010,86:1257-1265.
[7]Quintero Y,Poblet M,Guillamon J M,et al.Quantification of the expression of reference and alcohol dehydrogenase genes of some acetic acid bacteria in different growth conditions[J]. Journal of applied microbiology,2009,106(2):666-674.
[8]刘洪祥,王敏,王春霞,等.巴氏醋酸杆菌醋酸发酵工艺的优化[J].中国酿造,2009(3):34-37.
[9]Joseph Sambrook and David W Russell.Molecular Cloning:A Laboratory Manual[M].3rd edition,2001.
[10]Trcek J,Toyama H,Czuba J,et al.Correlation between acetic acid resistance and characteristics of PQQ-dependent ADH in acetic acid bacteria[J].Applied Microbiology and Biotechnology,2006,70:366-373.
[11]Nakano S and Fukaya M.Analysis of proteins responsive to acetic acid in Acetobacter:Molecular mechanisms conferring acetic acid resistance in acetic acid bacteria[J].International Journal of Food Microbiology,2008,125(1):54-59.
Cloning and protein sequence analysis of alcohol dehydrogenase of Acetobacter pasteurianus AC2005
ZHANG Ke-ping,ZHENG Yu,JIA Jun-hui,LUO Jian-mei,WANG Min*
(Key Laboratory of Industrial Fermentation Microbiology(Tianjin University of Science and Technology),Ministry of Education,School of Biological Engineering,Tianjin University of Science and Technology,Tianjin 300457,China)
The genes,adhA and adhB,coding the subunit I and II of alcohol dehydrogenase(ADH)were amplified by the polymerase chain reaction(PCR),using genomic DNA of Acetobacter pasteurianus AC2005 as template,which had been demonstrated a potential strain for acetic acid production.The sequences were blasted in GenBank databases.The results showed that adhA shared 94%identity and 98%amino acid sequence homology,besides adhB shared 93%identity and 97%amino acid sequence homology with the reported gene(accession number:D13893.1).The characterization of transbilayer helix of ADH was analyzed,using software of TMHMM 2.0.It was found that the subunits I and II were both membrane-bound protein.Furthermore,the three dimensional structure of subunit I of ADH in A.pasteurianus AC2005 was produced by using Swiss-Model workspace.Those results provided that some information for further researching the relationship of structure and function of ADH.
Acetobacter pasteurianus;alcohol dehydrogenase;gene clone;sequence analysis
Q789
A
1002-0306(2011)12-0265-04
2011-03-07 *通讯联系人
张科平(1985-),女,硕士研究生,研究方向:菌株特性及菌种改造方面的研究。
国家十一五科技支撑计划子课题(2008BAI63B06);高等学校博士学科点专项科研基金(20101208120003);天津市科技攻关重点项目(06YFGZNC00400)。
