黑曲霉ATCC16404固体发酵豆皮产生木聚糖酶的研究
2011-11-02李爱军蒋文明欧仕益孙远明
李爱军,蒋文明,欧仕益,孙远明
(1.暨南大学理工学院食品科学系,广东广州510632;2.华南农业大学食品学院,广东广州510642)
黑曲霉ATCC16404固体发酵豆皮产生木聚糖酶的研究
李爱军1,2,蒋文明1,*,欧仕益1,孙远明2
(1.暨南大学理工学院食品科学系,广东广州510632;2.华南农业大学食品学院,广东广州510642)
以豆皮为原料,用黑曲霉ATCC16404固体发酵产木聚糖酶,采用DNS测定酶活,研究了最佳产酶培养基配比,优化产酶最佳条件。单因素实验结果表明,最佳培养基配方为:以硫酸铵为氮源,矿质元素添加硫酸镁,添加量均为2%(w/w以豆皮干重计),豆皮颗粒大小为25~50目,不外加碳源,不加表面活性剂。选择料液比、初始pH、培养时间、接重量优化产酶条件,正交实验结果表明,最佳产酶条件为:料液比1∶1.00(w/v)、初始pH5.5,培养时间3d,1.0×107/mL浓度孢子悬浮液接种0.3mL/10g,在此条件下酶活为366.29U/g。
黑曲霉,豆皮,木聚糖酶,固体发酵
1 材料与方法
1.1 材料与仪器
马铃薯葡萄糖琼脂培养基(PDA) 青岛高科园海博生物科技有限公司;黑曲霉(ATCC164O4) 美国标准菌种保藏中心;豆皮 中粮新沙粮油工业(东莞)有限公司;玉米淀粉、小麦淀粉、酵母膏、蛋白胨、司盘、PEG(聚乙二醇)、PPG(聚丙二醇)、3、5-二硝基水杨酸
生化试剂;蔗糖、葡萄糖、甘油、CO(NH2)2、NH4Cl、NaNO3、(NH4)2PO4、KH2PO4、K2HPO4、MgSO4· 7H2O、MgCl2、CaCl2均为分析纯;木聚糖、木糖Sigma。
电子秤,分析天平,培养箱,超净工作台,显微镜,pH计,灭菌锅,冰箱,移液器,恒温水浴锅,鼓风干燥箱,分光光度计。
1.2 实验方法
1.2.1 标准曲线的制作 以木糖浓度为横坐标,吸光度为纵坐标做标准曲线(每重配一次DNS,重做一条标准曲线)。
1.2.2 酶活测定
1.2.2.1 粗酶液制备 取1.50g发酵豆皮加入45mL柠檬酸-氢氧化钠缓冲溶液,磁力搅拌器上搅拌30min,静置过夜后纱布过滤除去豆皮,抽滤得到粗酶液。
1.2.2.2 木聚糖酶酶活测定 酶活定义:在50℃、pH4.8条件下,每分钟分解底物释放出1μmol还原糖(以木糖计)所需要的木聚糖酶量为一个活力单位[15]。
样品测定:取0.1mL适宜稀释度的酶液加入0.1mL木聚糖底物,加缓冲溶液至1.5mL,50℃反应30min,迅速冷却后加入2mL DNS溶液[16],沸水浴5min后用自来水冷却,定容至10mL,在540nm波长处测定吸光度。
空白对照:取0.1mL木聚糖底物与1.3mL缓冲溶液,50℃反应30min,冷水冷却,加入2mL DNS溶液充分混合后加入0.1mL酶液,沸水浴5min后蒸馏水定容于10mL,在540nm处测定吸光度。
酶活计算公式[17]:
酶活力(U/g)=W×D×1000/150.2×30(min) ×0.1mL
式中:W为酶解反应产生的木糖的质量(mg);D为稀释度(mL/g);1000为mmol转化为μmol的系数;150.2为木糖摩尔质量(g/mol)。
1.2.3 发酵培养
1.2.3.1 培养基组成的优化 称取10.00g豆皮加入10mL培养液,灭菌后接种黑曲霉ATCC16404,37℃培养3d。考察碳源、氮源、矿质元素、豆皮颗粒大小、表面活性剂对产酶酶活的影响。
1.2.3.2 培养条件的优化 在最优培养基的基础上考察时间、初始pH、接种量、料液比对产酶条件的影响,再在此基础上选择合适的培养条件做正交实验。
2 结果与讨论
2.1 培养基优化
2.1.1 碳源的选择 考虑到黑曲霉在培养基中生长较慢,培养基中加入2%碳源,使黑曲霉在培养初期快速生长。实验中加入蔗糖、葡萄糖、玉米淀粉、小麦淀粉与不外加碳源进行比较,结果见图1。
实验中发现在培养2d和3d时豆皮培养基中黑曲霉的生长情况无明显区别,所以黑曲霉比较适合在豆皮培养基中生长。由图1得知,不外加碳源实验组与加玉米淀粉实验组得到的酶活差别比较小,可能是由于黑曲霉对玉米淀粉利用率低,而对葡萄糖的利用比较好,在加入葡萄糖后黑曲霉对半纤维素的利用率降低,所以在培养基中不加入其他碳源。2.1.2 氮源的选择 豆皮中含有12%左右的粗蛋白[18-19],考虑到黑曲霉对其的利用情况,在培养基中分别入2%的酵母膏、CO(NH2)2、蛋白胨、NH4Cl、NaNO3、(NH4)2SO4与不外加氮源进行比较,选择合适的氮源,结果见图2。
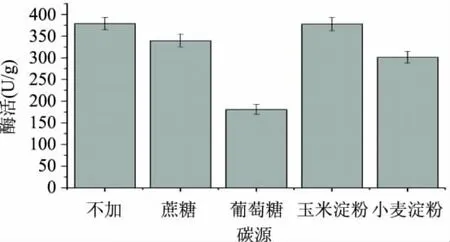
图1 不同碳源对酶活的影响

图2 不同氮源对酶活的影响
由图2得知,加入其它氮源后木聚糖酶酶活升高。相对于有机氮源,黑曲霉更适合于利用无机氮源,可能黑曲霉在利用大分子有机氮时要经过分解,而无机小分子氮源可直接被吸收利用。NH4Cl与NaNO3对酶活的影响较小,可能是由于该菌种对其利用率较低。黑曲霉较适宜利用 CO(NH2)2和(NH4)2SO4,由图2比较选择(NH4)2SO4作为氮源。2.1.3 矿质元素的选择 在培养基中分别加入2%的KH2PO4、K2HPO4、MgSO4·7H2O、MgCl2、CaCl2与不加矿质元素进行比较并比较不同矿质元素对产酶的影响,结果见图3。
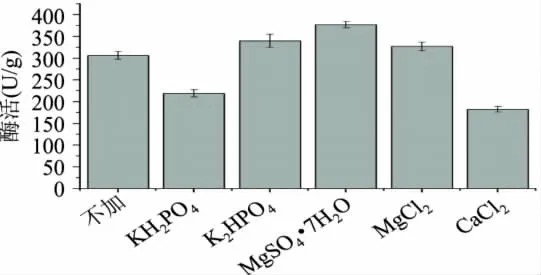
图3 不同矿物元素对酶活的影响
由图3比较得知,在矿质元素添加量2%水平时,加入MgSO4·7H2O实验组产生酶的酶活最高,所以选择在培养基中加入MgSO4·7H2O。KH2PO4与CaCl2添加组的酶活都比对照实验组低,可能是由于2%的添加量对于该菌种浓度过高从而抑制产酶。
2.1.4 豆皮颗粒大小的选择 豆皮颗粒大小对黑曲霉发酵有重要影响,黑曲霉为需氧微生物,颗粒较小时,培养基透气性降低,并且加入水后进一步降低透气性。颗粒过大使得黑曲霉与豆皮的接触面积变小,增加了黑曲霉分解豆皮的难度。实验中选择大于50目、25~50目、10~25目、小于10目、与未经过筛选处理的豆皮5种不同颗粒大小的豆皮进行实验对比,结果见图4。
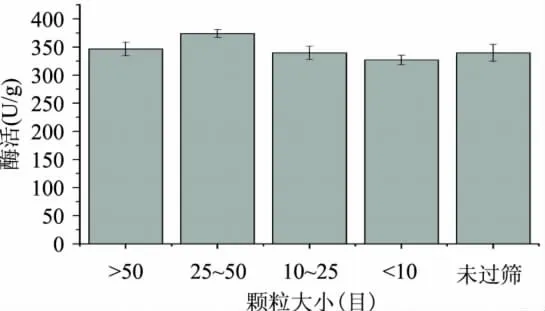
图4 豆皮颗粒大小对酶活的影响
由图4可知,豆皮颗粒大小在25~50目之间所产生木聚糖酶酶活最高,选择其作为培养基原料。
2.1.5 表面活性剂的选择 添加表面活性剂,可以增强细胞膜的通透性和加强酶的运输,能不同程度地提高酶活[20]。实验中分别加入2%的聚乙二醇(PEG)、聚丙二醇(PPG)、司盘60与不加表面活性剂实验组进行比较,结果见图5。

图5 不同表面活性剂对酶活的影响
图5表明,添加PEG实验组酶活性比不加表面活性剂实验组酶活性略有增加,但并不显著,所以在培养基中不加入表面活性剂。
2.2 培养条件的选择
2.2.1 料液比对产酶酶活的影响 水分低不能满足黑曲霉生长与产酶的需要,水分含量太高则会使得培养基基质粘连,透气性降低,也不利于黑曲霉的生长。实验以10g豆皮为原料,选择1∶0.50、1∶0.75、1∶1.00、1∶1.25、1∶1.50料液比进行比较,实验结果见图6。
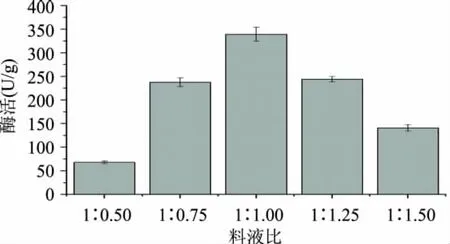
图6 料液比对酶活的影响
由图6得知,在料液比为1∶1.00时酶活性最高,水分过高或太低都会影响酶活性,经比较选择料液比1∶0.75、1∶1.00、1∶1.25三个水平做正交实验。
2.2.2 培养时间对产酶酶活性的影响 实验选择2、3、4、5、6d培养时间,测定木聚糖酶酶活性,实验结果见图7。
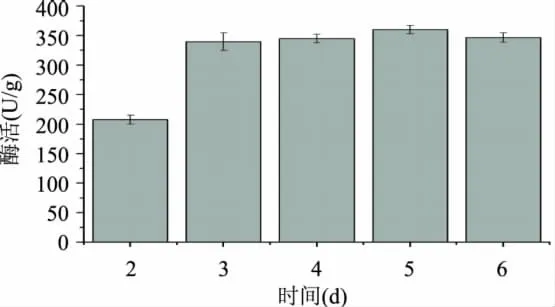
图7 培养时间对酶活的影响
黑曲霉在培养2d时已经长满培养基,但酶活性相对较低。由图7分析得木聚糖酶酶活在培养5d时达到最大值,3d后酶活性增高并不显著,可能由于代谢产物增加到一定量抑制了黑曲霉产生木聚糖酶。
2.2.3 初始pH对产酶酶活性的影响 pH对微生物生长繁殖影响很大,主要是影响细胞膜的电荷从而影响微生物对营养物质的吸收,另一方面是影响代谢过程中酶的活性从而影响微生物的生命活动[21]。实验选择初始pH分别为4.5、5.0、5.5、6.0、6.5进行培养,测黑曲霉产酶酶活,结果见图8。
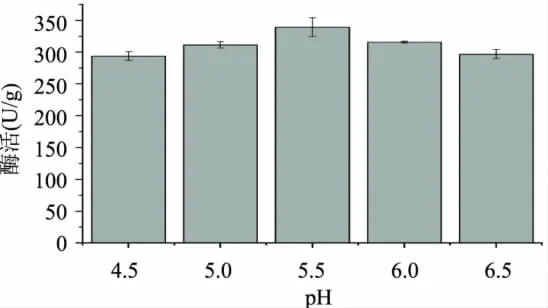
图8 初始pH对酶活的影响
由图8得知,pH过高或过低对黑曲霉发酵产木聚糖酶酶活性影响比较大。在pH5.5时产生的木聚糖酶活性最高,选择其作为培养基的pH。
2.2.4 接种量对产酶酶活性的影响 接种量会影响酶活性,接种量少时,生长较慢,酶活也较低;接种量多时,酶活也不高,菌体生长过快,培养基中的营养主要被菌体用于自身的生长[8,22],并且曲温升高,不利于产酶[8]。实验中配制1.0×107/mL的孢子悬浮液,10g豆皮中接种量分别为0.1、0.2、0.3、0.4、0.5mL,结果见图9。
由图9得知,孢子接种量为0.3mL时酶活达到最高。接种量在0.1、0.5mL时酶活比较低,在接种量为0.1mL时,可能由于菌种接种量过少,在发酵时间为3d时培养基中葡萄糖被利用尽。在接种量为0.5mL时,由于发酵初期菌种生长过快,可能导致发酵期间产热过多而影响了产酶活动。因此选择0.2、0.3、0.4mL作为正交实验的因素水平。
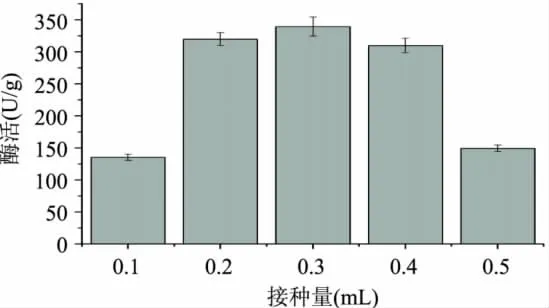
图9 接种量对酶活的影响
2.3 正交实验
由培养条件单因素实验选择合适的单因素进行正交实验设计(见表1),正交实验结果见表2。由于正交实验与单因素实验使用了同一菌种的不同培养批次,使得正交实验中所测定的酶活整体偏低一些。由正交实验结果得知各个实验因素中木聚糖酶酶活的变化趋势与单因素中基本一致。由极差分析得料液比对产酶影响比较大,其次为培养时间与初始pH,接种量的影响相对较小。在正交实验设计范围内,表观分析可知,最佳产酶条件为料液比1∶1.00、初始pH为5.5、培养时间为4d、浓度为1.0×107/mL孢子悬浮液接种量为0.2mL/10g。
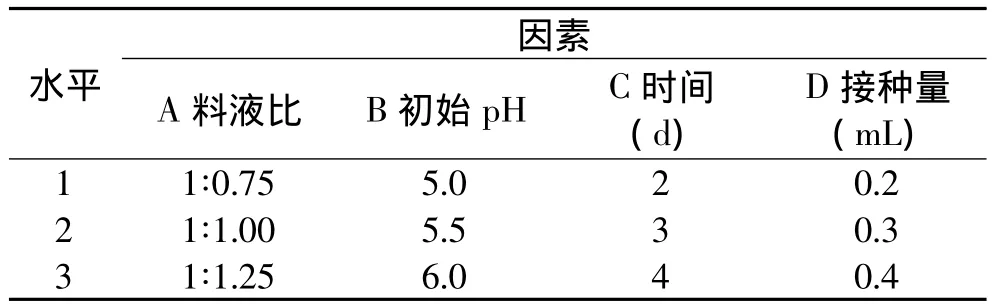
表1 正交设计因素与水平表
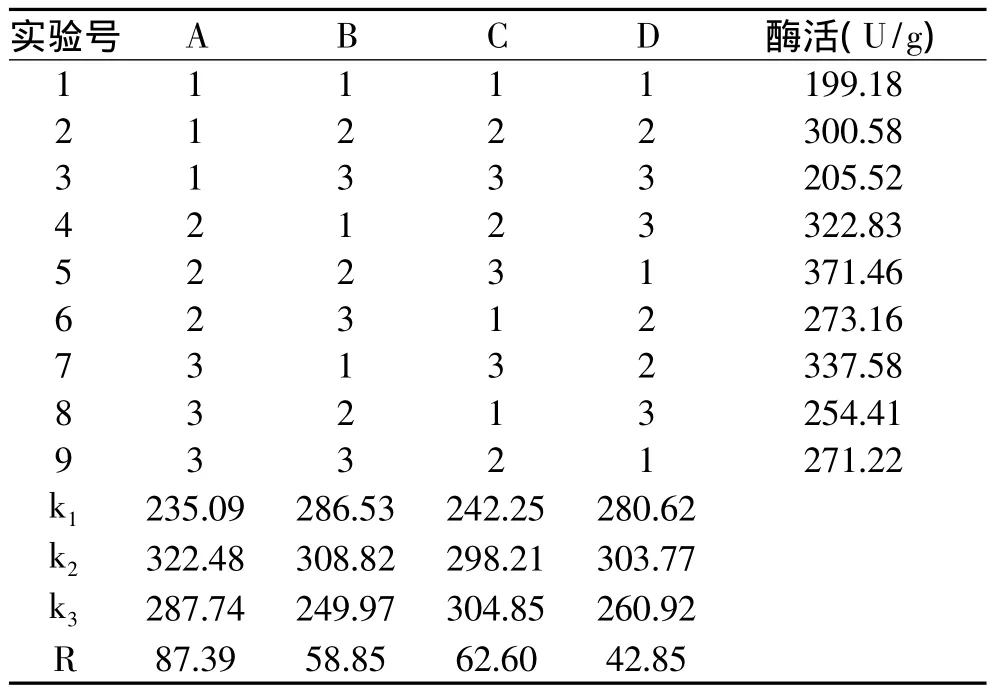
表2 正交实验结果
2.4 验证实验
正交实验极差分析结果表明A2B2C3D2为最优工艺组合,而正交结果显示,C因素中4d相比较3d酶活变化很小,并且考虑到培养时间过长会增加工艺生产成本和产品中的孢子量,所以取C2水平时的A2B2C2D2组合,与表观最佳工艺组合(正交实验中的5号)相比较。结果见表3。

表3 验证实验结果
经验证实验 A2B2C2D2组合时测得酶活为366.29U/g。与表观最佳工艺组合相比较略低,可能是由于某些单因素之间存在一定的相互作用,使得最佳工艺组合的酶活不是很高。接种量在0.2mL/10g时,通过延长发酵时间同样可以提高酶活。由于两个组合的酶活相差很小,并且考虑到发酵时间延长会增加生产成本,所以选择A2B2C2D2组合为最佳工艺条件。
3 结论
通过优化培养基,选择(NH4)2SO4作为氮源,MgSO4·7H2O作为矿质元素添加,选择25~50目颗粒大小的豆皮作为发酵原料,不外加碳源,不加表面活性剂。相对于大分子碳源和氮源,黑曲霉(ATCC164O4)更容易利用小分子碳源和氮源,添加葡萄糖可以加快黑曲霉生长,但延缓黑曲霉产木聚糖酶生长。豆皮颗粒大小与料液比对黑曲霉产酶影响比较大,黑曲霉(ATCC164O4)适于在酸性pH条件下生长。实验选择料液比、培养时间、初始pH、接种量对产酶条件进行优化,结果表明,在产木聚糖酶影响上各因素之间存在相互作用,经验证实验进一步验证表明,最佳产酶条件为料液比1∶1.00、初始pH5.5,培养时间3d,1.0×107/mL孢子浓度的菌液接种0.3mL/10g,在此条件下酶活为366.29U/g。
[1]AlemdarA,Sain M.Isolation and characterization of nanofibers from agricultural residues-Wheat straw and soy hulls[J].Bioresource Technology,2008,99(6):1664-1671.
[2]Gnanasamband R,Proctor A.Preparation of soy hull pectin[J].Food Chemistry,1999,65(4):461-467.
[3]Kalapathy U,Proctor A.Effect of acid extraction and alcohol precipitation conditions on the yield and purity of soy hull pectin[J].Food Chemistry,2001,73(4):393-396.
[4]Monsoor M A.Effect of drying methods on the functional properties of soy hull pectin[J].Carbohydrate Polymers,2005,61 (3):362-367.
[5]Schirmer-Michel  C,Fl^oers S H,Hertz P F,et al. Production of ethanol from soybean hull hydrolysateby osmotolerant Candida guilliermondii NRRL Y-2075[J]. Bioresource Technology,2008,99(8):2898-2904.
[6]Mielenz J R,Bardsley J S,Wyman C E.Fermentation of soybean hulls to ethanol while preserving protein value[J]. Bioresource Technology,2009,100(14):3532-3539.
[7]Brijwani K,Oberoi H S,Vadlani P V.Production of a cellulolytic enzyme system in mixed-culture solid-state fermentation of soybean hulls supplemented with wheat bran[J]. Process Biochemistry,2010,45(1):120-128.
[8]张年凤,赵允麟.黑曲霉产木聚糖酶的特性[J].无锡轻工大学学报,2003,23(5):38-41.
[9]高洁,李军训,肖军杜,等.黑曲霉ASP-12固态发酵木聚糖酶培养条件研究[J].饲料工业,2006,27(6):16-18.
[10]李艳丽,李卫兵,许少春,等.黑曲霉XY-7固态发酵生产木聚糖酶主要营养因子的研究[J].浙江农业学报,2008,20 (4):270-273.
[11]Polizeli M L T M,Rizzatti A C S,Monti R,et al.Xylanases from fungi:properties and industrial applications[J].Applied Microbiology Biotechnology,2005,67(5):577-591.
[12]Beg Q K,Kapoor M,Mahajan L,et al.Microbial xylanases and their industrial application:a review[J].Applied Microbiology Biotechnology,2001,56(3-4):326-338.
[13]Deng Ping,Li Defa,Cao Yunhe,et al.Cloning of a gene encoding an acidophilic endo-β-1,4-xylanase obtained from Aspergillus niger CGMCC1067 and constitutive expression in Pichia pastoris[J].Enzyme and Microbial Technology,2006,(39):1096-1102.
[14]Tapingkae W,Yachai M,Visessanguan W,et al.Influence of crude xylanase from Aspergillus niger FAS128 on the in vitro digestibility and production performance of piglets[J].Animal Feed Science and Technology,2008,140(1-2):125-138.
[15]周秀梅.木聚糖酶生产及酶学性质的研究[D].浙江大学,2005:18-18.
[16]大连轻工业学院,等.食品分析[M].北京:中国轻工业出版社,2004:173-173.
[17]张丽英.饲料分析及饲料质量检测技术[M].第三版.北京:中国农业大学出版社,2007:348-348.
[18]沈洪明.大豆皮成分检验及饲料应用效果[J].大豆通报,2004(3):25-26.
[19]侯世忠,祝平,井长伟.大豆皮的营养价值及在饲料中的应用[J].吉林畜牧兽医,2007,28(9):18-21.
[20]闫振丽,程杰渊,杨付伟,等.黑曲霉固态生产木聚糖酶发酵条件的优化[J].中国酿造,2009(4):99-101.
[21]张文治.新编食品微生物学[M].北京:中国轻工业出版社,1998:75-75.
[22]张晶,王战勇,苏婷婷.产木聚糖酶黑曲霉LN0601的液体发酵[J].辽宁石油化工大学学报,2007,27(2):10-12.
Xylanase production by Aspergillus niger ATCC16404 in solid-state fermentation of soybean hull
LI Ai-jun1,2,JIANG Wen-ming1,*,OU Shi-yi1,SUN Yuan-ming2
(1.Food Science Department,College of Science and Technology,Jinan University,Guangzhou 510632,China; 2.College of Food Science,South China Agricultural University,Guangzhou 510642,China)
Components of incubation media and followed by the best conditions for enzyme production were optimized in solid-state fermentation of soybean hull by Aspergillus niger ATCC16404 to produce xylanase,whose activity was determined by DNS.Results of single factor experiments showed that the optimum components of incubation media contain ammonium sulfate and magnesium sulfate used as nitrogen source and mineral element,with 2%addition based on the weight of 25~50 mesh dry soybean hull,and without additional carbon source and surfactant.Solid-to-liquid ratios,initial pH,incubation time,inoculum size were selected to optimize the condition of enzyme production.Orthogonal experiment showed the highest xylanase activity was 366.29U/g at the optimum fermentation conditions of solid-to-liquid ratio 1∶1.00,initial pH 5.5,3d incubation,0.3mL/10 g spore suspension of 1.0×107/mL concentration.
Aspergillus niger;soybean hull;xylanase;solid-state fermentation
TS201.3
A
1002-0306(2011)12-0261-05
豆皮为大豆加工副产物,大豆皮约占整粒大豆总重的8%,2009年我国大豆进口量为4255万t,国内产量1450万t,所以每年都有很多豆皮产生。豆皮在很多方面都有应用:从豆皮中提取纳米纤维素可作为强化纤维用于生物复合材料中[1];豆皮中提取的果胶[2-3],半乳糖醛酸含量最高达88.3%,而且不同干燥方式(冷冻干燥、冷冻干燥、真空干燥)对豆皮果胶溶解性和流动性没有显著破坏作用[4];高里假丝酵母发酵豆皮水解物产乙醇效果较好[5];豆皮可以不经前处理,由啤酒酵母直接发酵生产乙醇,还能够保留原有蛋白质价值[6];Khushal Brijwani等[7]利用里氏木霉和米曲霉混合菌固体发酵搀杂麦麸的豆皮生产纤维素酶系;实验表明,相对酸前处理,该酶系对碱前处理原料的糖化效果较好。目前国内主要利用玉米芯、麸皮等作为产生木聚糖酶的原料[8-10]。木聚糖酶广泛用于面包、饮料、纺织、造纸、废水处理[11-12]等方面,以及作为动物饲料添加剂[13-14]。本研究利用黑曲霉发酵产生木聚糖酶,旨在为木聚糖酶制剂的研制与豆皮深加工利用提供参考。
2010-10-25 *通讯联系人
李爱军(1966-),男,博士,副教授,研究方向:农产品深加工与利用。
广东高校科技成果产业化重大项目(cgzhzd0709)。
