转谷氨酰胺酶的膜固定化研究
2011-11-02那治国马永强岳文静王金山
那治国,马永强,姚 晶,*,岳文静,王金山
(1.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨150086; 2.哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
转谷氨酰胺酶的膜固定化研究
那治国1,马永强2,姚 晶1,*,岳文静2,王金山1
(1.黑龙江东方学院食品与环境工程学部,黑龙江哈尔滨150086; 2.哈尔滨商业大学食品工程学院,黑龙江哈尔滨150076)
以臭氧活化后的聚丙烯微孔膜为载体,并以丙烯酸为单体、戊二醛为交联剂固定转谷氨酰胺酶。研究了臭氧活化时间、接枝反应时间、温度、单体浓度、莫尔盐浓度对接枝率的影响,并对固定化条件进行研究。确定了最佳固定化条件为:己二胺浓度15%,胺烷基化温度50℃、时间120min,戊二醛浓度3%,交联温度30℃、45min,酶浓度10mg/mL,固定化时间20h。此条件下载酶量为30.23mg/g膜,酶活力可达16.9U/g膜。
转谷氨酰胺酶,固定化,聚丙烯微孔膜
1 材料与方法
1.1 材料与仪器
转谷氨酰胺酶 江苏泰兴一鸣精细化工有限公司;聚丙烯微孔膜 北京升河诚信膜科技发展中心;还原型谷胱甘肽、N-α-CBZ-Gln-Gly、L-Glutamic acid γ-monohydroxamic acid sigma公司。
S-3400型扫描电镜 日本日立公司;80-2型高速离心机 上海浦东物理光学仪器厂;S-54型紫外可见分光光度计 上海光谱仪器有限公司;臭氧发生器 镇江赛格环保科技有限公司。
1.2 实验方法
1.2.1 聚丙烯微孔膜臭氧处理及接枝方法 将聚丙烯微孔膜用丙酮抽提12h,于40℃条件下干燥6h后称重(W0)。将样品放入臭氧反应器中进行臭氧处理,然后真空脱气30min,以除去吸附在表面的O3和O2,再用乙醇浸泡10min后,立即进行接枝反应。溶解一定量的莫尔盐于水中,向其中加入丙烯酸单体,并将膜浸入溶液中,通氮除氧,于一定的温度反应数小时。将接枝膜用甲醇抽提12h后用清水冲洗,除去表面均聚物、单体及莫尔盐,最后于40℃真空干燥6h,称重(W),接枝率(GD)按下式计算。
GD(grafting degree,%)=(W-W0)/W0×100%
1.2.2 转谷氨酰胺酶的膜固定化方法 将己二胺溶解于去离子水中配成一定浓度的溶液,把丙烯酸接枝膜浸入己二胺溶液中,在不同温度下振荡一定时间,取出膜后,用大量去离子水冲洗除去吸附于膜上的己二胺。完成后将膜浸入一定浓度的戊二醛水溶液中,于设定温度的空气振荡器上振荡一段时间。取出膜,用大量去离子水冲洗以除去附着于膜上的戊二醛。取上述处理后的膜,浸入10mL一定浓度的经预处理的酶溶液中,于4℃下反应数小时。取出膜后,用大量pH7.0磷酸盐缓冲液冲洗,除去表面黏附的酶液。将固定化酶膜浸入pH7.0磷酸盐缓冲液中,于4℃下储存。研究不同条件对固定化酶膜活力的影响。
1.2.3 转谷氨酰胺酶酶活性的测定 采用Folk和Cole报导的分光 Hydroxamate分析法测定[7]。在37℃条件下酶液与试剂A反应10min后,添加试剂B终止反应并形成红色铁化合物,4000r/min离心15min,上清液于525nm处测定吸光度,用L-谷氨酸γ-单羟肟酸作标准曲线。其中:试剂A为含0.1mol/L Tris-HCl缓冲液(pH=6.0),0.1mol/L羟胺,0.01mol/L还原型谷胱甘肽及0.03mol/L N-α-CBZ-Gln-Gly的混合液;试剂B为3mol/L HCl,12%三氯乙酸浓度及5%FeCl3·6H2O(溶解于0.1mol/L HCl中)等体积混合液。1单位转谷氨酰胺酶酶活力单位定义为:37℃每min产生1μmol L-谷氨酸γ-单羟肟酸所需酶量(U/mL)。
1.2.4 过氧化物浓度测定[8]臭氧处理后的膜于室温条件下真空脱气1h后,放入100mL的锥形瓶中,加入25mL异丙醇,1mL饱和碘化钾,1mL冰醋酸,将混合物加热至初沸,保持沸腾2~5min,不时摇动锥形瓶。用Na2S2O3标准溶液滴定,直到黄色消失。按下式计算过氧化物的浓度GPOOH(mol/cm2)。
GPOOH=(V×C)/(A×1000)
式中:V-滴定所用去的 Na2S2O3溶液的体积(mL);C-Na2S2O3溶液的浓度(mol/L);A-膜的表面积(cm2)。
1.2.5 载酶量的确定 采用凯氏定氮法分别测定固定化前后的聚丙烯微孔膜的蛋白质含量,以及清洗固定化酶膜所用磷酸盐缓冲溶液中的蛋白含量[9]。根据以下公式计算载酶量:
载酶量(%)=[(C0-C)×V-Cw×Vw]/W ×100%
式中:C0-固定化之前酶溶液中蛋白含量;C-固定化之后酶溶液中蛋白含量;Cw-冲洗固定化酶膜之后,所用磷酸盐缓冲溶液中的蛋白含量;V-固定化实验所用酶溶液体积;Vw-冲洗固定化酶膜之后,所用磷酸盐缓冲溶液体积;W-浸入酶溶液中的膜的质量。
1.2.6 扫描电镜(SEM)观察酶膜表面形貌 空白膜以及酶固定后的膜在清洗后真空烘干至恒重,将样品剪成1cm×1cm的小块,经过喷金处理后用SEM观察,扫描放大倍数为3000倍。
2 结果与分析
2.1 L-谷氨酸γ-单羟肟酸标准曲线
线性回归方程:y=0.6871x+0.1961,R2=0.9992。

图1 L-谷氨酸γ-单羟肟酸标准曲线
2.2 不同条件对聚丙烯微孔膜臭氧处理及接枝反应的影响
2.2.1 臭氧处理时间对过氧化物浓度的影响 聚丙烯微孔膜经臭氧处理后,会在膜的表面引入过氧化物,在不同处理时间下臭氧活化效果见图2。从图2中可以看出,当臭氧处理时间较短时,膜表面的过氧化物浓度随着处理时间的延长而增大,但当处理时间超过45min时过氧化物浓度增加不明显。
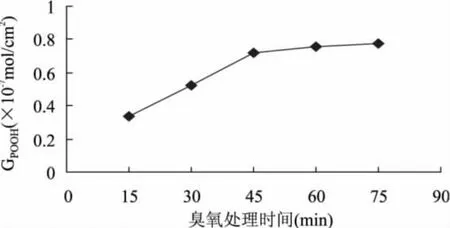
图2 臭氧处理时间对过氧化物浓度的影响
2.2.2 接枝反应时间对接枝率的影响 分别将经过不同时间臭氧处理后的聚丙烯微孔膜进行接枝反应,考察各膜在不同接枝反应时间对膜接枝率的影响,如图3所示,接枝率随着接枝时间的延长而增加,但当接枝时间达到2h时,接枝率增加不明显。当臭氧处理时间低于45min时接枝率随臭氧处理时间的延长而增加,但当臭氧处理时间为60min时接枝率接近甚至低于臭氧处理45min的膜,臭氧处理时间为75min时接枝率骤然下降。引起这一现象的原因主要是臭氧活化时间过长,会引起高聚物的降解,产生对材料力学的影响,膜的通透性变差,从而引起接枝率降低。因此,结合图2与图3确定最佳臭氧处理时间为45min,最佳接枝反应时间为2h。

图3 接枝反应时间对接枝率的影响
2.2.3 接枝反应温度对接枝率的影响 将臭氧处理后的聚丙烯微孔膜置于不同温度下进行接枝反应,考察不同温度对接枝率的影响。如图4所示,接枝率随温度的升高而降低,引起这一现象的主要原因是臭氧处理后的膜表面引入过氧化物,加入莫尔盐后活化接枝的引发体系为氧化-还原引发体系,这一体系的活化能比较低,可在较低的温度下引发聚合,并且有较快的聚合速率。温度升高,过氧化物的分解加快,活性自由基的寿命降低,导致聚合过程受抑制,接枝率下降。因此,本实验接枝温度确定为20℃。
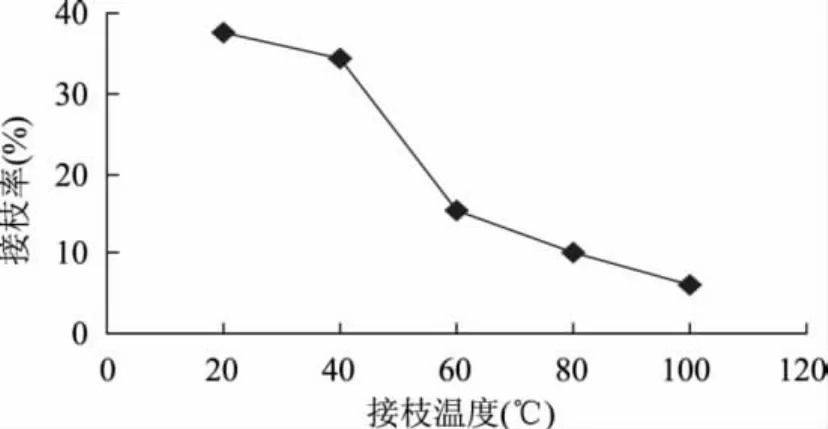
图4 接枝温度对接枝率的影响
2.2.4 单体浓度对接枝率的影响 将臭氧处理后的聚丙烯微孔膜在不同浓度的单体溶液中进行接枝,考察单体浓度对接枝率的影响,如图5所示,接枝率随单体浓度的增加而增加,当单体浓度达到12%之后,接枝率增加的不明显,因此本实验设定的单体浓度为12%。

图5 单体浓度对接枝率的影响
2.2.5 莫尔盐浓度对接枝率的影响 对臭氧处理后的聚丙烯微孔膜进行接枝反应时需添加一定量的莫尔盐,并需要考虑莫尔盐添加量对接枝率的影响。如图6所示,接枝率随莫尔盐添加量的增加而降低,当莫尔盐添加浓度为0.05%~0.15%时,接枝率下降非常缓慢,趋势平稳;当莫尔盐浓度为0.15%~0.25%时,接枝率骤然下降;但当莫尔盐添加浓度为0.05%、0.1%时虽然接枝率较高,但体系很粘稠,接枝膜变得粗糙。因此,确定莫尔盐添加浓度为0.15%,此条件下接枝率可达40.5%。
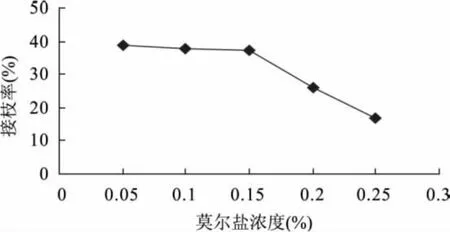
图6 莫尔盐浓度对接枝率的影响
2.3 转谷氨酰胺酶的膜固定化研究
2.3.1 己二胺浓度对固定化酶活性的影响 本实验考察了不同己二胺浓度对固定化酶膜活力的影响,如图7所示。当浓度低于15%时,固定化酶膜活力随己二胺浓度的增大而增大,当己二胺浓度高于15%时,酶膜活力基本稳定,产生这一现象的主要原因是膜表面的有效位点在己二胺浓度为15%时已经能够被充分占据,而浓度再继续增加也不会增加酶的固定化位点。因此,本实验确定的最佳己二胺浓度为15%。

图7 己二胺浓度对固定化酶活性的影响
2.3.2 胺烷基化温度对固定化酶活性的影响 不同胺烷基化温度对酶固定化的影响见图8。由图8可以看出,固定化酶膜活力随胺烷基化温度的升高而升高,当温度为50℃时活力便基本达到最高值,继续加热上升趋势缓慢,因此选择胺烷基化温度为50℃。原因可能是温度的升高有助于反应物越过过渡态能垒,从而促进酰胺化反应的进行,进而增加了膜表面用于固定化酶的氨基的量。

图8 胺烷基化温度对固定化酶活性的影响
2.3.3 胺烷基化时间对固定化酶活性的影响 不同胺烷基化时间对酶固定化的影响见图9。固定化酶膜活力随胺烷基化时间的延长而升高,但当时间为120min时,活力升高非常缓慢,几乎趋于平稳,说明此时的胺烷基化作用较完全,因此,本实验选定的最佳胺烷基化时间为120min。
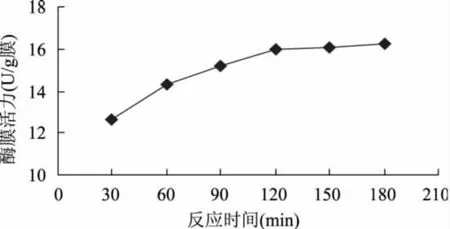
图9 胺烷基化时间对固定化酶活性的影响
2.3.4 戊二醛浓度对固定化酶活性的影响 分别选定不同浓度的戊二醛为交联剂,研究其对酶固定化的影响,结果如图10所示,固定化酶膜活力随交联剂浓度的增大而略升高,当浓度达3%时酶膜活力最大,浓度高于3%时酶膜活力有略微的下降,由此可见,浓度为3%的戊二醛溶液就可以使戊二醛分子与酶分子上的氨基化学键充分键合,浓度过高时,过多的戊二醛有可能修饰酶分子活性基团,从而使酶活略微下降。

图10 戊二醛浓度对固定化酶活性的影响
2.3.5 交联时间对固定化酶活性的影响 实验结果如图11所示,固定化酶膜活力随交联时间的增加而增加,当交联时间超过45min时,酶活力略微下降,引起这一现象的主要原因可能是时间过长,交联程度过高,酶不易参加反应,从而活力下降。
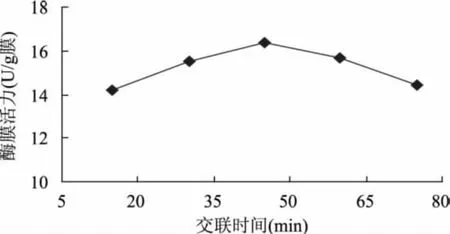
图11 戊二醛交联时间对固定化酶活性的影响
2.3.6 交联温度对固定化酶活性的影响 实验结果如图12所示,固定化酶膜活力随交联温度的升高而升高,当温度为30℃时达到最高,继续升高导致其活力下降,引起这一现象的主要原因是交联温度直接影响交联反应速度。
2.3.7 酶浓度对固定化酶活性的影响 将经过之前环节处理后的膜浸入不同浓度的酶液中进行固定化反应,如图13所示,当酶液浓度在2~8mg/mL范围内酶膜活力显著上升,浓度在8~10mg/mL范围时活力上升缓慢,当浓度超过10mg/mL时活力基本不再上升。由此可见,当酶液浓度为10mg/mL时,膜上的可结合位点基本全部被占据,再继续升高也仅仅附着在膜的表面,随后被缓冲溶液清洗掉。因此固定化时的酶浓度确定为10mg/mL。
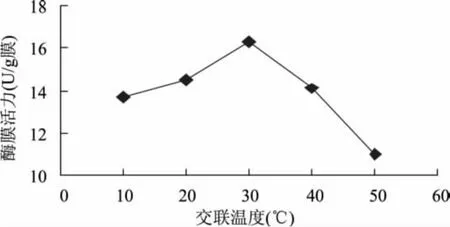
图12 戊二醛交联温度对固定化酶活性的影响

图13 酶浓度对固定化酶活性的影响
2.3.8 固定化时间对固定化酶活性的影响 因为酶的固定化反应需要在4℃条件下进行,所以需要较长的固定化时间,如图14所示,当固定化时间设定在5~20h之间时,随着反应时间的延长,固定化酶膜的活力升高,说明膜上酶的固定量增多。当反应20h之后,反应进行得比较完全,酶活性增加不显著。因此,最佳酶固定化反应时间为20h。

图14 固定化时间对固定化酶活性的影响
2.3.9 载酶量的确定 在上述单因素实验确定的最佳条件下进行酶的膜固定化反应,经测定,此反应条件下膜的酶蛋白承载量为30.23mg/g膜,此时的固定化酶膜活力达到16.9U/g膜左右。
2.4 扫描电镜(SEM)观察酶膜表面形貌
本实验分别对空白膜及固定化转谷氨酰胺酶酶膜做扫描电镜(SEM),照片如图15所示,从图15(a)中可以看出,空白聚丙烯微孔膜是由聚丙烯纤维构成,纤维相互错乱交叉,排列不规则,但表面很平整光滑。从图15(b)可看出,此时酶蛋白固定化后的膜表面由于交联了蛋白的基团,存在一些颗粒或团状的物体而显得有些粗糙,而且这些颗粒大小不一,形状各异,附着在纤维表面,可以说明MTG蛋白已经固定在聚丙烯微孔膜上。
3 结论
3.1 通过臭氧活化方法对聚丙烯微孔膜进行活化接枝,研究表明:膜表面的过氧化物浓度随着处理时间的延长而增大,但是超过45min时过氧化物浓度增加不明显;并用不同臭氧处理时间下的膜在不同接枝时间下进行接枝反应,确定了最佳臭氧处理时间为45min,最佳接枝反应时间为2h。以接枝率为指标确定最佳接枝温度为20℃、最佳单体浓度为12%、最适量莫尔盐浓度为0.15%,此条件下的接枝率可达到40.1%。
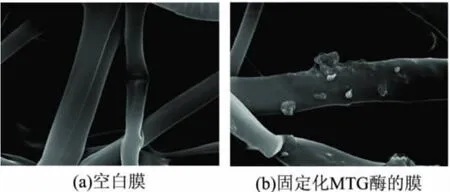
图15 固定化酶膜扫描电镜图
3.2 通过单因素实验研究了己二胺浓度、胺烷基化温度、胺烷基化时间、戊二醛浓度、戊二醛交联时间、戊二醛交联温度、酶浓度、固定化时间对固定化酶膜活力的影响情况,确定了最佳的酶固定化条件:己二胺浓度为 15%,胺烷基化温度为 50℃、时间为120min;戊二醛浓度为3%,交联温度为30℃、时间为45min;酶液浓度为10mg/mL,固定化时间为20h。在此条件下进行酶固定化反应,载酶量为30.23mg/g膜,且酶膜活力可达16.9U/g膜。
[1]DE JONG G A H,KOPPELMAN S J.Transglutaminase catalyzed reaction:impact on food applications[J].Journal of Food Science,2002,67(8):2798-2806.
[2]黄志良,宁正祥.转谷氨酰胺酶对乳蛋白酶的改性作用[J].食品工业科技,2002,23(3):77.
[3]NONAKA M,YOKOYAMA K,Nio N,et al.Polymerization of several proteins by Ca2+-independent transglutanminase devived from microorganisms[J].Agric Biol Chem,1989,53:2619-2623.
[4]卓仁禧,罗毅,陶国良.固定化酶技术及其进展[J].离子交换与吸附,1994,5:447-452.
[5]杨虎,许振良,周立志,等.聚偏氟乙烯膜表面丙烯酸接枝改性研究[J].膜科学与技术,2006,26(4):24-25.
[6]刘小冲,孙巨峰,金文,等.低温等离子体引发PTFE膜接枝丙烯酸固定化酶研究[J].材料导报,2007,21(1):150-151.
[7]Folk J E,Ando H,Adadi M,et al.Structural requirements of specific substrates for guinea pig liver transglutamianse[J].J Biol Chem,1965,240:2951-2960.
[8]李维红,刘鹏波,邹华维.聚丙烯微孔膜表面的臭氧处理接枝改性[J].高分子材料科学与工程,2008,24(4):97-98.
[9]张水华.食品分析[M].北京:中国轻工业出版社,2002: 102-106.
Study on immobilization of transglutaminase on membranes
NA Zhi-guo1,MA Yong-qiang2,YAO Jing1,*,YUE Wen-jing2,WANG Jin-shan1
(1.Department of Food and Environmental Engineering,Heilongjiang East College,Harbin 150086,China; 2.College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
Transglutaminase was immobilized on polypropylene microporous membranes by using activated ozone as the carrier,acrylic acid as the monomer and glutaraldehyde as the cross-linking agent.The effect of ozone activation time,grafting time,grafting temperature,monomer concentration and ammonium ferrous sulfate concentration on grafting degree were studied,and immobilization conditions were also studied.It was found the optimal reaction conditions as following:consistency of hexamethylendiamine was 15%,at 50℃ for 120min and consistency of glutaraldehyde was 3%,at 30℃ for 45min,consistency of enzyme was 10mg/mL at 4℃ for 20h.So the immobilized amount of protein could come to 30.23mg/g membrane and the activity of immobilized MTG could come to 16.9U/g membrane.
transglutaminase;immobilization;polypropylene microporous membranes
TS201.2+5
A
1002-0306(2011)12-0243-05
转谷氨酰胺酶(MTG,EC2.3.2.13,全称为蛋白质-谷氨酰胺γ-谷氨酰胺基转移酶)是一种能催化转酰基反应,催化蛋白质中赖氨酸上的ε-氨基和谷氨酸上的γ-羟酰胺基之间的结合反应,从而导致蛋白质(或多肽)之间发生共价交联形成共价化合物的聚合酶[1]。它可通过胺的导入、交联以及脱胺3种途径改善蛋白质的功能特性[2-3]。但是游离酶在水溶液中很不稳定,同时,此酶对热、高离子浓度、强酸、强碱及部分有机溶剂等均不够稳定,容易失活而降低其催化能力,这些不足大大限制了酶促反应的广泛应用[4]。而固定化酶膜能够将酶的催化特性和膜的优良分离性能有机地结合起来[5],从而可以克服这些不足,成为近年来的研究热点。聚丙烯微孔膜由于具有良好的物理和化学稳定性,易于控制的微孔结构以及制备方法等特点,得到了广泛的应用。然而,其化学惰性的表面也为酶固定化带来了困难。通过接枝聚合,在其表面引入反应性官能团,进而共价结合酶分子,将是聚丙烯膜上化学固定酶的一种有效手段[6]。本文采用臭氧活化的方法对聚丙烯微孔膜进行处理,以引发丙烯酸单体接枝在膜表面,并利用戊二醛的交联作用对转谷氨酰胺酶进行膜固定化,研究了臭氧活化、接枝反应及固定化条件。
2011-08-23 *通讯联系人
那治国(1980-),男,硕士,讲师,研究方向:食品化学。
黑龙江省教育厅科学技术研究项目(11553071);国家863计划项目(2008AA102303)。
