凝结芽孢杆菌CICIM B1821发酵生产L-乳酸的研究
2011-10-24田康明石贵阳王正祥
田康明,石贵阳,王正祥
(江南大学工业生物技术教育部重点实验室,江南大学生物资源与生物能源研究中心,江南大学中国高校工业微生物资源和信息中心,江苏无锡 214122)
凝结芽孢杆菌CICIM B1821发酵生产L-乳酸的研究
田康明,石贵阳,王正祥*
(江南大学工业生物技术教育部重点实验室,江南大学生物资源与生物能源研究中心,江南大学中国高校工业微生物资源和信息中心,江苏无锡 214122)
凝结芽孢杆菌(Bacillus coagulans)CICIM B1821是一株实验室前期筛选获得的产L-乳酸的嗜热菌。该菌株在34~55℃范围内均表现出良好的生长特性和产酸特性,50℃时获得最高的比生长速率和最大的乳酸积累量。CICIM B1821能够在pH为5.0~7.5的范围内保持高的菌体活性。氧气的存在有利于CICIM B1821的快速生长,但会导致副产物的积累,而在不通氧的条件下该菌株也生长良好,同时产酸速率可高达5.63g/L·h。控制残糖浓度不高于10%的发酵条件下,发酵48h,可积累乳酸107.5g/L,副产物总和仅为1.05g/L,葡萄糖对乳酸的得率为97.5%,所产L-乳酸光学纯度高于99%。此外,高浓度葡萄糖发酵实验显示,该菌株可在高渗透压下利用20%葡萄糖发酵生产L-乳酸,发酵100h,可积累乳酸134g/L,副产物总和仅为1.12g/L,葡萄糖对乳酸的得率为92.0%。
凝结芽孢杆菌,嗜热菌,L-乳酸,发酵生产
近年来,生物可降解聚合材料正在遍布日常生活和工业生产的方方面面。与石油来源的聚合材料相比,可降解、可再生的性能使得生物质的聚合材料需求量不断增加。而聚乳酸正是应用最广泛的生物质可降解聚合材料之一[1]。目前,90%的聚乳酸均由生物法发酵生产的乳酸加工聚合而成[2]。因此,建立高效的乳酸发酵生产工艺显得尤为重要。乳酸由L-乳酸和D-乳酸两种构型的单体组成。由于其构型不同,两种单体及其聚合材料的应用领域也有所差异。因此,工业生产中对乳酸的构型提出了越来越高的要求,特别是在食品和医药及相关领域,高光学纯度L-乳酸的应用更为广泛。传统的L-乳酸生产菌种为米根霉,但所产L-乳酸光学纯度不高,发酵温度较低,发酵工艺不易操作等不足限制了传统方法生产L-乳酸的发展[3]。嗜热菌用于L-乳酸的发酵生产则弥补了上述不足。凝结芽孢杆菌就是典型的代表。该菌种对营养成分要求不高,可以节约发酵成本;代谢快,可以缩短发酵周期;耐受温度高,可以减少发酵过程中对冷却水的消耗,同时也减少了染菌的可能。众多研究中已经实现了不灭菌的情况下直接发酵生产,大幅度降低了能耗[4]。本研究室前期筛选获得一株嗜热L-乳酸高产菌。为了进一步实现该菌株的推广应用,本研究从生长和发酵最适温度、pH、补料浓度、供氧情况等方面考察了该菌株的生长和发酵产酸的特性,并建立了高效的L-乳酸发酵工艺。
1 材料与方法
1.1 实验材料
菌株来源Bacillus coagulansCICIM B1821,由江南大学中国高校工业微生物资源和信息中心(CICIMCU,http://cicim-cu.jiangnan.edu.cn)提供;LB培养基(g/L) 蛋白胨10,酵母膏5,NaCl 10,pH 7.0,添加琼脂2%即为固体培养基;种子培养基[5](g/L)葡萄糖60,酵母膏10,蛋白胨10,无水MgSO40.25,轻质CaCO310,pH 7.0~7.2(其中葡萄糖及碳酸钙单独灭菌);发酵培养基(g/L) 葡萄糖150,酵母膏10,蛋白胨2,无水MgSO40.25,轻质CaCO375,pH7.0~7.2(其中葡萄糖及碳酸钙单独灭菌)。
1.2 分批发酵实验
1.2.1 摇瓶实验 种子平板培养采用LB培养基,50℃静置培养过夜。
单菌落接种于液体种子培养基,250m L三角瓶中分装40m L种子培养基,50℃下200r/m in培养6h,用于接种发酵培养基。
乳酸发酵于250m L三角瓶中进行,每瓶分装40m L发酵培养基,用四层牛皮纸和保鲜膜将瓶口的纱布包扎住,50℃静置发酵60h。每隔6h取样测定菌体量、耗糖及产酸情况。每个参数设置三个平行实验,测定结果取平均值。
考察温度对菌体生长和产酸影响时,由于不同温度下发酵液的挥发情况不同,产酸浓度值通过体积换算进行校正。如50℃发酵60h时实测浓度为35.0g/L,终体积为37m L,初始体积40m L,换算后浓度为:

1.2.2 发酵罐放大实验
1.2.2.1 种子培养方式 LB平板50℃静置培养过夜后,接单菌落于LB液体培养基,转速200r/min,50℃摇床过夜培养。500m L三角瓶中分装200m L种子培养基,5%接种量,50℃条件下,200r/m in培养6h,用于发酵罐接种。
1.2.2.2 发酵培养基 15L搅拌式发酵罐,初始装液量8L,罐上灭菌(121℃,20m in)。葡萄糖单独灭菌后分批补加,控制补加后终浓度不高于10%,发酵结束残糖浓度不高于1%,总添加量根据具体实验要求确定。20%葡萄糖发酵实验,一次补加葡萄糖至终浓度20%。
1.2.2.3 其他发酵参数 发酵温度50℃,调节pH至6.5,好氧阶段采用氨水调节,厌氧阶段采用25%的Ca(OH)2调节,好氧阶段控制DO值不低于30%,接种量为5%。
1.3 分析方法
1.3.1 菌体量的测定 吸取0.5m L发酵液置于具塞刻度试管中,加1m L浓度为2mol/L的盐酸,将发酵液中过量的CaCO3或Ca(OH)2全部溶解,去离子水定容到所需刻度。以水为空白,于600nm处测定OD值,1OD相当于0.25g/L的细胞干重。
1.3.2 葡萄糖和L-乳酸的测定 利用生物传感分析仪(SBA-40C,山东科学院生物研究所)测定残糖浓度和L-乳酸产量。
1.3.3 总乳酸和副产物的测定 高压液相色谱法测定总乳酸产量。仪器:dionex p680,Shodex SUGARSH 1011;柱温:50℃;流动相:0.01mol/L H2SO41m L/m in;检测器:示差折光检测器。
1.3.4 光学纯度的测定 高压液相色谱法测定L-乳酸的光学纯度。仪器:dionex p680,Astec CLC-L;柱温:24℃;流动相:5mmol/L CuSO41m L/m in;检测器:dionex UVD170U;检测波长:254nm。
1.3.5 数据处理 生长曲线的拟合、生长速率和比生长速率的计算均由绘图软件Origin 8.0辅助完成。
2 结果与讨论
2.1 不同温度对Bacillus coagulans CICIM B1821生长和发酵产酸的影响
考察了不同温度(34、37、42、45、50、55℃)对Bacillus coagulans CICIM B1821生长和发酵产酸的影响。
对比图1中的数据可以看出,在不同的发酵温度下,菌体生长状况差异明显。随着发酵温度的升高,菌体的倍增时间逐渐缩短,但是55℃条件下菌体的倍增时间没有继续缩短而是增加到接近42℃时的倍增时间。通过对生长曲线拟合和进一步计算发现,42℃发酵温度下,菌体获得了最高的生长速率(见图2),而在37℃发酵温度下,菌体获得了最高的菌体量,最大比生长速率和最高的乳酸积累量则在50℃发酵温度下获得(见图3和表1)。
菌体生长是一个复杂的过程,众多因素都影响着菌体的生长状况,如温度、pH、供氧强度、底物浓度、产物浓度等,其中温度的影响往往是比较显著的,菌体合成和代谢所依赖的各种酶都会受到温度的显著影响。M.V.Jones等人[6]研究了一株凝结芽孢杆菌(Bacillus coagulans)中在TCA循环中起关键作用的四种酶的热稳定性能,发现其中三种酶最适作用温度在60℃以上,而苹果酸脱氢酶的最适作用温度为43℃。这一结论可以从酶作用温度的角度为本研究中42℃发酵温度下菌体获得最大生长速率提供理论依据。M.V.Jones等人对比发现,四种酶55℃条件下的比酶活较30℃条件下高出三倍多;本研究中则发现,55℃发酵温度下菌体的最大比生长速率是34℃条件下的3.5倍,34℃发酵温度下菌体的倍增时间则是55℃条件下的3.1倍。
发酵生产过程中,除了要考虑菌体生长的最适温度,还涉及到温度对产物合成的影响。对比乳酸产量的不同,确定50℃为后续研究的基础发酵温度。此外,对该菌株碳源利用情况的考察显示,Bacillus coagulans CICIM B1821可以利用葡萄糖和木糖进行乳酸的发酵生产,这为后续开发利用纤维素水解液发酵生产乳酸奠定了基础。而目前广泛使用的纤维素水解酶类在50℃条件下的酶活力是30℃条件下的三倍[7]。这也为选择50℃作为后续研究的基础发酵温度提供了参考。
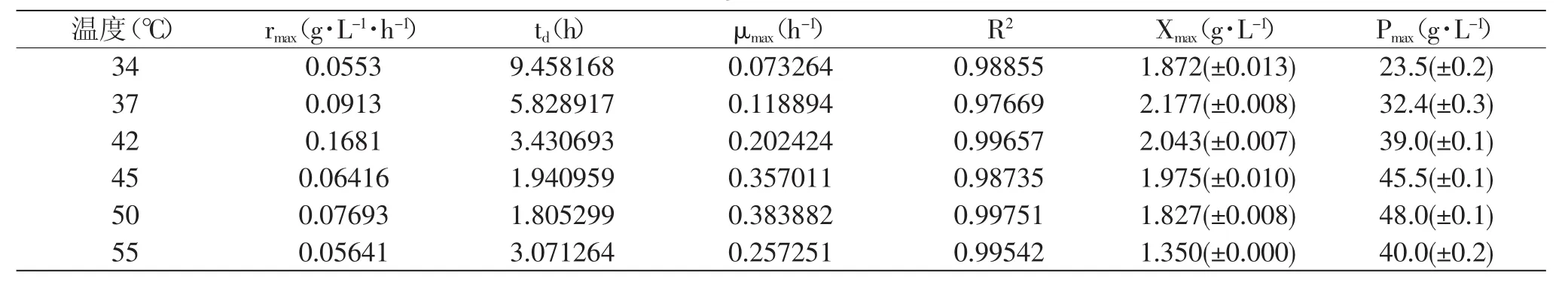
表1 不同温度对Bacillus coagulans CICIM B1821生长和产酸的影响
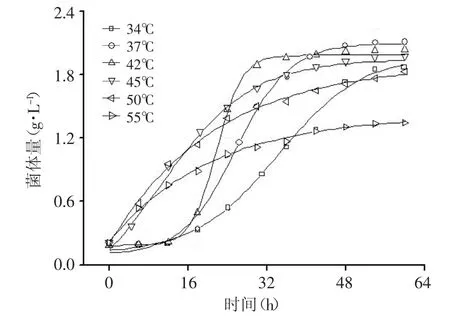
图1 不同温度对Bacillus coagulans CICIM B1821生长的影响

图2 不同温度对Bacillus coagulans CICIM B1821生长速率的影响
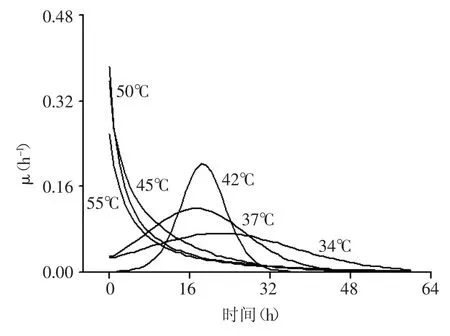
图3 不同温度对Bacillus coagulans CICIM B1821比生长速率的影响
2.2 不同pH对Bacillus coagulans CICIM B1821生长和发酵产酸的影响
对比了不同初始pH对菌体生长和产酸的影响。从图4可以看出,Bacillus coagulans CICIM B1821在5.0~7.0的pH范围内生长和产酸状况差异不大,说明该菌株具有良好的pH耐受能力,可以在较宽的pH范围内正常生长和发酵产酸。pH为6.5时该菌株生长状况和产酸能力相对较强,因此后续发酵罐放大实验中调节pH为6.5。
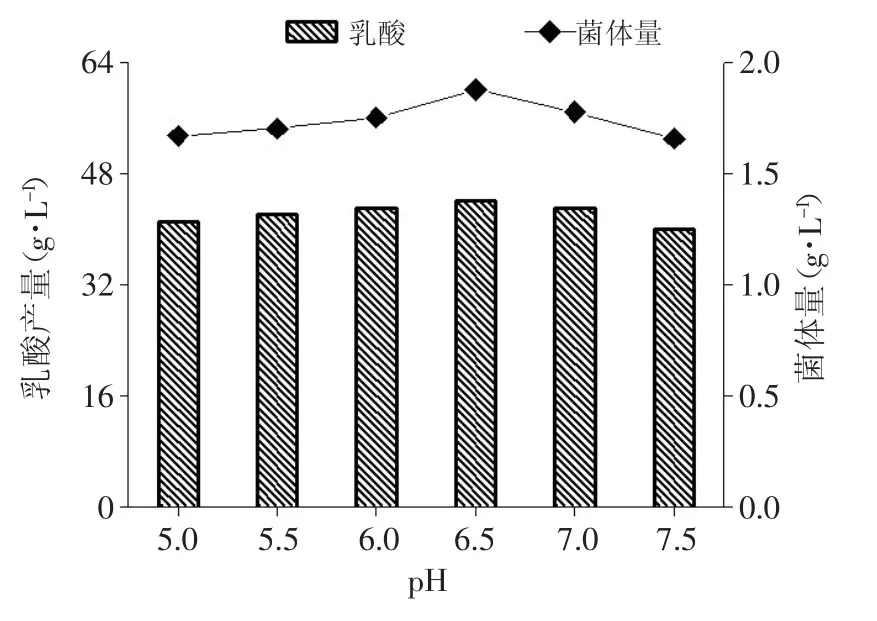
图4 不同pH对Bacillus coagulans CICIM B1821生长和产酸的影响
2.3 不同初始葡萄糖添加量对Bacillus coagulans CICIM B1821生长和发酵产酸的影响
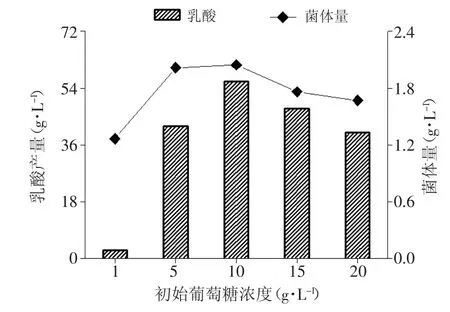
图5 不同初始葡萄糖添加量对Bacillus coagulans CICIM B1821生长和产酸的影响
图5中的菌体量和乳酸产量均为发酵60h结束时测得。1%的初糖很快被消耗,产酸只有2.5g/L。5%的初糖也几乎被完全消耗,产酸42g/L。由于糖浓度适宜菌体生长良好,发酵结束获得较高的菌体量。10%的初糖获得了最高的菌体量和产酸量。发酵结束时,初糖为15%和20%时,残留糖浓度分别为95g/L和153g/L。由于高浓度糖的抑制作用,菌体量和产酸水平均受到影响。
后续发酵罐放大实验中,考察了分批补糖控制残糖浓度不高于10%和20%葡萄糖一次补加两种方式对发酵的影响。

图6 Bacillus coagulans CICIM B1821在充分供氧条件下的生长曲线
2.4 种龄的确定
Bacillus coagulans属于兼性厌氧菌,该菌株可以在氧气充足的条件下快速生长,也可以在氧气不足时缓慢生长。为了获得高活性的菌体接种发酵,确定菌种的种龄就显得尤为重要。从图6中可以看出,50℃条件下,200r/m in充分供氧培养6h,菌种即进入稳定期;对数生长期为2~5h。
确定了种龄,后续发酵实验采用好氧培养6h的种子接种发酵。
2.5 不同生长阶段的菌体对发酵产酸的影响
兼性厌氧菌用于乳酸的发酵生产可以采用两种发酵方式,一种是全程厌氧发酵,菌体缓慢生长同步产酸;另一种是先好氧培养获得高活性的菌体,再进入厌氧发酵产酸阶段。通过考察菌体在好氧条件下的生长状况,针对不同生长阶段菌体活性不同的特点,分别对比了对数生长期前期、对数生长期中后期和未进入对数生长期的三种生长阶段的菌体的产酸情况。
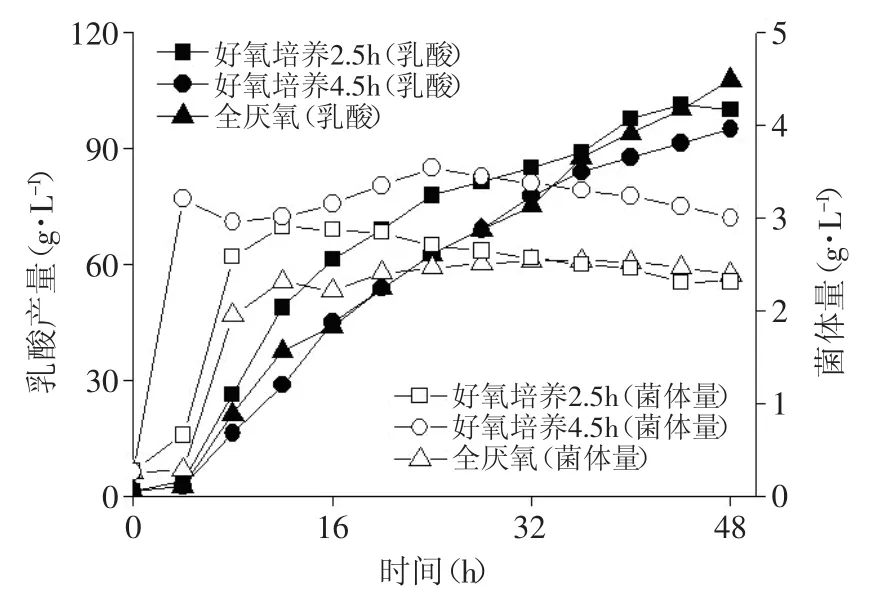
图7 Bacillus coagulans CICIM B1821在不同生长阶段转为厌氧发酵产酸情况的对比
如图7和表2所示,好氧培养4.5h后转为厌氧,菌体活性较高,最终的菌体量也较多,但是产酸速率和最终的产酸量均较低。同时伴生的杂酸较多,葡萄糖对乳酸的得率偏低。好氧培养2.5h后转为厌氧则获得了最高的产酸速率,但是由于仍然伴随着副产物的生成,葡萄糖对乳酸的得率仍低于全程厌氧的发酵方式。
2.6 Bacillus coagulans CICIM B1821利用20%葡萄糖厌氧发酵生产乳酸
前期研究显示,该菌株可以耐受较高浓度的葡萄糖发酵生产乳酸。但是,氧气充足的情况下,该菌株在糖浓度20%的发酵培养基中生长缓慢,延迟期长达30h,而厌氧条件下,该菌株可以利用20%葡萄糖发酵生产乳酸,而且延迟期在10h以内。
在15L发酵罐上,初始装液量9L,初始糖浓度20%,未通氧。发酵100h,乳酸产量达134g/L,残糖4.5g/L,葡萄糖对乳酸的转化率约92%,副产物有丙酮酸、乙酸、丁二酸、甲酸、富马酸和乙醇等,副产物总和低于1.2g/L(见图8和表2)。最高产酸速率为3.81g/L·h,所产乳酸的光学纯度高于99%(见图9)。
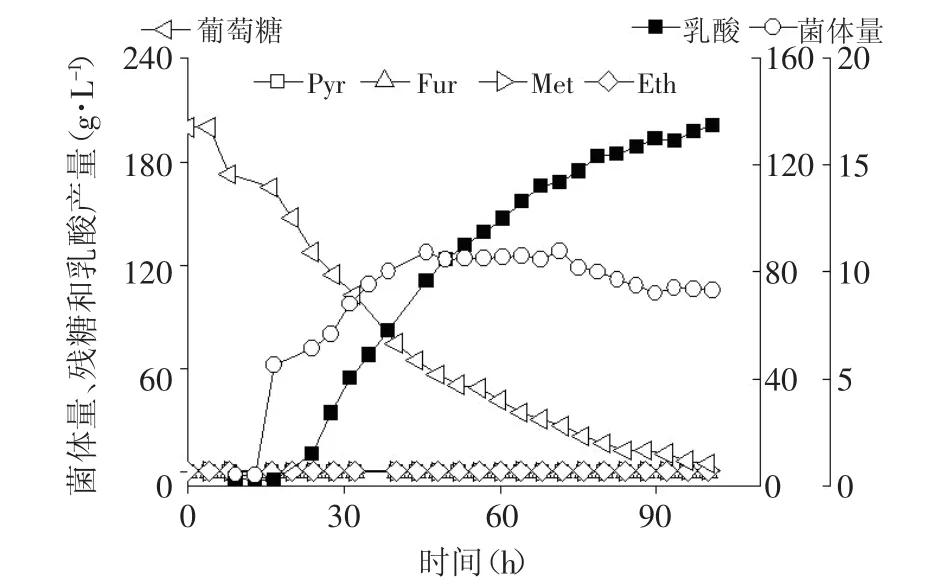
图8 Bacillus coagulans CICIM B1821利用20%葡萄糖厌氧发酵生产乳酸
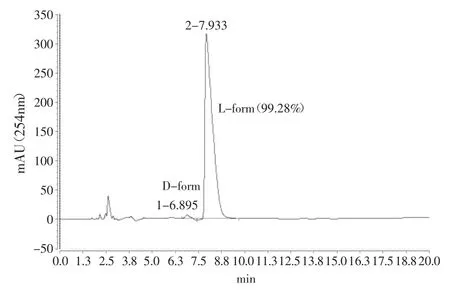
图9 Bacillus coagulans CICIM B1821产L-乳酸的光学纯度
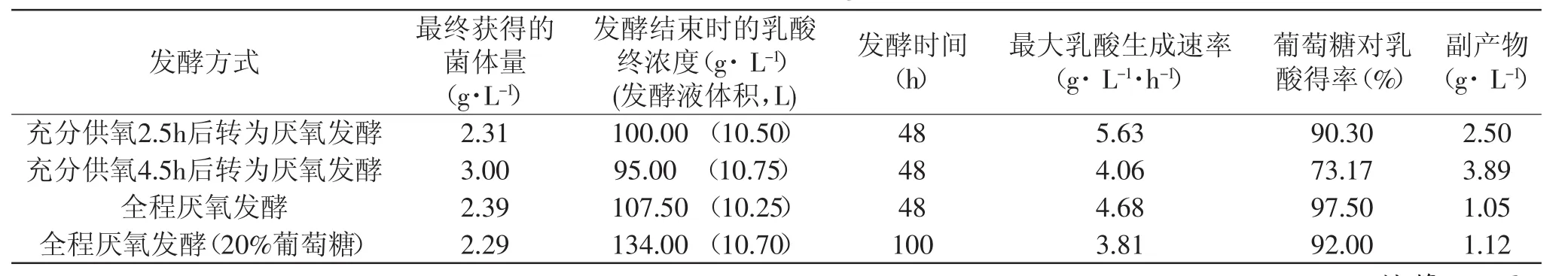
表2 不同生长阶段和不同补料方式对Bacillus coagulans CICIM B1821生长和产酸的影响
3 结论
Bacillus coagulansCICIM B1821是一株优良的L-乳酸产生菌,在适宜的发酵条件下可以用于发酵生产高光学纯度和高化学纯度的L-乳酸。本研究确定了该菌株适宜的发酵产酸温度为50℃,pH调节为6.5,采用全程厌氧发酵工艺,发酵过程中分批补加葡萄糖至终浓度不高于10%,实验中获得最高产酸速率为5.63g/L·h,发酵48h,积累乳酸107.5g/L,副产物总和仅为1.05g/L,葡萄糖对乳酸的得率为97.5%,所产L-乳酸光学纯度高于99%。
采用全厌氧分批补料发酵工艺可以高效制备高光学纯度和高化学纯度的L-乳酸,同时该菌株耐受高浓度葡萄糖发酵生产乳酸的特性也为发酵生产中节约操作成本奠定了基础。
研究显示,凝结芽孢杆菌在25~61℃均可以生长[8]。这一生长特性显示了该菌种优异的适应性和广泛的工业应用潜力。此外,Bacillus coagulans CICIM B1821为野生菌株其自身的生长温度特点也为各种生物材料用于该菌株的遗传改良拓展了空间。Ree等人[7]已成功构建了用于凝结芽孢杆菌和大肠杆菌穿梭表达的质粒载体。同时来源于高温微生物的复制元件也在凝结芽孢杆菌中得到了成功应用,这表明进一步改良凝结芽孢杆菌的产酸特性,以及用于其他产品的发酵生产都有广阔的应用空间。
[1]Isam H Aljundia,Joanne M Belovich,Orhan Talub.Adsorption of lactic acid from fermentation broth and aqueous solutions on Zeolite molecular sieves[J].Chemical Engineering Science,2005,60(18):5004-5009.
[2]QWang,JY Narita,W Xie,et al.Effects of anaerobic/aerobic incubation and storage temperature on preservation and deodorization of kitchen garbage[J].Bioresource Technology,2002,84:213-220.
[3]ZY Zhang,B Jin,JM Kelly.Production of lactic acid from renewable materials by Rhizopus fungi-Minireview[J].Biochemical Engineering Journal,2007,35(3):251-263.
[4]Michelson T,Kask K,Jogi E,et al.L(+)-Lactic acid producer Bacillus coagulans SIM-7 DSM 14043 and its comparison with Lactobacillus delbrueckii ssp.lactis DSM 20073[J].Enzyme Microbiology Technology,2006,39(4):861-867.
[5]周剑,虞龙.产L-乳酸凝结芽孢杆菌发酵条件的初步研究[J].氨基酸和生物资源,2005, 27 (1):70-73.
[6]MV Jones,WN Spencer.Thermostability of enzymes of the tricarboxylic acid cycle of Bacillus coagulans[J].Antonie van Leeuwenhoek,1985,51(2):193-201.
[7]Su RM,Kim JW,Qiao Y,et al.Development of plasmid vector and electroporation condition for gene transfer in sporogenic lactic acid bacterium,Bacillus coagulans[J].Plasmid,2007,58(1):13-22.
[8]AS Ball,C Edwards.Properties of protoplasts from the thermophile Bacillus coagulans and their significance for genetic studies[J].Letters in Applied Microbiology,1989,9(4):141-144.
Study on the production of L-lactate by Bacillus coagulans CICIM B1821
TIAN Kang-ming,SHI Gui-yang,WANG Zheng-xiang*
(Culture and Information Center of Industrial Microorganisms of China Universities,Center for Bioresource and Bioenergy,Jiangnan University,Wuxi214122,China)
Bacillus coagulans CICIM B1821 was selected for L-lactate production.Its optimal growth temperature and fermentation temperature were proved both at 50℃,and Bacillus coagulans CICIM B1821 presents good grow th and fermentation characteristics at temperature range from 34℃ to 55℃.Bacillus coagulans CICIM B1821 presented good grow th and fermentation characteristics at pH range from 5.0 to 7.5.The existence of oxygen was proved increasing both the biomass yield and the by-product concentration.The L-lactic acid purity was above 99%,the yield from glucose to lactate was 97.5%,and the total by-product amount was lower than 1.05g/liter,while the lactic acid concentration was 107.5g/liter during the no oxygen flowing fermentation process with glucose concentration no more the 10%.While fermentation 20%g lucose to lactate,and the total by-product a mount was lower than 1.12g/liter,while the lactic acid concentration was 134g/liter,and the yield from glucose to lactae was 92%.
Bacillus coagulans; thermophile; L-lactate; fermentation
TS201.3
A
1002-0306(2011)10-0245-05
2010-10-28 * 通讯联系人
田康明(1985-),男,在读博士研究生,研究方向:发酵工学。
中非国际合作重点项目(2009DFA31300)。
